Стехиометрия: тарихи шолу, негізгі заңдар және есептеу әдістері


Абай атындағы Қазақ Ұлттық Педогогикалық университеті
Реферат
Тақырыбы: Стехиометрия. Стехиометрияның негізін қалаушы
Орындаған: Сауытбекқызы Балайым
Тобы: Хнк 5\2 топ
Қабылдаған: Утемисова. А
2021-2022 ж
Стехиометрия - заттардың арасындағы массалық және көлемдік қатынастарды қарастыратын химияның бөлімі. Құрылымдық химияның дамуының маңызды кезеңі молекуланың кеңістіктік құрылысын табу болды. Стереохимияның пайда болуына кейде химияға қатесі жоқ көптеген жаңалықтар себепші болды. Стехиометрия түсінігі көбінесе химиялық реакцияға қатысты болады. Егер химиялық реакцияда бастапқы заттар қатаң белгілі қатынаста әрекеттесетін болса, реакция нәтижесінде сол өлшемге дәл сәйкес келетін өнім түзіледі. Ондай реакциялар стехиометриялық реакциялар деп аталады. Әртүрлі қосылыстардың салыстырмалы молекулалық массалары белгілі болса, ол қосылыстардың қандай қатынаста әрекеттесетінін білуге болады. Заттар арасындағы мольдік қатынас - реакцияға қатысатын заттар үшін коэффициенттерді білдіріп, стехиометриялық деп аталады.
1814ж. Огюстен Жан Френель сәуле толқынының тік толқындарға жататынын көрсетсе, 1815ж. француз химигі Жан батист Био заттардың оптикалық белсенділік құбылысын ашты. 1832ж. Берцеллиус бөліп алған изомерлі шарап және жүзім қышқылдары оптикалық изомерияның алғашқы мысалдары болды (шарап қышқылы сәуленің поляризация бетін оңға айналдырады) . 1848ж. француз химигі және биолог Луи Пастер жүзім қышқылының екі антиподтардың - шарап қышқылы мен оның изомерінің қоспасы екенін тапты. Олардың 13 кристалдары ассиметриялы. Ол бұл құбылысты молекуланың ассиметриясымен байланыстырады. 1874ж. дания химигі Якоб Генрих Вант-Гофф оптикалық изомерияны - көміртегі атомының ассиметриялығымен түсіндіру керектігі туралы жорамал ұсынды. Ол көміртегінің төрт валенттілігі ортадан тетраэдрдің төбелеріне бағытталған деген ұстанымды айтты. Ассиметрияның түрі осы бағытталған валенттіліктерге орналасқан атомдарға байланысты болады
Вант-Гоффпен бір мезгілде француз химигі Жозеф Ашиль Ле Бель осындай ойларды топшылады. Вант-Гофф - Ле Бель жорамалы қосылыстардың оптикалық белсенділігін және оптикалық изомерлердің санын болжауға мүмкіндік берді. Осы туралы Вант-Гофф 1875ж. өзінің «Кеңістіктегі химия» кітабында жазған. Алайда, бұл жорамал химик-ғалымдар арасында үлкен пікірталас тудырды. Кекуле мен Кольбе қарсы болса, гипотезаны жақтаушылар қатарында Вильгельм Фридрих Оствальд, Шарль Адолф Вюрц, Альберт Ладенбург болды. Вант-Гоффтың стереохимиялық теориясы 1890 жылдары Пауль Вальден мен Эмиль Герман Фишердің жұмыстары арқасында түбегейлі бекітілді


«Стехиометриялық мөлшер» деген ұғым химиялық реакцияның теңдеуіндегі немесе формуладағы заттың мөлшеріне сәйкес келеді. «Стехиометриялық есептеулерге» заттардың түрлері мен олардың арасында жүретін теңдеулері бойынша әр түрлі есептеулер және оған заттардың түрлері мен химиялық реакциялардың теңдеулерін құрастыру да жатады. Стехиометрияның негізін стехиометриялық заңдар құрайды. Бұларға заттар массасының сақталу заңы, құрам тұрақтылық заңы, эквиваленттер заңы, еселік қатынас заңы, кәлемдік қатынас заңы, Авогадро заңы жатады. Бұл заңдар заттардың атомдар мен молекулалардан тұратынын және атом - молекулалық ілімнің дұрыс екенін дәлелдесе, ал атом молекулалық ілім стехиометриялық заңдардың мәндерін толық түсіндіріп береді.
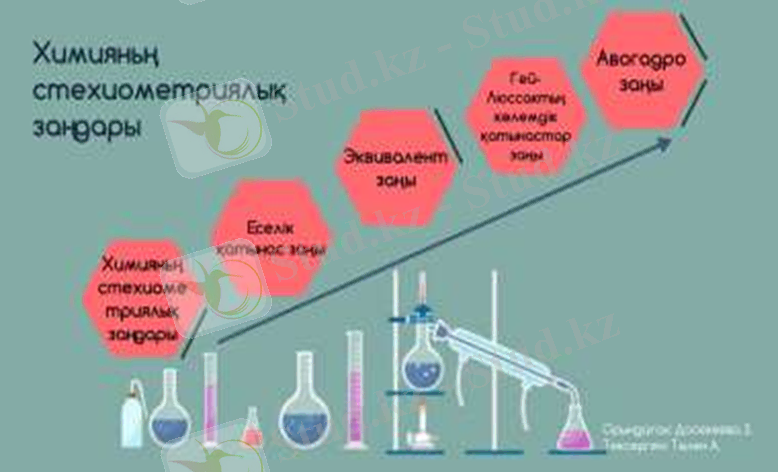
Заттар массасының сақталу заңы . (1748ж. )
Реакцияға қатысқан заттардың массасы реакция нәтижесінде түзілген заттардың массасына тең болады.
Атом-молекулалық ілім тұрғысынан қарағанда реакцияға қатысқан заттардың құрамында қандай атомдар қанша мөлшерде болса, реакция нәтижесінде шыққан заттардың құрамында сондай атомдар сонша мөлшерде болады. Бастапқы заттардың атом саны реакция нәтижесінде түзілген заттардың атом санына тең болады.
4Р + 5О2 = 2P2O5
Заттар массасының сақталу заңы
nA + mB = AnBm
Заттар массасының сақталу заңы заттың сандық құрамын зерттеуге негіз салды. Егер реакцияға қатысқан және реакция нәтижесінде шыққан заттардың массасы тұрақты болса, сол заттардың сандық құрамы да тұрақты болу керек деген пікір туды. Көптеген зерттеулер химиялық таза заттардың сапалық және сандық құрамы тұрақты болатынын көрсетті.
Құрам тұрақтылық заңы (Ж. Л. Пруст, 1808ж. )
Заттар массасының сақталу заңы заттың сандық құрамын зерттеуге негіз салды. Егер реакцияға қатысқан және реакция нәтижесінде шыққан заттардың массасы тұрақты болса, сол заттардың сандық құрамы да тұрақты болу керек деген пікір туды. Көптеген зерттеулер химиялық таза заттардың сапалық және сандық құрамы тұрақты болатынын көрсетті.
Құрам тұрақтылық заңы: Алыну тәсілдеріне қарамастан әрбір химиялық молекулалық қосылыстың сапалық және сандық құрамы тұрақты болады. Мысалы: су молекуласын мынадай әртүрлі тәсілдермен алуға болады.
2H2+ O2 = 2H2O
NaOH + HCІ = NaCІ+H2O
CH4 + 2O2 = CO2+ 2H2O
Қандай жолмен алынса да су молекуласының құрамында 11, 2% сутек, 88, 8% оттек болады. Кейінгі зерттеулер құрамы тұрақты қосылыстармен қатар құрамы өзгермелі қосылыстар да бар екенін көрсетті. Құрамы тұрақты қосылыстар дальтонидтер (H2O HCІ CH4 т. б) құрамы өзгермелілер бертоллидтер деп аталады. Мысалы титан оттекпен бірнеше оксидтер түзеді: ТіО 1, 46-1, 56 және ТіО1, 9-2, 0
Заңның жаңашыл тұжырымы:
Кездесетін жері мен алыну тәсіліне қарамастан әрбір молекулалы құрылысты таза заттың сандық және сапалық құрамы тұрақты болады.
Еселік қатынас заңы ( Дальтон, 1803 ж. )
Егер екі элемент бір-бірімен өзара бірнеше химиялық қосылыс түзсе, онда бір элементтің массасы осы қосылыстардағы екінші элементтің массаларының қатынасы бүтін сандардың қатынасындай болады.
SO SO2 SO3
1 : 2 : 3
Элементтің химиялық эквиваленті дегеніміз сутек атомдарының 1 молімен қосылатын немесе осы мөлшерін қосылыстан ығыстыратын мөлшерін айтады.
Эквиваленттер заңы
Элементтің химиялық эквиваленті дегеніміз сутек атомдарының 1 молімен қосылатын немесе осы мөлшерін қосылыстан ығыстыратын мөлшерін айтады.
Күрделі заттың эквиваленті деп сутектің бір эквивалентімен немесе кез келген басқа заттың бір эквивалентімен қалдықсыз әрекеттесетін мөлшерін айтады.
Эквиваленттік масса дегеніміз заттың 1 эквивалентінің г/мольмен алынған массасы. Эквиваленттік массаның (Э), атом массасы (А) және элементтің валенттілігінің (В) арасындағы байланысты мына формула көрсетеді:
Э = A/B
мысалы, ЭNa= 23 г/моль/1 = 23г/моль ; ЭCa= 40 г/моль /2 = 20 г/моль.
Эквиваленттер заңы: заттар бір-бірімен олардың эквивалентіне пропорционалды мөлшерде әрекеттеседі.
Басқаша тұжырымдамасы: Бір-бірімен әрекеттесетін заттардың массалары (көлемдері) олардың эквиваленттік массаларына (көлемдеріне) пропорционал болады.
Мысалы: сутек атомдарының 1 г/молі натрийдің 23г/молімен, сутек атомдарының 2г/молі натрийдің 46г/молімен әрекеттеседі.
Авогадро заңы (А. Авогадро, 1811 ж. )
Бірдей жағдайдағы (бірдей температура мен қысымда) әртүрлі газдардың бірдей көлемдеріндегі молекулалар саны да бірдей болады.
Авогадро заңынан мынадай салдар шығады:
Бірдей жағдайда әртүрлі газдардың бірдей молекулалары бірдей көлем алады.
Сонымен, кез келген газ молі қалыпты жағдайда 22, 4 л көлем алады.
Көлемдік қатынас заңы (Гей-Люссак)
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz