Калий гидроксидін өндірудің физика-химиялық негіздері, технологиялық схемалары және материалдық балансы


ҚАЗАҚСТАН РЕСПУБЛИКАСЫ БІЛІМ ЖӘНЕ ҒЫЛЫМ МИНИСТРЛІГІ
ҚАРАҒАНДЫ МЕМЛЕКЕТТІК ИНДУСТРИЯЛЫҚ УНИВЕРСИТЕТІ
«ХимиЯЛЫҚ технология ЖӘНЕ экология» КАФЕДРАСЫ
«Жалпы химиялық технология» пәнінен
«Калий гидроксидін өндіру» тақырыбы бойынша
КУРСТЫҚ ЖҰМЫС
Кабылдаған : Арбуз. Г. С .
Орындаған : Ермаханбетова А. Б
Группа: Тфп19К-1
Теміртау, 2020 ж

МАЗМҰНЫ
- Бастапқы шикізаттың сипаттамасы
- Алынатын өнімнің сипаттамасы
- Калии гидроксидін өндірудің негізгі процестерінің физикалық-химиялық негіздемесі
3. 1 Калий гидроксидінің өндірісі
3. 2 Процестің технологиялық схемасының сипаттамасы
- Процестің негізгі технологиялық көрсеткіштерін есептеу
- Материалдық балансын есептеу
ҚОРЫТЫНДЫ
ПАЙДАЛАНЫЛҒАН ӘДЕБИЕТТЕР ТІЗІМІ
КІРІСПЕ
Калий гидроксиді (лат. Kalii hydroxidum) - KOH химиялық формуласы бар Бейорганикалық қосылыс. Түссіз, өте гигроскопиялық кристалдар, бірақ гигроскопия натрий гидроксидіне қарағанда аз. KOH Сулы ерітінділерінде сілтілі реакция бар. Әр түрлі калий қосылыстарын алу үшін сұйық сабын өндірісінде қолданылатын KCl ерітінділерінің электролизімен алынады.
Тривиалды атаулар: каустикалық калий, сондай-ақ калий оксиді гидраты, калий гидроксиді, калий сілтісі.
Калий (Potassium) 1807 жылы ағылшын химигі және физигі Гемфри Дэви ашты, ол қатты, сәл ылғалданған каустикалық калийдің электролизін жасады. Ғалым жаңа металды "Потассий" (Potassium) деп атады, бірақ бұл атау тамыр алмады. Металлдың атасы Гильберт болды, ол калий атауын ұсынды; ол Германия мен Ресейде қабылданды. Екі атау да (Потассий және Калий) металл калийі ашылғанға дейін қолданылған терминдерден шыққан.
1. Бастапқы шикізаттың сипаттамасы
Калий гидроксиді (каустикалық калий) - ақ түсті қатты зат. Өте гигроскопиялық, ыдырамай ериді және қайнайды.
Ол күшті экзо әсерімен суда жақсы ериді, сілтілі орта жасайды.
Калий гидроксидінің негізгі сипаттамалары төмендегі кестеде келтірілген:
Ол жоғары гигроскопиялық, бірақ натрий гидроксидіне қарағанда аз. Ауадан су буын белсенді сіңіреді. Ол суда жақсы ериді, ал жылу энергиясының көп мөлшерін шығарады.
2. Алынатын өнімнің сипаттамасы
Калий гидроксиді тыңайтқыштар, синтетикалық каучук, пластмассалар, аккумуляторларға, реактивтерге, ксантогенаттарға арналған электролиттер өндіру үшін, болат құю құймаларын сілтілендіру үшін, бұрғылау ерітінділерінің сілтілігін белгіленген шектерде ұстап тұру үшін, биодизель отынын өндіруде катализатор ретінде қолданылады, фармацевтика өнеркәсібінде және халық шаруашылығының басқа да салаларында қолданылады.
Төменде пайдаланылатын материалдар мен процестердің мысалдары келтірілген:
-қышқылдарды бейтараптандыру,
-сілтілік элементтер,
-катализ
-жуғыш заттар,
-бұрғылау ерітінділері,
-бояғыштар,
-тыңайтқыштар,
-тамақ өнімдерін өндіру,
-газ тазарту,
-Металлургия өндірісі,
-мұнайды қайта өңдеу,
-әртүрлі органикалық және бейорганикалық заттар,
-қағаз өндірісі,
-пестицидтер,
-фармацевтика,
-РН реттеу,
-калий карбонаты және басқа калий қосылыстары,
-сабын,
-синтетикалық каучук

Тамақ өнеркәсібінде E525 тағамдық қоспасы ретінде белгіленеді. Ол қышқылдықты реттегіш ретінде, кептіргіштер және көкөністерден, тамыр дақылдарынан және жемістерден теріні кетіргіш ретінде қолданылады. Ол сонымен қатар кейбір реакцияларда катализатор ретінде қолданылады.
Метан алу, қышқыл газдарды сіңіру және ерітінділердегі кейбір катиондарды анықтау үшін де қолданылады. Майлы майлармен әрекеттесетін косметикалық өнімдер өндірісіндегі танымал өнім майларды ыдыратады және жуады.
Құрғақ түйіршіктер түрінде немесе гельдер құрамында (натрий гидроксидімен бірге) кәріз құбырларының бітелуін ерітетін агент ретінде. Калий гидроксиді бітелуді реттейді және оны одан әрі құбыр арқылы оңай жылжытуға ықпал етеді. Цирконий өндірісінде фторланбаған цирконий гидроксидін алу үшін қолданылады. Өнеркәсіптік жуу саласында 50-60 °С дейін қыздырылған калий гидроксиді негізіндегі өнімдер тот баспайтын болаттан жасалған бұйымдарды майдан және басқаларынан тазарту үшін қолданылады
Калий гидроксиді-каустикалық, улы және коррозиялық белсенді зат. Ол екінші қауіптілік класындағы заттарға жатады. Сондықтан онымен жұмыс істеу кезінде абай болу керек. Теріге, шырышты қабықтарға және көзге тиген кезде ауыр химиялық күйіктер пайда болады. Калий гидроксидін алудың негізгі әдісі-калий хлоридінің сулы ерітіндісінің электролизі. Электролиз кезінде катодта сутегі иондары шығарылады және сонымен бірге катодқа жақын жерде калий иондары мен гидроксид иондары жиналады, яғни. калий гидроксиді алынады; анодта хлор бөлінеді.
2KCl + 2H2O = H2↑ + Cl2↑ + 2KOH
3. Калий гидроксидін өндірудің негізгі процестерінің физикалық- химиялық негіздемесі
Түссіз кристалдар пайда болады. Ол екі түрлі модификацияда болуы мүмкін: моноклиникалық, 247 °C-қа дейін төзімді және натрий хлоридіне ұқсас текше (a = 0, 533 нм, z = 4, fm3m кеңістіктік тобы) . Балқу температурасы 405 °C, қайнау температурасы 1325 °C, тығыздығы 2, 044 г / см3. Суда еритін - 107 г / 100 мл (15 °C) .
Калий гидроксидін алу:
Өнеркәсіптік масштабтағы калий гидроксиді калий хлоридінің қатты асбест катодымен (өндірістің диафрагмалық әдісі), полимерлі катодпен (өндірістің мембраналық әдісі), сұйық сынап катодымен (сынапты өндіріс әдісі) электролизі нәтижесінде алынады. Соңғы 10 жылдағы әлемдік калий гидроксиді өндірісінің негізгі бағыты-өндірушілердің электролиздің мембраналық әдісіне көшуі. Калий гидроксидінің химиялық қасиеттері. Калий гидроксидінің химиялық реакциялары:
Калий гидроксиді - химиялық белсенді зат, күшті химиялық негіз. KOH Сулы ерітінділерінде қатты сілтілі реакция бар. Калий гидроксидінің химиялық қасиеттері басқа сілтілі металдардың гидроксидтеріне ұқсас. Сондықтан оған келесі химиялық реакциялар тән:
1. калий гидроксидінің натриймен реакциясы:
KOH + Na → NaOH + K (t = 380-450 °C) .
Реакция нәтижесінде натрий гидроксиді мен калий түзіледі.
2. калий гидроксидінің хлормен реакциясы:
2KOH + Cl2 → KCl + KClO + H2O.
Реакция нәтижесінде калий хлориді, калий гипохлориті және су түзіледі. Бұл жағдайда калий гидроксиді суық концентрацияланған ерітінді түрінде бастапқы зат ретінде қолданылады.
3. калий гидроксидінің йодпен реакциясы:
6KOH + 3I2 → 5KI + KIO3 + H2O (t = 80 °C) .
Реакция нәтижесінде калий йодиді, калий иодаты және су түзіледі. Бұл жағдайда калий гидроксиді бастапқы зат ретінде ыстық концентрацияланған ерітінді түрінде қолданылады.
4. калий гидроксидінің алюминиймен және сумен реакциясы:
2Al + 2KOH + 6H2O → 2K[Al(OH) 4] + 3H2 .
Реакция нәтижесінде калий мен сутегі түзіледі. Бұл жағдайда калий гидроксиді бастапқы зат ретінде ыстық концентрацияланған ерітінді түрінде қолданылады.
5. калий гидроксидінің мырыш пен сумен реакциясы:
Zn + 2KOH + 2H2O → K2[Zn(OH) 4] + H2 .
Реакция нәтижесінде натрий тетрагидроксоцинкаты мен сутегі түзіледі.
Өнеркәсіптік масштабта калий гидроксиді калий хлоридінің электролизімен алынады.
Электролиздің үш нұсқасы мүмкін:
қатты асбест катоды бар электролиз (өндірістің диафрагмалық әдісі),
полимерлік катодпен электролиз (мембраналық өндіріс әдісі),
сұйық сынап катодымен электролиз (сынапты өндіру әдісі) .
Электрохимиялық өндіріс әдістерінің қатарында ең оңай және ыңғайлы әдіс-сынап катодымен электролиз, бірақ бұл әдіс металл сынаптың булануы мен ағып кетуінен қоршаған ортаға айтарлықтай зиян келтіреді. Мембраналық өндіріс әдісі ең тиімді, сонымен қатар ең күрделі.

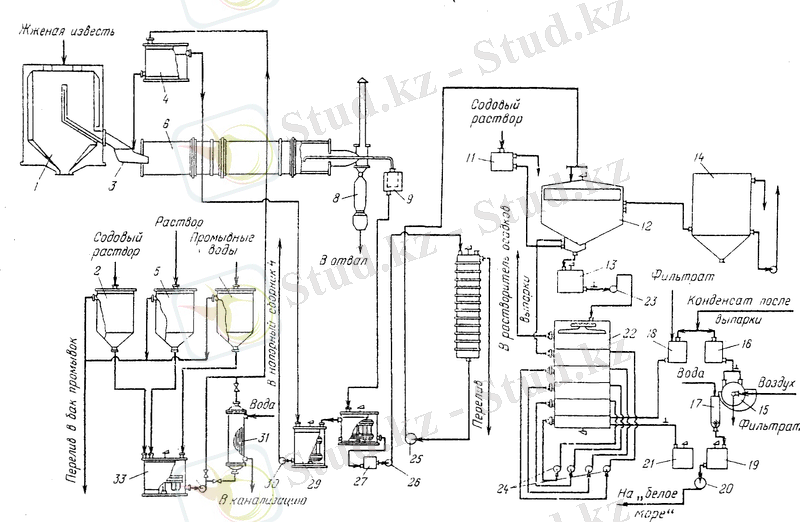
3. 2 Процестің технологиялық схемасының сипаттамасы
Өнеркәсіптік масштабта калий гидроксиді калий хлоридінің электролизімен алынады. Электролиздің үш нұсқасы мүмкін: қатты асбест немесе полимерлі катоды бар электролиз (диафрагмалық және мембраналық өндіріс әдістері), сұйық сынап катоды бар электролиз (сынап өндіру әдісі) . лектрохимиялық өндіріс әдістерінің қатарында ең оңай және ыңғайлы әдіс-сынап катодымен электролиз, бірақ бұл әдіс металл сынаптың булануы мен ағып кетуінен қоршаған ортаға айтарлықтай зиян келтіреді. Мембраналық өндіріс әдісі ең тиімді, сонымен қатар ең күрделі. Диафрагма және сынап әдістері сәйкесінше 1885 және 1892 жылдардан бері белгілі болғанмен, мембраналық әдіс салыстырмалы түрде жақында пайда болды - 1970 ж. Соңғы 10 жылдағы әлемдік калий гидроксиді өндірісінің негізгі бағыты-өндірушілердің электролиздің мембраналық әдісіне көшуі. Сынап электролизі ескірген, экономикалық жағынан қолайсыз және теріс әсер етеді
Калий гидроксидін қолданудың маңызды бағыттарының бірі-жұмсақ сабын өндіру. Калий мен натрий сабындарының қоспалары сұйық сабындар, жуғыш заттар, сусабындар, қырыну кремдері, ағартқыштар және кейбір фармацевтика үшін қолданылады. Қолданудың тағы бір маңызды саласы-әртүрлі калий тұздарын өндіру. Мысалы, калий перманганаты марганец диоксидін каустикалық калиймен біріктіріп, нәтижесінде пайда болған калий манганатын электролиз камерасында тотықтыру арқылы алынады. Калий дихроматын ұқсас жолмен алуға болады, дегенмен ол көбінесе ұсақталған хромит кенін карбонатпен немесе калий гидроксидімен және алынған хроматқа қышқылмен әсер етіп, калий дихроматын түзеді. Калий гидроксиді каустикалық содамен қатар көптеген бояғыштар мен басқа да органикалық қосылыстар өндірісінде, сондай-ақ газдардың адсорбенті, дегидратациялаушы агент, ерімейтін металл гидроксидтерінің тұнбасы, сілтілі аккумуляторларда, түрлі калий қосылыстарын алу үшін.
4. Процестің негізгі технологиялық көрсеткіштерін есептеу
2KCL+H2O→H2↑+CL2↑+2KOH
1. Материалдық баланс .
2KCL+H2O→H2↑+CL2↑+2KOH
Затты әріп белгісіне ауыстыру.
2A+B→C+D+2E
Стехиометриялық тәуелсіз .
Қажетті компонент
Заттың ағындағы мәні
сағ
/сағ
Қателік =
Қорытынды
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz