Бейорганикалық химияның теориялық негіздері: негізгі ұғымдар, стехиометрия, газ заңдары және атом құрылысы


«Бейорганикалық химияның теориялық негіздері» пәні бойынша дәрістер
1. ХИМИЯНЫҢ НЕГІЗГІ ЗАҢДАРЫ МЕН ТҮСІНІКТЕРІ
Химия пәні
Химия пәні материя қозғалысының химиялық формасын зерттейді. Химиялық реакциялар барысында молекулалар құрамындағы бөлшектердің қосылуы, айрылуы, алмасуы, орын басуы нәтижесінде бастапқы заттардың сапасы өзгеріп жаңа сапалы заттар түзіледі және олардың қасиеттері де басқаша болады. Химия дегеніміз - заттардың құрамын, құрылысын, олардың бір түрден екінші түрге айналуын және осы айналу кезінде байқалатын құбылыстарды зерттейтін ғылым.
Атом-молекулалық ілім.
Барлық заттар атом деп аталатын аса кішкене бөлшектерден түзілген.
Молекула - ол сол заттың химиялық қасиеті бар, ең кіші бөлшегі. Молекуланың химиялық қасиеті оның құрамымен және химиялық құрылысымен анықталады. Молекулалар бір, екі және көпатомды бола алады.
Атом - элементтің химиялық қасиеттерін сақтап тұратын ең кіші бөлшегі. Э лементтің химиялық қасиеттері оның құрылысына байланысты. Осы тұрғыдан қарағанда қазір атомға мынадай анықтама беріледі.
Атом - оң зарядталған атом ядросынан және теріс зарядталған электрондардан тұратын электробейтарап бөлшек.
Химияның негізгі түсініктері
Ядро зарядтары бірдей болып келетін атомдардың белгілі бір түрін химиялық элемент деп атайды. Әрбір элементтің аты мен өзінің таңбасы болады. Қазіргі кезде 110-нан астам химиялық элемент белгілі.
Элементтің салыстырмалы атомдық массасы - ол берілген элемент атомының абсолюттік массасы көміртек атомының абсолюттік массасының 1/12 бөлігінен қанша есе көп екендігін көрсететін сан, яғни массаның атомдық бірлігі.
Салыстырмалы молекулалық масса - ол молекуланың орташа массасының молекуланың атомдық бірлігіне қатынасы. Бұл шама өлшемсіз және M r таңбасымен белгіленеді.
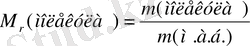
Химияда қарастырылған шамалардан басқа ерекше физикалық шама - зат мөлшері пайдаланылады. Ол осы заттың құрылымдық бөлшектері (атомдар, молекулалар немесе басқа бөлшектер) санымен анықталады. Зат мөлшері (яғни моль саны) латын әрпі n немесе грек әрпі v (ню) арқылы белгіленеді. Ал зат мөлшерін моль бірлігімен өлшейді.
Бір моль заттың массасын оның молярлық массасы деп атайды, оны М әрпімен белгілеп, г/моль деп өрнектейді. Заттың молярлық массасы ( М ) оның массасының зат мөлшеріне қатынасы болып келеді:
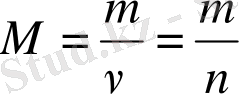
Зат мөлшері n молекуланың (атомның) берілген санының N Авогадро саны N A қатынасына тең:
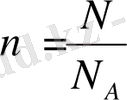
Заттардың жіктелуі.
Химиялық элемент деп белгілі бір қасиеттер жиынтығымен сипатталатын атомдардың түрін айтады. Химиялық элементтер бір-бірімен әрекеттесіп әр түрлі қосылыстар түзеді. Бұл қосылыстарды құрамына қарай жай және күрделі заттар деп бөледі. Жай заттар бір элементтің атомынан түзіледі. Күрделі заттар әр түрлі элементтердің атомдарынан тұрады.
Таза заттар
ЗАТТАР
Заттар қоспасы
Жай заттар
Күрделі заттар
Молекулалары бір химиялық элементтің атомдарынан тұрады
Молекулалары әртүрлі химиялық элементтердің атомдарынан тұрады
F 2 , CI 2 , Br 2 , O 2 , S, N 2 , P, Ca, H 2
N 2 O 5 , NaOH, CuSO 4 , AI 2 O 3 , H 3 PO 4
Әрбір элемент ең болмағанда бір жай зат түзеді. Кейбір элементтер бір емес, екі немесе бірнеше жай заттарды түзуі мүмкін. Бұл құбылысты аллотропия деп атайды.
Аллотропия - ол бір элементтің бірнеше қарапайым зат түзу құбылысы. Бір химиялық элементтен түзілетін бірнеше жай заттарды аллотропиялық түр өзгерістер дейді.
Мысалы, көміртегі химиялық элементі алмаз, графит, карбин деп аталатын үш жай зат түзеді. Алмаз - мөлдір, өте қатты, графит - сұр түсті, үйкегенде із қалдыратын жұмсақ, ал карбин - аморфты күйе тәрізді заттар. Үшеуі де көміртегінен тұратын бұл жай заттардың физикалық қасиетіндегі айырмашылықтар, олардағы көміртегі атомдарының орналасу ретіне байланысты.
Валенттілік. Химиялық формулалар.
Химиялық реакциялардың теңдеулері
Элементтің валенттілігі - ол элемент атомының химиялық байланыс түзе келіп, басқа атомдардың белгілі санын қосып алу қабілеттілігі.
Валенттілік атомдардың түзетін химиялық байланыстарының санымен анықталады.
Кез келген молекуланың құрамын химиялық формуламен өрнектеп көрсетуге болады.
Химиялық формуладағы, молекула құрамына енген элемент атомының қанша екендігін қөрсететін сандарды индекстер дейді. Химиялық формула молекуланың сапалық және сандық құрамын (молекула қандай элементтердің атомдарынан тұратындығын және молекулада осы атомдар саны қанша екендігін) көрсетеді.
Молекуладағы атомдардың қосылу реті мен әрбір элементтің валенттілігін көрсететін формулаларды құрылымдық формулалар дейміз. Бұл формулалардағы валенттілік қысқаша сызықшалармен белгіленеді, ондағы сызықша саны элементтің валенттілігіне тең болуы керек. Енді берілген қосылыстардың құрылымдық формуласын жазайық: AsH 3 , Mg 3 N 2 , K 2 S, SiО 2 , PCI 3 .
H - As - H; K - S - K; Mg = N - Mg - N = Мg; О = Si = О; CI - P - CI
H CI
Химиялық теңдеу - ол химиялық реакцияларды химиялық таңбалар мен формулалар көмегімен өрнектеу.
Мысалы, 2 A1+ 6 HC1= 2 A1C1 3 + 3 H 2
Теңдеудегі формулалар алдына қойылған цифрларды коэффициенттер дейді. Олар реакцияға әрбір заттың қанша молі түсіп, қанша моль өнім түзілгендігін көрсетеді.
Негізгі стехиометриялық заңдар
Стехиометрия - ол әрекеттесуші заттардың массалық немесе көлемдік қатынастары туралы ілім.
Стехиометрияның негізін стехиометриялық заңдар құрайды және бұларға зат массасының сақталу заңы, құрам тұрақтылық заңы, эквиваленттер заңы, еселік қатынас заңы, Авогадро заңы жатады. Бұл заңдар заттардың атомдар мен молекулалардан тұратынын және атом-молекулалық ілімнің дұрыс екенін дәлелдеді.
Массаның сақталу заңы.
М. В. Ломоносовтың масса сақталу заңы : химиялық реакцияға түскен заттардың массасы, реакция нәтижесінде түзілген заттардың массасына тең.
Кез келген түрлену барысында массалар өзгеріске тап болып, энергия бөлінеді немесе сіңіріледі. Масса мен энергия арасындағы мұндай өзара байланысты қазіргі физиканың негізін салушы А. Эйнштейн 1905 жылы көрсетті:
Е = ∆m · с 2
мұндағы Е - энергияның мөлшері;
∆ m - массаның өзгеруі;
с - вакуумдағы жарық жылдамдығы.
Ендеше, массаның сақталу заңы масса мен энергияның сақталу заңының бір түрі болады.
Заттардың құрам тұрақтылық заңы. 1801 жылы француз химигі Ж. Пруст металдардың оксидтері мен сульфидтерін анализдеу негізінде, құрам тұрақтылық заңын тұжырымдады: Қандай жолмен алынған болса да, таза химиялық қосылыстардың сапалық және сандық құрамы әрдайым тұрақты болады.
Еселік қатынас заңы. Ағылшын ғалымы Джон Дальтон 1803 жылы еселік қатынас заңын ашты. «Егер екі элемент бір-бірімен бірнеше молекулалық қосылыс түзетін болса, онда бір элементтің белгілі бір тұрақты массасына келетін екінші элементтің массаларының өзара қатынасы кіші бүтін сандардың қатынасындай болады».
Еселік қатынастар заңы белгілі болған кезден бастап химиялық реакциялар атомистикалық теория тұрғысынан қарастырыла бастады.
Газ заңдары
Көлемдік қатынастар заңы. 1808 жылы Ж. Гей-Люссак көлемдік қатынастар заңын ашты: реакцияласушы және реакциядан шығатын газдардың көлемдерінің өзара қатынасы кіші бүтін сандар қатынасындай болады.
Газдың күйін масса m, көлем V, қысым Р және температурамен T (T=273+t 0 C) сипаттауға болады. Осы шамалардың арасындағы байланыс идеалды газдардың заңдарымен өрнектеледі.
Бойль-Мариотт заңы: тұрақты температурадағы (изотермиялық процесс, Т=cоnst) газдың массасы үшін газ көлемі қысымға кері пропорционалды.
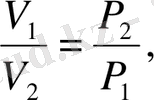 рV = cоnst
рV = cоnst
Гей-Люссак заңы: тұрақты қысымдағы (изобаралық процесс, Р =cоnst) берілген газдың массасы үшін газ көлемі абсолюттік температураға тура пропорционалды.
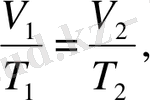
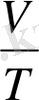 = cоnst
= cоnst
Шарль заңы: тұрақты көлемдегі (изохоралық процесс, V= cоnst) берілген газдың массасы үшін қысым абсолюттік температураға тура пропорционалды.
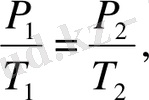
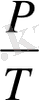 = cоnst
= cоnst
Газдардың көлемдерін тек мына жағдайларда ғана салыстыруға болады: 273К және 101, 3кПа (1 атм) . Бұл температура мен қысымды қалыпты жағдай (қ. ж. ) деп атайды.
Бойль-Мариотт пен Гей-Люксактың біріккен газ заңы. Бұл заң берілген мөлшердегі газ күйін сипаттайтын қысым, көлем және температура арасындағы өзара байланыстарды көрсетеді:
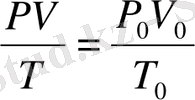
мұндағы P 0 , V 0 , T 0 - қ. ж. кезіндегі газдың қысымы, көлемі мен температурасы.
Қалыпты жағдайдағы 1моль газ үшін
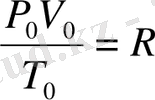 шамасы барлық газдарға бірдей болады және оны
әмбебапты газ тұрақтысы
деп атайды. Оның (
R
) сандық мәні газдың қысым және көлем бірліктеріне тәуелді болады:
шамасы барлық газдарға бірдей болады және оны
әмбебапты газ тұрақтысы
деп атайды. Оның (
R
) сандық мәні газдың қысым және көлем бірліктеріне тәуелді болады:
R=8, 314 Дж/моль ּ К; R=0, 082 л ּ атм/ моль ּ К; R=62, 4 л ּ мм. рт. ст/моль ּ К.
Авогадро заңы.
1811 жылы Италия ғалымы А. Авогадро кейін заңға айналған гипотезасын ұсынды:
Авогадро заңының тұжырымы: бірдей жағдайда алынған әртүрлі газдардың бірдей көлемдеріндегі молекулалардың саны да бірдей болады.
Авогадро заңынан аса маңызды екі салдар туындайды:
- бірдей жағдайдағы әртүрлі газдардың бірдей молекула саны бірдей көлем алады, яғни кез келген газдың 1молі бірдей жағдайда бірдей көлемде болады;
- кез келген газдың 1 молі қ. ж. 22, 4 л көлем алады. Бұл көлемдімолярлық көлем Vmдеп атайды; Vm=22, 4 л/моль.
Газдың молярлық көлемін V m біліп, кез келген газдың көлемін V, моль санын n және массасын m есептеуге болады:
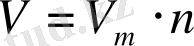
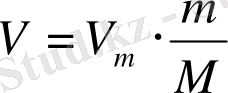
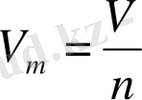
Кез келген заттың тығыздығы ρ - ол осы зат массасының m оның көлеміне V қатынасы:
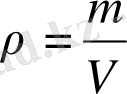
Егер кез келген газдың 1 молін алса, оның массасы молярлық массаға М , ал көлемі молярлық көлемге V m тең болады.
Демек, газдың тығыздығы тең:
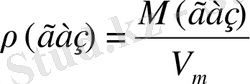
Әртүрлі газдардың бірдей көлемдегі массаларының қатынасы олардың молярлық массаларының қатынасына тең:
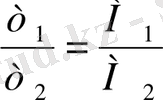
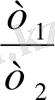 - қатынасы екінші газ бойынша алынған бірінші газдың
салыстырмалы тығыздығы
D
деп аталады:
- қатынасы екінші газ бойынша алынған бірінші газдың
салыстырмалы тығыздығы
D
деп аталады:
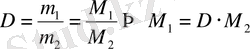
Әдетте, әртүрлі газдардың тығыздығын сутекке (ең жеңіл газ) және ауаға қатынасы бойынша жиі анықтайды.
Кез келген газдың сутек бойынша салыстырмалы тығыздығы тең:
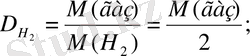 M(газ) = 2 ·
M(газ) = 2 ·

Кез келген газдың ауа бойынша салыстырмалы тығыздығы тең:
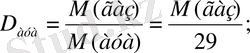 M(газ) = 29 ·
M(газ) = 29 ·
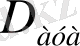
Газдың салыстырмалы тығыздығы - өлшемсіз шама.
Идеалды газ күйі Клайперон-Менделеев теңдеуімен толық өрнектеледі:
 немесе
немесе
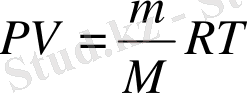
мұндағы Р - газ қысымы;
V - газ көлемі;
Т - абсолюттік температура;
R - әмбебапты газ тұрақтысы;
n - газдың мольдік саны;
m - газ массасы;
М - газдың молярлық массасы.
Эквивалент. Эквивалент заңы
Элементтің эквиваленті деп сутегі атомдарының 1 молімен әрекеттесетін немесе сондай мольді қосылыстан ығыстырып шығаратын заттың мөлшерін айтады.
Мысалы иодсутекте HI сутегінің 1 молімен қосылып тұрғандықтан иодтың эквиваленті 1 мольге, күкіртсутекте H 2 S сутегінің екі молімен қосылып тұрғандықтан күкірттің эквиваленті 1:2 мольге, aммиакта NH 3 cутегінің үш молімен қосылып тұрғандықтан азоттың эквиваленті 1:3 мольге, силанда SiH 4 сутегінің төрт молімен қосылып тұрғандықтан кремнийдің эквиваленті 1:4 мольге тең болады.
Элементтің 1 эквивалентінің массасын оның эквиваленттік массасы дейді, ал ол г/мольмен көрсетіледі. Жоғарыда келтірілген қосылыстардағы иодтың, күкірттің, азоттың, кремнийдің сәйкес эквиваленттік массалары мынадай: 127г/моль, 32:2=16г/моль, 14:3=4, 67г/моль, 28:4=6, 5г/моль.
Қосылыстағы элемент молінің қандай бөлігі сутегі атомдарының 1 моліне эквивалентті екенін көрсететін санды эквиваленттік фактор дейді және оны f экв әрпімен белгілейді. Эквиваленттік фактор өлшемсіз сан, оны 1-ді қосылыстағы сол элементтің валенттілігіне (В) бөлу арқылы табады.
f экв = 1: В
Мысалы, жоғарыдағы келтірілген қосылыстардағы иодтың, күкірттің, азоттың, кремнийдің сәйкес эквиваленттік факторлары мынадай: 1:1; 1:2; 1:3; 1:4.
Бұдан элементтің зквиваленттік массасы Э немесе элемент эквивалентінің 1 молінің массасы элементтің эквиваленттік факторын оның молярлық массасына (М) көбейткенге тең:
Э= f экв ·М
Элементтің эквиваленттік массасын оның эквивалентінің молярлық массасы деп атайды.
Газдар үшін “бір моль эквиваленттің көлемі” түсінігі енгізілген. Бұл шама қалыпты жағдайда тең:
V 1 моль ּ экв. = f экв. ּ 22, 4 л
Эквиваленттік көлем деп осы жағдайда заттың 1 эквивалентіне сәйкс келетін көлемді айтады. Мысалы, қалыпты жағдайда сутегінің 1 эквиваленті (1 г/моль) 11, 2 л, оттегінің 1 эквиваленті (8 г/моль) 5, 6 л көлем алады.
Қышқылдың эквиваленті қышқылдың молярлық массасының оның негізділік санына (металл атомымен орын алмаса алатын сутек атомының саны) қатынасына тең:
М
э қышқыл
=
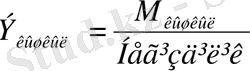
Мысалы,
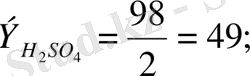
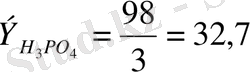
Негіздің эквиваленті негіздің молярлық массасының оның қышқылдық санына (негіз түзетін гидроксид - ионының санына немесе металл валенттілігі) қатынасына тең:
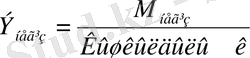
Мысалы,
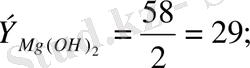
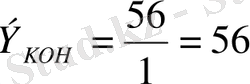
Тұздың эквиваленті тұздың молярлық массасының металдың атом саны (n) мен металл валенттілігі (В) көбейтіндісінің қатынасына тең:
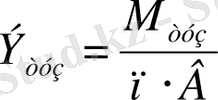
Мысалы,
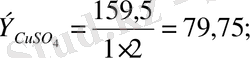
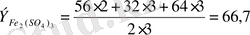
Оксидтің эквиваленті оттек және онымен қосылған элемент эквивалентінің қосындысына тең:
Э оксид = Э элемент + Э оттек , мұндағы Э оттек = 8
3. АТОМ ҚҰРЫЛЫСЫ
Атом құрылысының күрделілігі
ХIХ ғасырдың аяғы мен ХХ ғасырдың басында ашылған физика мен химияның ұлы жаңалықтары: катод сәулелерінің, электролиз құбылысының, радиоактивтіктің ашылуы атом құрылысының күрделі екенін және оның құрамына электрондар кіретінін көрсетті. Электрон - заряды теріс, массасы протон массасының 1/1840 бөлігіне тең бөлшек. Атом электробейтарап бөлшек болғандықтан электрондардың теріс зарядтарын бейтараптап тұратын атом құрамына кіретін оң зарядтар болуға тиіс.
Атом құрамына оң зарядты бөлшектер кіретінін 1911 жылы ағылшын ғалымы Э. Резерфорд тәжірибе арқылы дәлелдеді. Ол α-сәулелерінің шоғырын жұқа металл пластинкасына бағыттап жібергенде, сәулелердің басым көпшілігі металл пластинкасы арқылы өтіп кететіні, тек кейбір α-сәулелерінің бағытын өзгертетінін, ал өте сирек бірен-саран α-бөлшектерінің кейін қайтатынын байқаған. Кейбір α-сәулелерінің кейін қайтуын олардың атом құрамындағы заряды оң бөлшекпен соқтығысуынан деп қана түсіндіруге болады. Орасан көп атомдар арқылы өткен сәулелердің тек кейбіреулері ғана бағытын өзгертеді. Бұдан атомның құрамындағы оң зарядтар шоғырланған бөлшектің көлемі өте кішкентай екенін байқауға болады.
Осы тәжірибе негізінде Э. Резерфорд атомның планетарлық теориясын ұсынды. Бұл теория бойынша атомның ортасында оң зарядталған ядро болады, оны электрондар орбиталар бойынша айналып жүреді.
Атом электробейтарап болғандықтан ядродағы оң зарядтардың саны, оны айналып жүрген электрондар зарядының санына тең. Электрондар массасы өте аз шама болғандықтан, атомның барлық массасы ядроға шоғырланған. Ядроның көлемі атомға қарағанда өте кішкентай. Егер атом, ядро, электрон шар тәрізді десек, атомның диаметрі 10 -10 м, ал ядроның диаметрі 10 -15 м болады, яғни ядро атомнан 1 есе кіші болады.
Бұдан былайғы зерттеулер ядродағы оң зарядтардың саны Д. И. Менделеевтің периодтық жүйесіндегі элементтің реттік нөмеріне тең екенін көрсетті.
Сонымен элемент атомы ядросындағы оң зарядтардың саны және оны айналып жүретін электрондардың саны элементтің реттік нөмеріне тең. Мысалы, кальцийдің периодтық жүйедегі реттік нөмері 20. Бұдан кальций атомының ядросында 20 оң заряд бар екенін және оны 20 электрон электрондық қабаттарда айналып жүретінін білуге болады.
Атомдардың электрондық құрылымы.
Н. Бор ұсынған атом құрылысының теориясы. 1913 жылы Дания ғалымы Нильс Бор сутек атомы құрылысының теориясын ұсынды. Бұл теорияны жасауда ол Э. Резерфордтың планетарлық моделін және М. Планктың сәуле шығарудың кванттық теориясын негізге алды. Кванттық теория бойынша заттар энергияны жеке-жеке порциялар - кванттар түрінде сіңіреді немесе бөліп шығарады:
E=hν,
мұнда h - Планк тұрақтысы, ν - тербеліс жиілігі.
Бор электронның ядроға құламайтын себебі электрон ядроны айналғанда пайда болатын орталықтан тебетін күш mv 2 /r электронның ядроға тартылу күшімен e 2 /r 2 теңестіріліп тұрады деген пікірге келеді
mv 2 /r=e 2 /r 2 , (I)
мұндағы m - электрон массасы, e - электрон мен ядро зарядтары, r - орбитаның радиусы, v - электрон қозғалысының жылдамдығы.
Бұл теңдеуде m мен e-нің мәндері белгілі, ал r мен v-нің мәндері белгісіз. Екі белгісі бар теңдеуді шешуге болмайды.
Классикалық электродинамика бойынша бір дененің орталықтың төңірегіндегі қозғалуы mv ּ 2πr-ге тең қозғалыс мөлшерінің моментімен аяқталады, ал кванттық механика бойынша электрон энергиясы, яғни электрон қозғалысы мөлшерінің моменті бүтін санды квант әрекеттеріне nh тең. Олай болса, мынадай теңдеу құруға болады: mv ּ 2π=nh. (II)
Бұл (II) теңдеуден v мен r-ді тауып, олардың мәндерін бірінші (I) теңдеуге қойсақ, мынадай теңдеулер келіп шығады:
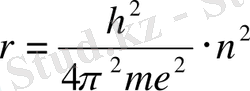 ;
;
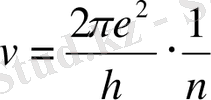
Енді теңдеудегі әріптердің сандық мәндерін (h=6, 62·10 -34 Дж·с, π =3, 14, e=1, 6·10 -19 Кл, m=9, 108·10 -31 кг) қою арқылы тұрақты орбиталдың радиустары (r n ) мен оларды айналатын электрон жылдамдықтарын (v n ) табамыз:
r n = 0, 053 n 2 нм, v n = 2187 1/n км/с,
n - Бор тұрақты орбитасының нөмері.
Келтірілген теңдеулер Бор теориясының I постулатының математикалық көрінісі.
Бордың I постулаты. Электрон ядроның маңайында кез келген орбиталар бойынша емес, тек тұрақты орбиталар бойынша айналады. Бұл орбиталар бойынша айналғанда электрон энергия бөліп шығармайды. Бірінші тұрақты орбита үшін n=1. Олай болса оның радиусы r 1 =0, 053·1 2 =0, 053нм, бұл орбита бойынша айналатын электронның жылдамдығы v 1 =2187/1=2187 км/с.
Екінші орбита үшін n=2, олай болса, оның радиусы r 2 =0, 053·2 2 =0, 212 нм, ал екінші орбита бойынша айналатын электронның жылдамдығы v 2 =2187/2=1093, 5км/с
Бордың II постулаты. Электрон бір тұрақты орбитадан екінші тұрақты орбитаға көшкенде атом квант түрінде энергия сіңіреді немесе бөліп шығарады:
E=hν,
мұндағы, ν-тербеліс жиілігі.
Электрон жақын орбитадан алыс орбитаға көшкенде атом квант түрінде энергия сіңіреді, ал электрон алыс орбитадан жақын орбитаға көшкенде атом энергия бөліп шығарады.
Кванттық механика тұрғысынан атомдардағы электрондардың күйі. Кванттық механика - микробөлшектердің - молекулалардың, атомдардың қозғалыстары мен әрекеттесулерін зерттейді. Кванттық теория бойынша электрон әрі материалдық бөлшектердің, әрі толқынның қасиеттерін көрсетеді.
Оның материалдық бөлшек сияқты белгілі массасы болады, қысым туғызады, сонымен бірге электрондар қозғалғанда толқындық құбылыстар байқалады.
Толқындық қасиеттері бар электрон өте шапшаң қозғалып ядро төңірегіндегі кеңістіктің кез келген бөлігінде бола алады. Сондықтан қазіргі көзқарас бойынша электрон ядро төңірегінде белгілі тығыздығы бар теріс зарядтардың электрон бұлтын түзеді.
Электронның атомдағы күйін 4 квант сандарының мәндері сипаттайды.
1 . Бас квант саны n. Бас квант саны электрондардың жалпы энергия қорын және электрондар орналасқан деңгейлердің ядродан қашықтығын көрсетеді.
Бас квант санының мәндерін бүтін сандармен, ал оларға сәйкес келетін энергетикалық деңгейлерді латынша бас әріптермен белгілейді:
Бас квант сандары 1, 2, 3, 4, 5, 6, 7;
Энергетикалық деңгей K, L, M, N, О, P, Q.
Электрондар орналасқан деңгейлерді электрондық қабаттар дейді. Бас квант сандарының өсуіне байланысты ол деңгейлерде орналасқан электрондардың энергия қорлары да өседі.
2. Орбиталь квант саны l. Энергетикалық деңгейдегі деңгейшелердің санын орбитальдық квант санының мәндері анықтайды. Электрондар орналасқан деңгейшелерді қабатшалар дейді.
Орбиталь квант саны l осы энергетикалық деңгейдегі орбитальдардың мүмкін болатын пішіндерін және сол пішіндерге сәйкес келетін деңгейшелердің сандары мен түрлерін ( s, p, d, f) анықтайды. Орбиталь квант саны бас квант санына тәуелді және бас квант санының n мәніне сәйкес 0-ден n-1-ге дейінгі бүтін сандар болып келетін мәндері болады және оларға деңгейшелер сәйкес келеді:
0, 1, 2, 3 … n - 1
s, p, d, f
Сонымен n=1-ге сәйкес келетін бірінші энергетикалық деңгейде бір s-деңгейшесі болады, оның орбиталының пішіні шар тәрізді болады. Екінші энергетикалық деңгейде n=2 екі (s және p деңгейшелер, ал оларға сәйкес келетін s-орбитальдың пішіні шар тәріздес, p-орбитальдарының пішіні гантель тәріздес болады. Үшінші деңгейде үш деңгейше -s p d, төртінші деңгейде төрт деңгейшелер -s p d f болады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz