Электролиттік диссоциация теориясы, қышқыл-негіз теориялары және диссоциация үдерісінің сандық сипаттамалары


ЭЛЕКТРОЛИТІК ДИССОЦИАЦИЯ ТЕОРИЯСЫ
§1 Электролиттік диссоциация теориясының негізгі қағидалары Электролиттер
Электролит деп ерітінділері не балқындылары электр тогын өткізетін заттарды айтамыз.
Ерітіндіде электр тогын тасымалдаушы бөлшектер - иондар, олай болса, зат молекулаларының полюсті еріткіштер және жоғары температура әсерінен иондарға ыдырауы диссоциация деп аталады.
1887 жылы швеция ғалымы С. Аррениус электролитік диссоцияция теориясын ұсынды, оның қағидалары төмендегідей:
1) негіз, қышқыл, тұзды суға еріткенде молекулалары оң және теріс зарядты иондарға ыдырайды;
2) электр өрісі әсерінен оң зарядты бөлшектер катодқа, ал теріс зарядты иондар анодқа тартылады (катион, анион) ;
3) барлық заттардың иондарға ыдырау дәрежесі бірдей емес, оның сан шамасы ерітуге алынған заттың табиғатына байланысты.
Электролит ерітінділерінің электр тогін өткізетіні және олардың ерітіндісінде зарядталған бөлшектер болу керек деген болжам XIX ғасырдың басынан бар. Бірақ, С. Аррениусқа дейінгі ғалымдар (Гроттус, Фарадей т. т) зат иондарға электр тогі әсерінен ыдырайды деп келді.
Аррениус теориясы бойынша зат молекуласы полюсті еріткіш молекуласы әсерінен иондарға ыдырайды. Бұл ғалым ерітінділердің физикалық теориясын жақтаушы еді, сондықтан заттардың иондарға ыдырау себебі анықталмады. Осыны түсіндіру үшін Д. И. Менделеев жасаған ерітінділердің химиялық теориясымен ұластыру керек болды, бұл жұмысты Каблуков И. А. орындап шықты.
Иондану - еріген заттың еріткіш молекулаларымен әсерлесу нәтижесінде болатын үдеріс, еріткіш молекулаларымен әсерлесіп, сольваттар түрінде жүреді.
Ионды және полюсті ковалентті байланысты қосылыстар тек суда ғана емес, сонымен қатар диэлектриктік тұрақтысы жоғары HCN (∑= 107), HCOOH (∑= 57), R-OH (∑ = 20-35) және т. с. с еріткіштерде диссоциацияланады.
Еріген заттарды диссоциялайтын еріткіштерді иондаушы еріткіштер деп атайды.
Ионды байланысты қосылыстар диссоциациясының механизмі
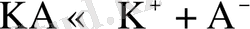
Катиондар гидратациясы донорлы-акцепторлы байланыс бойынша жүреді. Донор - су молекуласындағы оттегі, ал акцептор - катион; анион гидратациясының механизмін сутектік байланыс арқылы түсіндіруге болады.
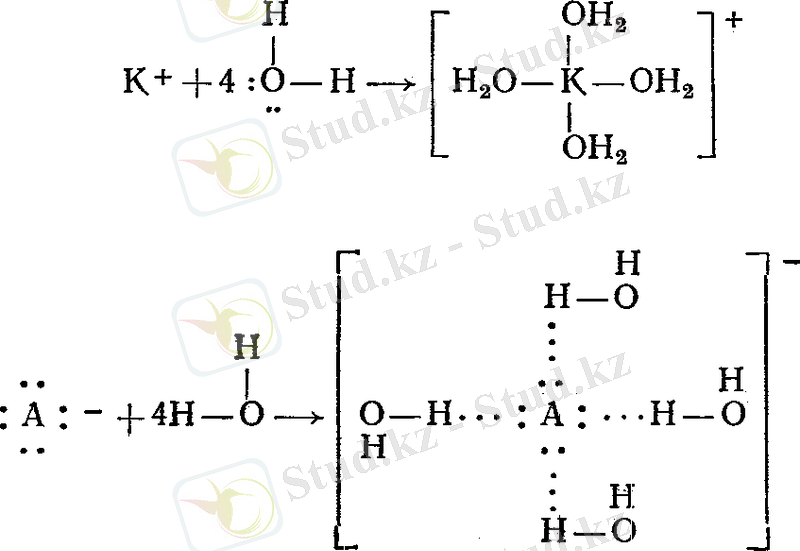
Катиондарды қоршайтын су молекуласының саны (координациялық сан) көпшілік жағдайда ион зарядына екі еселі болады Al 3+ , Cr 3+ , Fe 3+ - к. с. = 6, ал Be 2+ , Zn 2+ иондары үшін к. с. = 4, ал хлор анионы (Cl - ) үшін к. с. = 4.
Мысал ретінде BeCl 2 диссоциациясын қарастырайық:
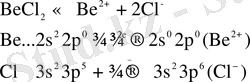
Сонда берилий ионында төрт кванттық ұяшық бос тұрса, хлор ионындағы жұп электрондар және су құрамындағы оттек атомының байланысқа жұмсалмаған жұп электрондары болғандықтан олардың координациялық сандары төртке тең болады:

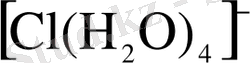 кешенді иондар түзіледі. Көпшілік жағдайда кешенді (акво кешенді) қосылыстар кристалогидраттар
кешенді иондар түзіледі. Көпшілік жағдайда кешенді (акво кешенді) қосылыстар кристалогидраттар
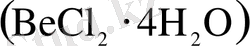 береді.
береді.
Полюсті байланысты молекулалар су молекуласы әсерінен ориентациялық поляризацияға ұшырап, ионға ыдырайды сурет 8. 1 ал, полюссіз байланысты молекулалар иондарға ыдырамайды.
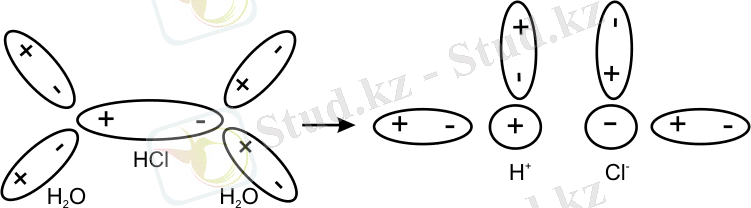
8. 1 - сурет Тұз қышқылы құрамындағы иондардың гидратациялануы
Ионды қоршаушы су молекулаларының саны (координациялық сан) ион радиусы мен зарядына тәуелді болады.
Практикада заттардың диссоциациялану теңдеуін жазғанда иондар гидратациясын есепке алмай (жазуға, есте ұстауға оңай болуы үшін) төмендегідей етіп келтіреді.
Қышқылдар үшін: H x R ↔︎ хH + + R x-
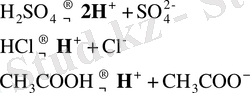
Негіздер үшін:
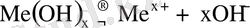
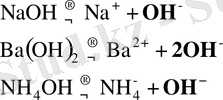
Екідайлы негіздер үшін:
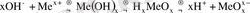
Қышқылдар мен негіздердің қазіргі кезде бірнеше теориясы бар;
Ол мына ғалымдар есімдерімен байланысты: Шатенштейн, Льюис, Измайлов, Бренстед-Лоури, Усанович М. И.
Осы әлемге танымал теориялардың бірінің авторы М. И. Усанович Аль-Фараби атындағы Қазақтың мемлекеттік университетінің (Алматы) физхимия кафедрасының меңгерушісі болған академик. Усанович теориясы бойынша заттың негіздік не қышқылдық қасиеті тек сол заттың қасиетіне ғана байланысты емес, сонымен қатар ол затпен әсерлесетін зат қасиеттеріне де тәуелді болады деп қарастырады. Бұл тұжырым А. М. Бутлеровтың құрылыс теориясымен де үндеседі.
С. Аррениустің электролиттік диссоциация теориясы бойынша электролиттердің анықтамалары төмендегідей болады:
Қышқылдар -заттарды суда еріткенде молекулалары диссоциациялану кезінде сутек катиондары мен қышқыл қалдық аниондарына ыдырайтын заттар.
Негіздер - заттарды суда еріткенде молекулалары диссоциациялану барысында металл катиондарымен (NH 4 + - аммоний ионына) гидроксил аниондарына ыдырайтын күрделі заттар.
Тұздар - заттарды суда еріткенде молекулалары диссоциациялану кезінде негіз және қышқыл қалдық иондарына ыдырайтын заттарды айтады.
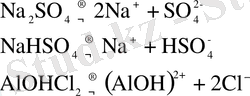
§2 Қышқылдар мен негіздер теориялары
С. Аррениустың электролиттік диссоциация теориясы заттардың судағы ерітіндісіндегі күйін, иондарға ыдырауын қарастырады. Бұл теория қышқылдар мен негіздерге деген қазіргі заманғы көзқарастың негізі болды.
Қышқыл мен негіздің әрекеттесуі сулы ортада мына сұлбамен өтеді:
Қышқыл + негіз = тұз + су
Н х R + Ме(ОН) х = МеR+хН 2 О
Ал, сулы ортадан басқа ортада осыған ұқсатып, реакция сұлбасын былай жазамыз:
Қышқыл + негіз = тұз + еріткіш
Мысалы, аммоний хлориді мен калий амиді әрекеттесуі кезінде мына реакция жүреді:
NH 4 CI + KNH 2 = KCI +2NH 3
қышқыл негіз тұз еріткіш
Қышқылдардың сутектік концепциясын (бір-бірімен байланыссыз өмірге әкелген 1923 жылы Бренстед (Дания) және Лоури (Англия) ) протондық теория бекіте түсті.
Бұл теория бойынша: реакцияларда қышқылдар протондарды беретін болса, ал протондарды қосатын заттарды негіздер деп атады . Қышқыл мен негіздің әрекеттесуін мына сұлбамен көрсетуге болады:
АН + В ↔︎АН . . . В↔︎ А - + НВ +
Реакция жүру үшін аралық сатыда қышқыл құрамындағы сутек пен негіздің арасында сутектік байланыс орнайды десек, негіз - электрон жұптарының доноры, ал қышқыл - электрон жұптарының акцепторы болып табылады (осы түсінікті А. И. Шатенштейн ұсынған еді)
Н 2 О + Н 2 О = (Н - О . . . Н - О) = Н 3 О + + ОН - (1)
негіз қышқыл Н Н қышқыл негіз
Н 3 О + + ОН - = 2 Н 2 О (2)
қышқыл негіз екідайлы зат
Н 2 SO 4 + H 2 O = H 3 O + + HSO 4 - (3)
қышқыл (1) негіз (2) қышқыл (2) негіз (1)
NH 4 + + H 2 O = NH 3 + H 3 O + (4)
қышқыл (1) негіз (2) негіз (1) қышқыл (2)
(3, 4) - реакциялар судың екідайлы қасиетін дәлелдейді.
NH 3 + NH 3 ↔︎ (H 3 N ---HNH 2 ) ↔︎ NH 4 + + NH 2 - (5)
негіз (1) қышқыл (1) қышқыл (2) негіз (2)
NH 2 - + H 2 O ↔︎NH 3 + O H - (6)
негіз (1) қышқыл (2) қышқыл (1) негіз (2)
NH 4 + + NH 2 - → 2NH 3 (7)
қышқыл негіз екідайлы зат
Келтірілген мысалдарда протон бір бөлшектен екіншісіне өтіп, бірі солваттанған оң зарядты ионға, екіншісі-теріс ионға айналады. Оң зарядты мына типтес иондарды H 3 O + , NH 4 + лионий (гидроксоний) , ал OH - -NH 2 - HSO 4 - осы типтесиондарды лиат-иондар деп атайды.
Бренстед-Лоури теориясы бойынша бөлшектердің қышқылдық-негіздік қасиеттері протонды қосу немесе беру қабілеттерін салыстыру арқылы анықталады. Бөлшек неғұрлым протонды оңай берсе, оның қышқылдық қасиеті басым болады, ал оны толықтырушы бөлшектің протонды қосу мүмкіндігі аз болады, мысалы НСІ, Н 2 SO 4 - күшті қышқылдар, олардан протон оңай бөлінеді, ал қышқыл қалдықтары СІ - , НSO 4 2- протонды нашар қосады, сондықтан олар әлсіз негіздерге жатады.
H 3 O + -Н 2 SO 4 - NH 4 + - H 2 O
Қышқылдық қасиет артады
H 2 O - Н 2 SO 4 - - NH 3 - O H -
Негіздік қасиет артады
1923 жылы қышқылдар-негіздер теориясына Т. Н. Льюис өз үлесін қосты. Электрон доноры - негіздер қышқылдардан протонды қосса, электрон акцепторы - қышқылдар негіздерге протондарды береді.
Бренстед - Льюис теориясы бойынша негіздер туралы пікірі бір-біріне сәйкес келсе, Льюис теориясы бойынша қышқылдарға протонды қышқылдардан басқа электрон акцепторлар да жатады: ВF 3 , SO 3 , AlCl 3 , Ag + . Бұл бөлшектер бізге белгілі протонды қышқылдар сияқты индикаторлар түстерін өзгертеді. Бренстед теориясы бойынша қышқыл мен негіздерге электробейтарап бөлшектен басқа иондар да жатады. Мысалы, NH 4 + (қышқыл), Н 2 РО 4 - (қышқыл, негіз), НРО 4 2- (қышқыл, негіз), РО 4 3- (негіз) .
F Н F Н
F В + :N Н F В N Н Н
F Н F Н
қышқыл негіз кешенді комплекс
Льюис теориясы қышқыл мен негіздің әрекеттесуін донорлы-акцепторлы әсерлесу арқылы кешенді қосылыстың түзілуіне әкеледі.
Бұл теорияның кемістіктеріне тоқталсақ:
1) протонды қышқылдар (НСІ, Н 2 SO 4 ) қышқылдық-негіздік әрекеттесу негізінде электрон жұптарын қоспайтынын түсіндіре алмайды;
2) қышқыл мен негіздің күштерін өзара салыстыруға келмейді.
1939 жылы Қазақстандық ғалым М. И. Усанович қышқылдар мен негіздерге қатысты өзінің тоериясын ұсынды. Бұл теория осыған дейін белгілі теорияларды біріктірді.
Қышқылдар деп катиондарын беретін немесе анион мен электронды қосатын бөлшек, яғни негіздерді бейтараптап, тұз түзетін зат.
Негіздер анион мен электрондарды беретін, катиондармен қосылысып тұз түзетін зат деп қарастырады.
Бұл анықтама бойынша біз білетін тотығу-тотықсыздану реакциясы да осы қышқылдық-негіздік әрекеттесуге келіп саяды.
Заттардың қышқылдық-негіздік қасиетттерін анықтау үшін қосылыстағы орталық атомның координациялық қанығу дәрежесін және периодты жүйедегі орнына көңіл бөлу керектігін атап көрсетті.
1952 жылы Р. Малликен қышқылдар мен негіздердің квантты механикалық теориясын ұсынды, ол да Усанович теориясы сияқты жалпылай теория, бірақ күрделірек.
Аталған теориялардың әрқайсысы қышқылдар мен негіздерді әр қырынан сипаттап, бірін-бірі толықтырады.
§3 Диссоциация үдерісінің сандық сипаттамалары
Электролит суда еріп, иондар саны көбейген сайын олар ерітінді ішінде кездесіп, бір- бірін тартып, ассоциациялану үдерісі де жүре бастайды:
диссоциация ↔︎ ассоциация
Еріген молекулалардың қандай бөлігі диссоциацияланғанын көрсететін шама диссоциациялану дәрежесі болып табылады.
Диссоциациялану дәрежесі диссоциацияланған молекулалар санының жалпы суда еріген молекулалар санына қатынасымен анықталады:
(0-1, 0- 100%) (8. 1)
Иондану дәрежесіне байланысты заттарды шартты түрде үш топқа бөледі:
а)
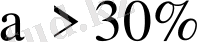 - күшті электролиттер,
- күшті электролиттер,
ә) 3<
 < 30 % - орташа күшті электролиттер
< 30 % - орташа күшті электролиттер
б)
 < 3 % - әлсіз электролиттер
< 3 % - әлсіз электролиттер
Диссоциациялану дәрежесінің мәні белгілі болса, ерітіндідегі иондар концентрациясын мына формуламен анықтауға болады.
C I = C ∙α∙ n (8. 2)
Мұндағы, C I - ион концентрациясы,
C - зат концентрациясы,
α - диссоциялану дәрежесі,
n - ерітіндідегі ионның моль саны (зат мөлшері) .
Диссоциациялану дәрежесінің мәніне сай электролиттерді осылай бөлу шартты түсінік, өйткені бұл шамаға мынадай факторлар әсер етеді:
1) еріткіш пен еріген зат табиғаты (байланыс табиғаты) ;
2) ерітінді концентрациясы С(СH
3
COOH) = 0, 1 моль/л,
 = 1, 3%; С(СH
3
COOH) = 10
-3
моль/л,
= 1, 3%; С(СH
3
COOH) = 10
-3
моль/л,
 = 13, 2%;
= 13, 2%;
3) ерітіндіге қосылатын аттас ион концентрациясына тәуелді,
КtАn ↔︎ Кt + + Аn -
МеАn ↔︎ Ме + + Аn -
егер анионы аттас (бірдей) екінші затты бірінші зат ерітіндісіне қосса, тепе-теңдіктің оңнан солға ығысуына байланысты (Ле- Шателье принципі бойынша) заттың (НАn) диссоциациялану дәрежесі төмендейді,
4) температураға тәуелді:
а) КtАn ↔︎ Кt + + Аn - + Q
∆S ›0 ∆H‹0 ∆G‹0
Егер диссоциация экзотермиялық болса, ол өздігінен жүреді.
Ал, диссоциация эндотермиялық болса:
ә) КtАn ↔︎ Кt + + Аn - - Q
∆S ›0 ∆H›0 онда мына теңсіздік │∆H│ < │T∆S │ орындалуы үшін жоғары температура иондану дәрежесін арттырады.
Заттардың иондану үдерісі, әсіресе әлсіз және орташа күшті электролиттер үшін, қайтымды болғандықтан оны диссоциациялану константасы арқылы сипаттауға болады.

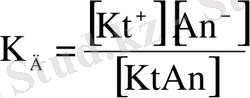 (8. 3)
(8. 3)
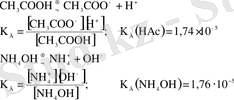
H 3 PO 4 ↔︎ H + + H 2 PO - 4 Kд = 7, 1 ∙10 -3
H 2 PO 4 - ↔︎ H + + HPO 4 2- Kд = 6, 2 ∙10 -8
HPO 4 -2 ↔︎ H + + PO 4 3- Kд = 5, 2 ∙10 -13
Kд 1 > Kд 2 > Kд 3
Диссоциациялану константасы тек зат табиғаты мен температураға тәуелді, концентрацияға тәуелсіз шама. Оның сандық мәні неғұрлым үлкен болса, электролит соғұрлым күшті болады.
Заттың диссоциациялану константасы мен диссоциациялану дәрежесінің арасында байланыс бар. Бұл байланысты анықтау үшін КtАn затының диссоциациясын қарастырайық; КtАn затының концентрациясы С болса, ерітіндідегі иондар концентрациялары:
[Кt
+
] = [Аn
-
] =
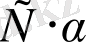 олай болса, диссоциацияға ұшырамай қалған КtАn затының концентрациясы [КtАn] =
олай болса, диссоциацияға ұшырамай қалған КtАn затының концентрациясы [КtАn] =
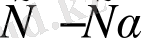 =
=
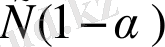 . Енді осы мәндерді диссоциациялану константасының математикалық өрнегіне қойсақ:
. Енді осы мәндерді диссоциациялану константасының математикалық өрнегіне қойсақ:
К
д
=
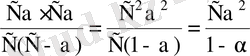 (8. 4)
(8. 4)
Бұл формула Оствальдтың сұйылту заңының (1888ж) математикалық өрнегі деп аталады.
Әлсіз электролиттер үшін
 <<1 болуына байланысты, бөлімін 1-ге тең десек,
<<1 болуына байланысты, бөлімін 1-ге тең десек,
K Д C ∙ , (8. 5)
формуладағы С - ерітіндінің молярлы концентрациясы:
С (Х) =
, сонда:
; (8. 6)
Бұл формула әлсіз электролиттер ерітіндісін сұйылтқанда (көлемі артқанда) диссоциациялану дәрежесінің артатынын көрсетеді.
Күшті электролиттер толық диссоциацияланады, олай болса, олар үшін
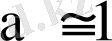 болуы керек, бірақ тәжрибе жүзінде
болуы керек, бірақ тәжрибе жүзінде
 < 1 болады. Бұл қайшылықты 1923 жылы Дебай-Хюккель теориясы түсіндірді. Күшті электролит ерітіндісінде иондар концентрациясы үлкен болады. Диэлектриктік тұрақтысы төмен еріткіш молекулаларымен сольваттанған иондар бір-бірімен электростатикалық күшпен әсерлесіп, иондық «атмосфера» түзіп, олардың еркін қозғалысына кедергі болады. Осыған байланысты тәжірибе жүзінде бөлшек санына байланысты анықталатын шамалар (Δр, Т
қайнау
, Т
қату
) мәндері электролит толық иондалды деп есептеген мәнінен төмен болады. Сондықтан байқалатын концентрацияны Льюис (1907) ұсынысы бойынша активті (белсенді) деп атады. Белсенділік пен нақты концентрация арасында мынадай байланыс бар:
< 1 болады. Бұл қайшылықты 1923 жылы Дебай-Хюккель теориясы түсіндірді. Күшті электролит ерітіндісінде иондар концентрациясы үлкен болады. Диэлектриктік тұрақтысы төмен еріткіш молекулаларымен сольваттанған иондар бір-бірімен электростатикалық күшпен әсерлесіп, иондық «атмосфера» түзіп, олардың еркін қозғалысына кедергі болады. Осыған байланысты тәжірибе жүзінде бөлшек санына байланысты анықталатын шамалар (Δр, Т
қайнау
, Т
қату
) мәндері электролит толық иондалды деп есептеген мәнінен төмен болады. Сондықтан байқалатын концентрацияны Льюис (1907) ұсынысы бойынша активті (белсенді) деп атады. Белсенділік пен нақты концентрация арасында мынадай байланыс бар:
а = f ∙C, (8. 7)
мұндағы а - активтік , f - активтілік (белсенділік) көрсеткіші , С - нақты концентрация. Бұл формуладағы:
1) еріткіштің диэлектрлік тұрақтысы жоғары болса, ерітінді концентрациясы төмен болғанда иондық «атмосфера» түзілуі азайып, f→1, а
 С болады;
С болады;
2) иондардың активтілік көрсеткіші ерітіндінің құрамы мен концентрациясына, ион заряды мен оның табиғатына тәуелді. Сұйылтылған ерітінділерде С≤ 0, 5 моль/л болғанда ионның активтілік көрсеткіші ион заряды мен ерітіндінің иондық күшіне тәуелді.
Ерітіндінің иондық күші ондағы әр ион зарядының квадраты мен моляльдығы концентрацияларының көбейтінділерінің қосындысының жартысына тең болады.
J = (8. 8)
Сұйық ерітінділер үшін иондардың активтілік көрсеткішін шамамен мына формуланы пайдаланып есептеуге болады.
Igf = - 0, 5z 2 (8. 9)
Мұндағы, J - иондық күш, С mi - моляльдық концентрациясы, z i - ионның заряды.
Ерітінділердің иондық күшін анықтау дәлдігі жоғары химиялық және биохимиялық зерттеулер үшін өте қажет.
Кешенді қосылыс диссоциациясына тоқталсақ, ондай қосылыстарды (катионды, анионды) суда еріткенде диссоциация екі сатымен жүреді. Бірінші сатысында сыртқы сфера ішкі сферадан бөлінеді. Cебебі олардың арасында иондық байланыс. Ал, ішкі сферадағы бөлшектердің бір-бірінен ыдырауы қайтымды үдеріс байланыс-ковалентті донорлы-акцепторлы механизммен түзілген. Осы сатысының жүруін сипаттайтын тұрақты шаманы қосылыстардың тұрақсыздық константасы деп атайды. Бұл шаманың сандық мәні неғұрлым үлкен болса, кешенді қосылыс тұрақсыз, ал кіші мәнді болса - тұрақты, берік қосылыс болады.
[Cu(NH 3 ) 4 ] SO 4 → [Cu(NH 3 ) 4 ] 2+ + SO 4 -2
[Cu(NH 3 ) 4 ] 2+ ↔︎Cu 2+ + 4NH 3
[Cu(NH 3 ) 4 ] +2 = 2, 1 ∙ 10 -13
K 2 [Cu(CN) 4 ] → 2K + + [Cu(CN) 4 ] -2
[Cu(CN) 4 ] -2 ↔︎ Cu 2+ + 4CN -
[Cu(CN) 4 ] 2- = 5 ∙ 10 -28
Олай болса, келтірілген мысалда екінші қосылыс біріншісіне қарағанда берік болып саналады, себебі
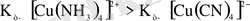 .
.
Күшті электролиттерге суда жақсы еритін тұздар жатады. Ал, қышқылдар мен негіздердің күшті не әлсіз болуы молекуладағы байланыс полюстілігі мен беріктілігіне тәуелді, енді соны қарастырайық.
§4 Оттексіз қышқылдардың және гидроксидтердің қышқылдық-негіздік диссоциациялануы
Оттексіз қышқылдардардың жалпы формуласы - H х R (R - Г, S, Se, Te)
Қышқылдардың күштерін салыстыра болжау үшін мынаны білген жөн.
Бейметалдардың сутекті қосылыстарының судағы ерітінділерінің қышқылдың қасиеттері период бойынша қышқыл түзуші элементтердің электртерістіліктері арту бағытына қарай артады:
NH 3 H 2 O HF AsH 3 H 2 Se HBr
PH 3 H 2 S HCI SbH 3 H 2 Te HJ
Байланысқа түспек электрондар бейметалл атомына қарай көбірек ығысуына байланысты сутек иондары қозғалғыш күйге енеді де, ионға оңайырақ ыдырайды.
Ал, топ бойынша элементтердің кему бағытына қарай қышқылдық қасиет артады.
HF - HCI - HBr - HJ
Оның себебі галогенид иондарының радиустары артады да, сутек ионымен байланыс күші азаяды. Осы заңдылық VI- топшасының элементтері үшін де орындалады.
Ал, элемент оксидтерінің гидраттарды негіздерше және қышқылдарша да диссоциацияланады.
Кесте 8. 1. Негізгі топша элементтерінің гидроксидтері
топ
қасиет
Негіздік қасиеттері артады
Гидроксидтің негіздік-қышқылдық қасиеті оның суда еру кезінде ерітіндіге бөліп шығаратын ионының табиғатына байланысты.
Гидроксид диссоциацияланған кезде оның ерітіндіге бөліп шығаратын иондарының табиғаты мына жағдайларға байланысты:
а) молекуладағы байланыс полюстілігіне (Э - орталық ион) ол - гидроксид түзуші элемент табиғатына;
ә) орталық ионның зарядына;
б) орталық ион радиусына.
Гидроксидтің диссоциациялануын оны түзуші элементтің табиғатына тәуелділігін қарастырсақ:
а) егер Э - типтік металл болса, онда Э - О арасында байланыс өте полюсті болады, және ол О - Н арасындағы байланыс полюстілігінен жоғары болуына байланысты қосылыс негіздерше диссоциацияланады, яғни ерітіндіге гидроксид иондары бөлінеді;
ә) егер Э - бейметалл болса, онда Э - О арасындағы байланыс полюстілігі
О -Н арасындағы байланыс полюстілігінен кем болады да, зат қышқылдарша иондарға ыдырайды;
в) егер Э-дің қасиеті металл мен бейметалл аралығында болса, онда Э - О және О - Н полюстілігі шамалас болуына байланысты жағдайға байланысты екі жақты (екідайлы) қасиет көрсетеді, олай болса ерітіндіге гидроксид иондары да сутек иондары да бөлінуі мүмкін.
1. Период бойынша солдан оңға қарай атом (ион) радиустары кемиді, бейметалдық қасиет артады, олай болса, осы бағытта гидроксидтердің қышқылдың қасиеті артады.
2. Топ бойынша жоғарыдан төмен қарай атом (ион) радиустары артады, осы бағытта металдық қасиет артады, олай болса, осы бағытта гидроксидтерінің негіздік қасиеті артады.
Оттекті қышқылдардың жалпы формуласын ЭО m (ОН) n десек , қышқылдық қасиет n-нің мәніне қарағанда m-нің мәніне көбірек тәуелді.
Э(ОН) n - әлсіз рК = 7-10; ЭО(ОН) n -орташа (рК= 1, 5-4) ;
ЭО 2 (ОН) n - күшті рК= 0-1, 4; ЭО 3 (ОН) n - өте күшті.
m - нің мәні артқан сайын электрон бұлттарының тығыздығы оттекке қарай көбірек ығысады да Н-О арасындағы байланыс әлсіреп, қышқылдық күші артады.
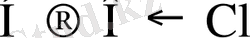
НОСl

(HOClO) HClO 2
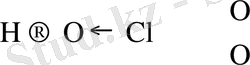
(HOClO 2 ), HClO 3
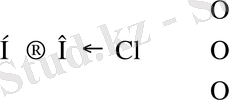
(HOClO 3 ), HClO 4
Олай болса, қышқылдық қасиет мына қатар бойынша артады:
НОСl- HClO 2 - HClO 3 - HClO 4 , яғни:
3. Гидроксид түзуші элемент атомының қосылыстағы тотығу дәрежесі неғұрлым жоғары болса, оның қышқылдық қасиеті соғұрлым басым болады екен.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz