Молекулалық-кинетикалық теория және термодинамиканың негіздері


Молекулалық-кинетикалық теория
мен оның әдісі.
Жылулық құбылыс екіге бөлінеді: Термодинамикалық және молекула- кинетикалық.
Термодинамика дегеніміз - заттың ішкі құрылымын ескермей, энергетикалық түрлендірудің негізінде жылулық құбылыстарды зерттейтін физиканың бөлімі.
Молекула-кинетикалық теория осы жылулық құбылыстарды- қозғалыстарды Ньютон заңдарына бағынатын молекулалар мен атомдардан тұрады деген болжам негізінде қарастырады.
Зат құрылымының молекулалы-кинетикалық құрылымы теориясын (МКТ) көптеген бақылаулар мен тәжірибелердің жалпылама қорытындысы ретінде М. В. Ломоносов жасады. Оның негізгі қағидаларын атап өтейік:
- Барлық денелер микробөлшектерден (атомдардан немесе молекулалардан) тұрады әрі дененің массасы өзін түзетін микробөлшектердің массаларының қорытындысына тең: m=m0N
- Денедегі микробөлшектер үздіксіз және хаосты қозғалыста болады. Бұл қозғалыстың жылдамдығы дене температурасына тәуелді. Сондықтан жылулық қозғалыс деп атайды.
- Денендегі микробөлшектер өзара әрекеттеседі. Дене бөлшектерінің арасында тебілу және тартылу күштері бар.
Молекула кинетикалық теорияның негізгі қағидаларының тәжірибелік дәлелдемелері:
- Заттардың бөлінгіштігі (физикалық, химиялық қасиеттері өзгеріссіз қалады) . (ақ қағаз, қайшы)
2. Газдардың сығылғыштығы. Газ кез-келген көлемді алады. (дене молекулаларының арасында үлкен қашықтық бар (шприц, насос)
3. Газ өзі тұрған ыдыс қабырғасына қысым түсіреді. Бұл молекулалардың қозғалыста болғанын көрсетеді. (Баллон суреті)
4. Диффузия- бір заттың молекулаларының екінші заттың молекула аралық кеңістігне еніп кетуі. (иіс су, су, маргансофка, қант) . Диффузия неге тәуелді? Ол дене температурасын және агрегаттық күйіне тәуелді.
5. Молекулаларды электрондық микроскопта және иондық проекторда бақыланады.
6. Денелерді беріктігі микробөлшектердің өзара тартылатынын білдіреді. (ағаш апару керек)
7. Дененің серпімді диформация қасиеттері бар. (серіппе, резина)
8. Броундық қозғалыс- сұйықта немесе газда қалқып жүрген қандай да бір қатты заттың өте ұсақ бөлшектерінің сұйық немесе газ молекулаларының соққыларының әрекетінен бейберекет қозғалуы. Ашқан ғалым ағылшын ботанигі Броун.
9. Молекула жылдамдықтарын анықтау. 1920 жылы О. Штерн тәжірибе жасады. Штерн тәжірибесінің формуласы
V 2 = 3RT/m
Идеал газдардың негізгі заңдары.
Идеал газ деп молекулалар арасында өзара әсерлесу күштері болмайтын, жеке молекулалар көлемі ыдыс көлемімен салыстырғанда өте аз, тіпті оны еске алмауға да болатын және молекулалар арасындағы өзара соқтығысу абсолют серпімді болатын газдарды айтады. Молекула-кинетикалық теория ашылғанға дейін идеал газдар қасиетін сипаттайтын көптеген зандар болған.
Бойль-Мариотт заңы. Газ күйіндегі заттардың меншікті көлемі болмайды. Сондықтан газдар ыдысқа толтырылғанда, сол ыдыстың көлемін толық алып тұрады және ыдыс қабырғаларына белгілі бір қысым күшін түсіреді. XVII ғасырдың ортасында ағылшын ғалымы Р. Бойль (1627-1691) және француз физигі З. Мариоттың (1620-1684) бір-біріне тәуелсіз жасаған тәжірибе қорытындылары температура тұрақты болғанда газ көлемінің (V) оның қысымына (р) тәуелді өзгеретінін тұжырымдады, яғни берілген газ массасы үшін тұрақты температурада оның қысымы көлеміне кері пропорционал өзгереді, яғни:
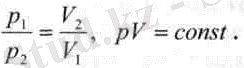
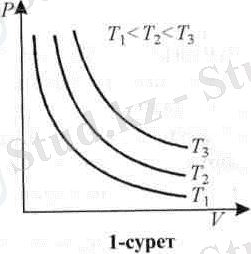
Бұл тәуелділікті изотерма деп аталатын гипербола қисығымен көрсетуге болады (1-сурет) . Газ күйінің бір күйден екінші күйге тұрақты температурада өтуі изотермалық процесс деп аталады. Ал нақты газдар бұл заңдылыққа тек тығыздықтары өте аз болғанда ғана бағынады. Сонымен, тұрақты температурада р мен V тәуелділігі заттар қасиетін сипаттайды.
Гей-Люссак заңы.
Газ көлемінің (V) оның температурасына (7) тұрақты қысымда (р = const) тәуелді болу шартын бірінші рет француз ғалымы Гей-Люссак (1778-1850) тағайындады: берілген газ массасы үшін 0ысым тұрақты болғанда, газ көлемі оның температурасына сызықты тәуелді өзгереді (р = const, т = const) :
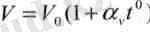
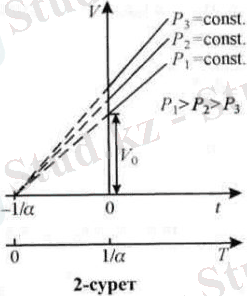
мұндағы: V0 - газдың 0°С - тағы көлемі, av - газдың көлемдік ұлғаюының термиялық коэффициенті. Тұрақты қысымда газ көлемі мен температураның тәуелділігі графикте түзу сызықпен көрсетіледі. Қысымның әрбір мәніне сәйкес келетін түзу сызық изобара деп аталады (2-сурет) . Ал газ күйінің тұрақты қысымда өзгеруі изобаралық процесс делінеді.
Шарль заңы. Тұрақты көлемде газ температурасының қысымға тәуелді болатыны да анықталады, яғни берілген газдың массасы үшін көлемі тұрақты болғанда, газ қысымы оның температурасына сызықты тәуелділікте өзгереді.
Сонымен, молекула-кинетикалық теория заттың күйлерін және ондағы байқалатын құбылыстарды молекулалар арасында әсер ететін күштермен байланыстырады. Молекулааралық күштердің табиғаты эксперименттік зерттеулер мен теориялық болжаулар нәтижесі арқылы айқындалады. Мысалы, газдардың сұйыққа айналуы, үлкен қашықтықтарда молекулалар арасында тартылыс күштері, ал сұйықтың сығылуға қатты карсылығы, жақын қашықтықта тебу күштері болатынын дәлелдейді және қашықтыққа қатысты бұл күштер қатты өзгереді. Термодинамикалық жүйе деп термодинамикалық тепе-теңдік күйде болатын макрожүйелерді айтады. Тепе-теңдік күйдегі жүйені сипаттайтын шамаларды P, V, T термодинамикалық параметрлер деп атайды. Егер жүйенің кез-келген параметрлері уақыт бойынша өзгеретін болса, онда жүйеде процесс жүреді. Процесс деп жүйенің күйінің өзгерісін де айтады. Жүйенің бір күйден екінші күйге өтуі, жүйенің тепе-теңдік күйден шығуымен байланысты болады. Демек, жүйе қандай да бір процесс жүрген кезде тепетеңдік емес күйлерінің тізбегінен өтеді.
Термодинамика пәні мен әдісі
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz