Ерітінділердегі қышқылды-негіздік тепе-теңдік және буферлік жүйелер: рН, рК және активтік қышқылдық



СӨЖ
ТАҚЫРЫБЫ: Коллоидтық жүйелердің электрлік қасиеттері
ОРЫНДАҒАН: Нұрсұлтанқызы М.
Факультет: Фармация
Топ: 201 А
ТЕКСЕРГЕН: Тулегеннова Г.
АЛМАТЫ 2018 ж
Жоспары:
1. Ерітінділердегі қышқылды-негіздік тепе-теңдік
2. Судың иондық көбейткіші. рН және рК туралы ұғым.
2. 1 Сутектік көрсеткіш.
2. 2 рК туралы ұғым.
3. Активтік және аналитикалық (титрлік) қышқылдылық.
4. Буферлік қоспалар.
- Ерітінділердегі қышқылды-негіздік тепе-теңдік
С. Аррениустың электролиттік диссоциациялану теориясына сәйкес қышқылдық қасиетті сутек иондары (Н+ ), ал негіздік қасиетті гидроксид-иондары (ОН- ) көрсетеді. Алайда бұл теория гидроксид-иондары болмайтын кейбір заттардың неге негіздік қасиет көрсететінін түсіндіре алмайды. Мысалы, аммиак кез келген негіз сияқты тұз қышқылын бейтараптайды да аммоний хлоридін түзеді.
1923ж Бренстед пен Лоури қышқылдар мен негіздердің тағы бір жалпы теориясын ұсынды.
Бұл теория бойынша протондардың кез келген доноры- қышқыл, ал акцепторы- негіз болады, яғни қышқыл дегеніміз сутек иондарын беретін, ал негіздер - сутек ионын қосып алатын заттар. Мысалы, хлорсутек сумен әрекеттескенде.
HCl + H 2 O = H 3 O + + Cl -
HCl молекуласы су молекуласына сутек ионын береді, ал су оны қосып алады. Сондықтан, бұл жерде HCl - қышқыл, ал су - негіз болып тұр. Кері реакцияны, яғни гидроксоний ионы протонды беріп, қышқылдық қасиет көрсететін реакцияны былайша өрнектеуге болады;
H 3 O + + Cl HCl + H 2 O
Мұндағы гидроксоний ионын (H 3 O + ) H 2 O негізімен қосақтасқан қышқыл ол хлорид ионын (Cl- ) HCl қышқылмен қосақтасқан негіз деп атау қабылданған.
Сонда HCl-дың сумен әрекеттесуін мынадай тепе-теңдік реакция түрінде көрсетуге болады: HCl + H 2 O = H 3 O + + Cl -
Қышқыл немесе негіз арасындағы барлық реакциялар қышқылды-негіздік жұптар түзеді. Бірнеше мысалдар қарастырып, оларды былайша көрсетуге болады:
HNO 3 +H 2 O = H 3 O + +NO 3 - (a)
HCl+NH 3 = NH 4 + +CІ - (ә)
H 2 O+NH 3 =NH 4 + + OH - (б) OH
H 2 SO 4 +CH 8 COOH ↔︎CH 3 C ̶ OH+SO 4 H - (в)
CH 3 COOH+ H 2 O↔︎ H 3 O + + CH 3 COO - (с)
1-қышқыл 2-негіз 2-қышқыл 1-негіз
Мұндағы а-және с-теңдеуіндегі Н2О-негіз де, ол б-теңдеуінде Н2О қышқыл болып тұр. Сірке қышқылының реакцияларында суға қарағанда қышқылдық (с), ал күкірт қышқылына қарағанда негіздік (в) қасиет көрсетіп тұр.
1-қышқылдың протонға деген ынтықтылығы артқан сайын Кп. т артады. Сол себепті сірке қышқылы күшті қышқылдардан, мысалы күкірт қышқылынан (в-рекциясын қара) протонды алуға қабілетті. Мұндай реакцияларда сірке қышқылы негіздік қасиет көрсетеді.
Радиусы аз және қозғалғыштығы үлкен болғандықтан протон бір заттан оңай өте алады. Судың протонға деген ынтықтылығы өте жоғары (Q= 1087, 8 кДж/кг) . Сол себепті көптеген заттар суға протон береді. Протонды беру процесі қайтымды. Мысалы, с- реакциясындағы тіке бағытта сірке қышқылының молекуласы протонды негіз ретінде болатын су молекуласына береді, ал кері бағыттағы реакцияда гидроксоний ионы (H 3 O + ) қышқыл болады да ацетат-ионы негіз болады. Вант-Гоффтың ұсынған химиялық реакция изотермасының теңдеуіне сәйкес диссоциациялану протонға ынтықтылықты сипаттайды
∆G=-RT(lnK
П. Т.
-
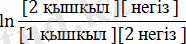 ) (1)
) (1)
Мұндағы квадраттық жақша соңғы және бастапқы заттардың концентрациялары, Кп. т - протолиттік тепе-теңдіктің константасы.
Сонымен, заттың қышқылдық және негіздік қасиеттері оның молекуласының қасиетіне ғана емес, сонымен қатар оның әрекеттесетін заттарының молекулаларының қасиеттеріне де байланысты. Ерітінділерде қышқылды-негіздік қасиеттер ең алдымен еріткішпен әрекеттесуімен анықталады. Мысалы, тұз қышқылында (100%-дық сірке қышқылын күшті қышқылдардың қасиеттері мына қатар бойынша кемиді:
HClO4> HBr > H2SO4 > HCl > HNO3
Бұл осы қышқылдардағы протонға ынтықтылықты білуге мүмкіндік береді. Бұл көрсетілген қышқылдар мен негіздердің күші олардың протонды беру, иә қосып алу қаншалықты оңай болатынына байланысты. Қышқыл неғұрлым протонды оңай берсе, соғұрлым күшті болады, керісінше негіз неғұрлым протонды оңай қабылдаса, соғұрлым күшті болады.
Протонды алып-беру арқылы жүретін реакцияларды протолиттік реакциялар деп атайды. Олар әсіресе сулы ерітінділерді қышқылдар мен негіздерге тән болады.
2. Судың иондық көбейткіші. рН және рК туралы ұғым. 2. 1 Сутектік көрсеткіш.
Химиялық таза судың диссоциациялануының тепе-теңдігін былайша көрсетуге болады:
- H2O + H2O ↔︎ H3O++ ОН-
1-қышқыл 2-негіз 2-қышқыл 1-негіз (2)
Судың протолиттік константасы өте аз шама. Мысалы, 25 0 С-де ол мынаған тең:
- КЕ. К. =[H3O+] [ОН−] [H2O] 2\frac{\lbrack H3O + \rbrack\ \lbrack ОН - \rbrack}{\lbrack\ H2O\rbrack 2}= 3. 24*10-18 (3)
Сондықтан (3) - теңдеудегі судың концентрациясы тұрақты шама. Оны 1л-дегі моль мөлшерімен өрнектесек мынадай болады:
- {H2O} = 18 1000 = 55. 56 моль/л
(2) -теңдеу бойынша Н3О + және ОН- иондарының концентрациясы өзара тең. Ендеше (3) -теңдеуді былайша жазуға болады.
- [H3O+] [ОН-] =(55. 56) 2 * КЕ. К. = Кс(4)
Бұл тұрақты шама су иондарының көбейтіндісі деп аталады. Су иондарының көбейтіндісі (К с ) судың протолиттік тепе-теңдігінің константасымен шатастырмаған жөн, соңғы шама біріншісінен (55, 56) 2 есе аз.
Егер (4) -теңдеудегі КЕК мәнін қоятын болсақ, онда 250С К с -ның сандық мәні мынаған тең болады.
- Кс= (55, 56) 2*3, 24*10-18= 10-14
Протолиттік тепе-теңдік константасы судың диссоциациясының константасынан өзгеше болады. Ол өзгешелікті мынадан көруге болады. Протолиттік реакция мынадай түрде жазылады:
H 2 O + H 2 O ↔︎ H 3 O + + ОН - , немесе H 2 А + H 2 O ↔︎ H 3 O + + ОН - + А -
Мұндағы НА-қышқыл, А-анион, С. Аррениус теориясы бойынша электролиттік диссоциациялану реакциясының теңдеуі былайша жазылады:
- H2O ↔︎ H++ ОН-(немесе H++ А-)
К Е. К. = және К К = болғандықтан К Е. К және қышқылдың диссоциациясының термодинамикалық константасының қарым- қатынасы былайша өрнектеледі:
- КК= КЕ. К[ H2O] (5)
Яғни К К К Е. К ке қарағанда 55, 56 есе көп болады.
- КК, Н2О= КЕ. К[ H2O] =3, 24*10-1855, 56 * = 1, 8*10-18
К К -ның мәндері анықтамаларда беріледі.
Келесі есептеулерде К К шамасын және [H 3 O + [-ның орнына [H + ] - ны қойып жазамыз. Судың диссоциациялану эндотермиялық процесс сондықтан температура артқан сайын К 0 -ның мәні көбейеді.
Су диссоциацияланғанда H + және ОН-тың бірдей мөлшері түзілетіндіктен 25 0 С-де олардың концентрациясы 10 -7 г/ион/л-ге тең.
- [H+] =10-14= 10-7г/ион/л[ОН-]
Су иондарының көбейтіндісі - белгілі бір температурада тек суда емес, кез келген қышқыл, сілті және тұздардың сулы ерітінділерінде тұрақты шама. Ендеше, егер кейбір қышқылды қосқанда сутек иондарының концентрациясы қаншалықты артса, оған сәйкес гидроксид иондарының концентрациясы соншалықты азаяды. Нәтижесінде иондарының концентрациясының көбейтіндісі өзгермейді. Сол себепті иондарының бірінің концентрациясын екіншісінің концентрациясы белгілі болған жағдайда мына формуламен есептейді:
- [H+] =10-14; [ОН-] =10-14; (6) [ОН-] [H+]
Сонымен сулы ерітінділер сутек ионы да, гидроксид ионы да болады, олардың иондарының көбейтіндісі 25 0 С-де тұрақты және 10 -14 -ке тең болады.
Әдетте [H + ] -тың шамасы аз болады. Мысалы, адам организмінің ең қышқыл сұйықтығы асқазан сөлінде 188 [H + ] концентрациясы 10 -1 г-ион/л, ал түкірікте [H + ] -тың концентрациясы шамамен 10 -5 г-ион/л және т. б.
1920 жылы В. Соренсен сутек иондарының концентрациясын ыңғайлы етіп өрнектеу үшін сутек иондарының концентрациясының ондық логарифмінің теріс таңбасын алуды ұсынды. Бұл шама сутектік көрсеткіш деп аталады және былай өрнектеледі. Яғни сутектің көрсеткіш сутек иондарының концентрациясының теріс иондық логарифмі.
Таза су үшін 25 0 С-де рН=-lg 10 -7 =7. Қышқылдық сұйықтықтар үшін рН <7, ал сілтілік сұйықтықтар үшін рН >7.
Химиялық және биологиялық процестерде басқа иондардың ішінде сутек иондарының орны ерекше. Мысалы, тірі клеткада химиялық заттардың синтезі мен ыдырауына қажет ферменттердің активтілігі сутек иондарының концентрациясына тікелей байланысты болады. Әрбір ферментті әсер етуіне ыңғайлы рН-тың белгілі бір мәні болады. Мысалы, азоттың микробтармен фиксациясы (бекітілуі) рН = 7, 2 болғанда байқалады. Өсімдіктердің дамуы топырақ рН-на байланысты әртүрлі болады. Мысалы, сұлы, картоп рН-5 болғанда мол астық береді, бидай, қызылша және т. ббейтарап типті аздаған сілтілік ортада жақсы дамиды.
Ортаның рН-ын жасанды түрде әк немесе суперфосфат қосып өзгертуге болады.
Сутек иондарының концентрациясы жануарлар мен адамның кейбір органдарының функционалдық қызметіне көп әсерін тигізеді. Сондай-ақ сутек иондарының концентрациясы заттар мен ерітінділердің: еріткіштігі, диализі, беттік керілуі, тұрақтылығы, тұтқырлығы, осмостық қысымы, ісіну және т. б. негізді физика- химиялық қасиеттеріне де күшті әсерін тигізеді. Сол себептен сутек иондарының концентрациясын анықтау химия, биология, физиология, бактериология, медицина, ауыл шаруашылығы мен техниканың барлық салаларында қолданыс табуда.
2. 2 рК туралы ұғым.
Протолиттік теорияға сәйкес қышқыл неғұрлым протонды жылдам берсе соғұрлым күшті болады. Қышқылдың күшін оның диссоциациялау константасының теріс логарифмімен (рКк) сипаттаған ыңғайлы.
- рКк = -lgKa
Күшті қышқылдар үшін рКқ теріс сан болады:
- H2SO4КК= 108рКК= -8
- HCl КК= 103рКК= -3
- HNO3КК= 102рКК= -2
Әлсіз қышқылдар үшін рКк оң сан болады.
- HNO2КК= 4*104рКК= +3. 4
- CH3COOH КК= 1. 8*10-5рКК= + 4. 75
- HCN КК= 4. 4*10-10рКК= +9. 4
Бұл көрсетілгендер қышқыл неғұрлым әлсіз болса, соғұрлым рК-ның мәні жоғары болады. Негіздердің күші протон ионын H 3 O + қосып алу қабілеттілігімен анықталады:
- В + H3O+↔︎ ВН++ + H2O
- А-+ H3O+↔︎ АН + H2O
Негіздер үшін олармен қосақтасқан қышқылдың константасын Кқ білген жеткілікті, яғни ВН + /В жұбында негіз үшін:
К Н = pК Н = -lgК Н
3. Активтік және аналитикалық (титрлік) қышқылдылық.
Аналитикалық немесе титрлік қышқылдылық - г-экв/л-мен өрнектелген қышқылдың концентрациясы (кейде ерітіндінің нормалдылығы деп атайды) . Бір нормальды ерітінділердің титрлік қышқылдылығы бірдей және 1л ерітіндідегі 0, 1г/л H + ионы болады және с. с.
Активтік қышқылдылық бос гидроксоний H 3 O + иондарына тең, ол ерітіндінің рН-ына тікелей байланысты. рН сутек ионының активті концентрациясының теріс логарифміне тең болғандықтан әлсіз қышқыл үшін:
- QH+= α * CH+
Ал күшті қышқыл үшін:
- QH+= ϕ * CH+
Мұндағы Q H + - активтік қышқылдылық: C H + - аналитикалық қышқылдылық. -және - диссоциациялау дәрежесі және активтілік коэффициенті.
Төменгі кестеде кейбір бір нормальді қышқылдардың аналитикалық (титрлік) және активтік қышқылдықтары берілген.
Кестенің мәліменттерінен аналитикалық қышқылдықтары бірдей әртүрлі қышқылдардың активтік қышқылдылығы әртүрлі болатынын көруге болады. Негіздерге байланысты олардың химиялық активтілігі ОН-тың аналитикалық концентрациясы емес, активтік концентрациясымен анықталады. Бұл айтылғандардан сутектің бос иондарының концентрациясын (активтік концентрация) анықтау үшін кәдімгі титрлеу әдісін қолдануға болмайтынын және арнайы әдістер қажет екенін байқаймыз. Ондай әдістерге жататындар: индикаторлық (көрсеткіштік), немесе колориметрлік, электрметрлік және сутек иондарының концентрациясын буферлік қоспалар арқылы анықтау
4. Буферлік қоспалар.
Күшті қышқылдар мен негіздердің әлсіз қышқылдық немесе әлсіз негіздік қасиет көрсететін сұйылтылған ерітінділердің рН тұрақты болмайды. Қышқылдар мен негіздердің сұйылтылған ерітінділеріне ауадан немесе тұздардың, шынылардың сілтіленуінен болатын азын-аулақ кірмелер енуі ерітіндінің рН- ының мәнін айтарлықтай өзгертеді.
Егер мысал ретінде, сірке қышқыл мен оның тұзының қоспасын алсақ, ондай қоспаның рН-ының мәні салыстырмалы түрде тұрақты болады. Бұл қоспаға қышқыл немесе сілтінің аздаған мөлшерін қоссақ, сондай-ақ ол қоспаны сұйылтсақ, ерітіндінің рН-ының мәні іс жүзінде өзгермейді.
Ерітіндінің рН-ының белгілі бір мәндерінде өзінің қасиеттерін сақтап қалуын буферлік әсер деп атайды.
Буферлік әсері бар ерітінділерді буферлік қоспалар деп атайды. Олардың құрамында әлсіз қышқылдар мен олардың күшті негіздермен түзген тұздары немесе әлсіз негіздер мен олардың күшті қышқылдарымен түзген тұздары болады.
Ацетат қоспасы деп аталатын сірке қышқылы мен оның тұзынан тұратын қоспаны мысалға алып, буферлік қоспаның әсерінің механизмін қарастырайық. Сірке қышқыл ерітіндісіне мынадай тепе-теңдік болады:
- CH3COOH↔︎ CH3COO-+ Н+(а)
Оның диссоциациялану константасы бойынша өрнектеуге болады:
- КК= [CH3COO-] [Н+] (ә)
- [ CH3COOH ]
Бұдан сутек иондарының концентрациясымен табатын болсақ:
- [Н+] = КК[CH3COОН]
- [CH3COO-]
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz