Молекула құрылысы, энергетикалық деңгейлері және молекулалық спектрлер


МОЛЕКУЛА ҚҰРЫЛЫСЫ ЖӘНЕ СПЕКТРЛЕРІ
МОЛЕКУЛА ТУРАЛЫ ЖАЛПЫ МАҒЛҰМАТ
Заттың негізгі химиялық қасиеттерін сақтайтын және өз алдына «өмір сүре» алатын ең кішкене бөлшегін молекула дейміз. Молекула өзара химиялық байланыспен қосылған бірдей немесе әр түрлі атомдар системасы. Молекулада екі немесе одан да көп атомдар бола алады. Мысалы, Н 2 , О 2 , СО 2 , СН 4 және т. б. Молекуладағы атомдар саны өскен сайын оның мөлшері өсе береді. Молекула өзара химиялық байланыспен қосылған бірдей немесе ядроларының барлық заряды барлық электрондардың зарядына тең. Электрондар молекулада белгілі бір күйде электрондық бұлт түзіп, ядролардың айналасында қозғалады. Молекулаға енетін атомдардың ішкі электрондық қабықтарындағы электрондар көп өзгеріске ұшырамайды. Негізінен молекуланың химиялық және физикалық қасиеттерін анықтайтын сыртқы қабықта орналасатын валенттік электрондар. Атомдар жақындасып молекула түзгенде валенттік электрондар бір-бірімен әрекеттесіп химиялық байланыс түзеді. Молекуланың беріктігі атомдардын өзара байланысымен анықталады. Атомдар ядролары белгілі бір ара қашықтыққа келгенде, олардың арасында өзара тартылыс күші Ғ тр , ал өте жақын келгенде өзара тебіліс күші Ғ тб пайда болады (4. 1-сурет) . Белгілі бір r 0 қашықтықта екі күш бір-бірін теңгеріп, қорытқы күш Ғ=0. Бұл жағдай екі атом үшін өзара әрекетінің потенциалдық энергиясының ең минимум мәніне U 0 -гe сәйкес келеді (4. 1 б-сурет) .

4. 1-сурет
r 0 қашықтық-байланыс ұзындығы, D энергия, молекула құрайтын атомдардың байланыс энергиясы немесе атомдарды ажырату үшін керек диссоциация энергиясы деп аталады. Диссоциация энергиясы теріс шама, ал атомдар молекула құраған кездегі бөлінетін энергия оң шама. Молекуланың тұрақтылығы, беріктігі айтылған диссоциация энергиясына, химиялық активтігі де осыған байланысты болады. Молекула құрайтын атомдар арасындағы байланыс екі түрге бөлінеді. Молекуладағы бір атом ядросының айналасында электрондар саны көп болып, екіншісінің айналасында электрондар аз болып жіктелуі мүмкін. Сөйтіп молекула әр түрлі таңбалы (оң және теріс), бір-біріне тартылатын екі ионнан тұрады. Байланыстың мұндай түрін гетерополярлық немесе иондық байланыс деп атаймыз. Мысалы, NaCl, КСl - хлорлы калийде калий өзінің сыртқы қабықтағы валенттік бір электронын хлорға беріп оң зарядты ион, ал хлор бір электрон алып теріс ионға айналады. Сөйтіп пайда болған иондық молекуланы электрлік диполь ретінде қарастыруға болады. Иондардың ара қашықтығы, яғни байланыс ұзындығы r о =1, 3∙10 -10 м.
Байланыстың екінші түрі гомеополярлық немесе коваленттік байланыс деп аталады. Бұл байланыс кезінде электрондардың бір бөлегі екі ядроны да айнала қозғалады. Байланыс, қарама-қарсы бағытталған спиндері бар қос электрондар арқылы болады (4. 2-сурет) . Коваленттік байланыс, бірдей ядролары бар атомдар Н 2 , О 2 , N 2 және т. с. с. және әр түрлі ядролы атомдар арасындз (NО, НҒ, СН 4 және т. с. с. ) бола береді. Бірінші аталған (Н 2 , О 2 , N 2 ) молекулаларда электрондар симметриялы жіктеледі, ал екінші түрлерінде (NO, HF, CH 4 , NH 3 ) электрондар ассимметрия түзеді. Осының әсерінен молекула электрлік дипольдік момент алады. Коваленттік байланыс туралы алда толығырақ тоқталамыз.
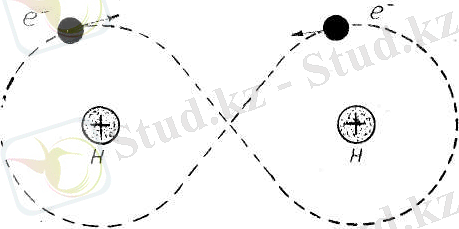
4. 2-сурет
МОЛЕКУЛАНЫҢ ЭНЕРГЕТИКАЛЫҚ ДЕҢГЕЙЛЕРІ ЖӘНЕ ТОЛҚЫНДЫҚ ФУНКЦИЯСЫ
Атом сияқты молекулада кванттық заңдарға бағынады. Молекулаларда атомдағыдай энергетикалық дискреттік мәндер қабылдап, әр түрлі күйлерде болады. Бірақ молекулалардың энергетикалық деңгейлерінің құрылысы күрделі. Себебі, электрондардың қозғалысымен қатар молекулалар құрайтын атом ядроларының тербелісі және айналысы молекуланың энергетикалық күйіне әсер етеді. Тербелмелі қозғалыс кезінде ядролардың салыстырмалы орналасулары, ал айналмалы қозғалыс кезінде молекуланың кеңістікте орналасуы өзгереді. Электрондар қозғалысы ядро қозғалысына қарағанда өте жылдам болғандықтан, молекуланың негізгі энергиясы электрондық энергиядан Е эл тұрады. Электрондар қоршаған ядролардың тербеліс энергиясы Е тб , молекуланың айналмалы қозғалысына келетін Е айн энергия және электрондық энергия Е эл келесідей катынаста болады:
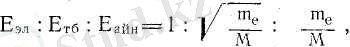
m е - электрон массасы, М - ядро массасы. Сонымен молекуланың жалпы энергиясы
 (4. 1)
(4. 1)
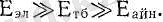 (4. 2)
(4. 2)
Молекуланың күйі оның
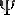 толкындық функциясымен анықталады. Молекуланың толқындық функциясын және оның энергетикалық деңгейлерін әрбір аталған қозғалыстың түрі үшін Шредингер теңдеуін есептеу арқылы табады. Сонда молекуланың электрондық
толкындық функциясымен анықталады. Молекуланың толқындық функциясын және оның энергетикалық деңгейлерін әрбір аталған қозғалыстың түрі үшін Шредингер теңдеуін есептеу арқылы табады. Сонда молекуланың электрондық
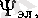 тербелмелі
тербелмелі
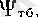 айналмалы
айналмалы
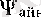 толқындық функциялары бар және оларға сәйкес
толқындық функциялары бар және оларға сәйкес
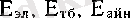 энергиялары бар.
энергиялары бар.
Молекула екі немесе одан да көп атомдардан тұратын орнықты система. Орнықты дейтініміз молекулаға сырттан белгілі бір энергия берілмесе ол атомдарға бөлінбейді. Басқаша айтқанда, молекула система ретінде «өмір сүруі» үшін оның байланыс энергиясы, оны құрайтын бір-бірімен байланыспаған бөлек атомдар системасының энергиясынан кем. Егер бір топ атомдар арасындағы әрекеттесу олардың жалпы энергиясын азайтатын болса, молекула құралады. Егер әрекеттесу жалпы энергиясын арттыратын болса, молекула түзілмейді. Атомдар бір-бірінен тебіледі.
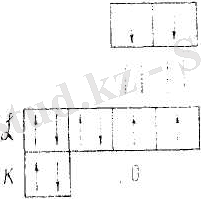
Коваленттік байланыста болатын атомдар системасын қарастырайық. Оның мысалы ретінде сутегі молекуласына Н 2 тоқталамыз. Сутегі атомдарының бір-бір электроны екі протон айналасында қозғалады (4. 2-сурет) . Ядролары бір-бірінен R АВ қашықтықта орналасқан екі сутегі атомын қарастырайық (4. 3-сурет) . Екі атомда өзінің негізгі күйінде, яғни 1s күйінде. Екеуінің ара қашықтығы R ab олардың толқындық функциялары кеңістікте бір-бірін жаппайтын ара қашықтықта болсын (4. 3 а-суретте график түрінде көрсетілген) .
Системаның толық энергиясы әрбір атомның энергиясын екі еселегенге тең. Күнделікті өмірде сутегі молекуласы орнықты система екенін білеміз, яғни ядролары белгілі бір R ab apa қашықтығында орналасқан. Атомдар бірігіп орнықты система құрайды, электрондары ортақтастырылған. R ab apa кашықтығында әрбір атомның толқындық функциясы кеңістікте бір-бірін жабады (4. 3, б-сурет) . III тараудың § 20-ында айтылғандай, егер екі пара-пар бөлшектердің (біздің жағдайымызда электрондардың) толқындық функциялары кеңістікте бір-бірін жабатын болса, екі мүмкін күйі болады. Бірінші, спиндері антипараллель бағдарлағанда электрондардың толқындық функциялары молекуланың орталық аймағында көбірек концентрацияланған (4. 3, в-сурет) . Спиндерінің бағыты стрелка бағытымен көрсетілген. Электрондардың кванттық сандары n, l, m L бірдей де, Паули принципі бойынша, спиндері бір-біріне қарама-қарсы бағдарланған. Екінші, спиндері параллель бағдарланған (4, 3 г-сурет), толқындық функциялар системаның шеткі аймақтарына концентрацияланған.
1927 ж. В. Гайтлер және Ф. Лондон осы қарастырып отырған сутегі молекуласының негізгі күйін Шредингер теңдеуін қолданып есептеген. Система 4. 4-суретте көрсетілгендей 1-электрон А ядросының тұсында, ал 2-электрон В ядросының, немесе, 1 және 2 орын ауыстырады. Бұл айтылған күйлердің бір-бірінен айырмашылығы тек қана пара-пар бөлшектерін - электрондардың орын ауыстырғанында. Системаның потенциалдық энергиясы
 (4. 3)
(4. 3)
мұндағы
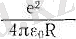 - протондардың, ал
- протондардың, ал
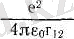 - электрондардың өзара әрекеттесу энергиясы; -
- электрондардың өзара әрекеттесу энергиясы; -
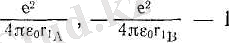 - электронның А және В ядроларымен, -
- электронның А және В ядроларымен, -
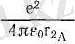 және -
және -
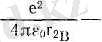 2-электронның А және В ядроларымен әрекеттесу энергиялары.
2-электронның А және В ядроларымен әрекеттесу энергиялары.
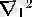 - бірінші электронның координаталары бар Лаплас операторы,
- бірінші электронның координаталары бар Лаплас операторы,
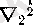 - екіншісінікі. (4. 4) теңдеуінен табылатын энергияның меншікті мәндері, ядролардың ара қашықтығы R-дың функциясы (4. 5-сурет) . Сонымен қатар электрондық энергия Е
эл
электрондардың спиндерінің бір-біріне параллель, 4. 5-суретте көрсетілген 1-қисық немесе антипараллель бағдарлануына байланысты - 2-қисық. 4. 3 және 4. 5-суреттерде молекула құралуы үшін электрондар спиндерінің антипараллель бағдарлануы керек екені көрінеді. Алдында айтып кеткендей атомдар арасындағы өзара әрекеттесу энергиясы олардың жалпы энергиясын азайтатын болса, молекула құралады дегенбіз.
- екіншісінікі. (4. 4) теңдеуінен табылатын энергияның меншікті мәндері, ядролардың ара қашықтығы R-дың функциясы (4. 5-сурет) . Сонымен қатар электрондық энергия Е
эл
электрондардың спиндерінің бір-біріне параллель, 4. 5-суретте көрсетілген 1-қисық немесе антипараллель бағдарлануына байланысты - 2-қисық. 4. 3 және 4. 5-суреттерде молекула құралуы үшін электрондар спиндерінің антипараллель бағдарлануы керек екені көрінеді. Алдында айтып кеткендей атомдар арасындағы өзара әрекеттесу энергиясы олардың жалпы энергиясын азайтатын болса, молекула құралады дегенбіз.
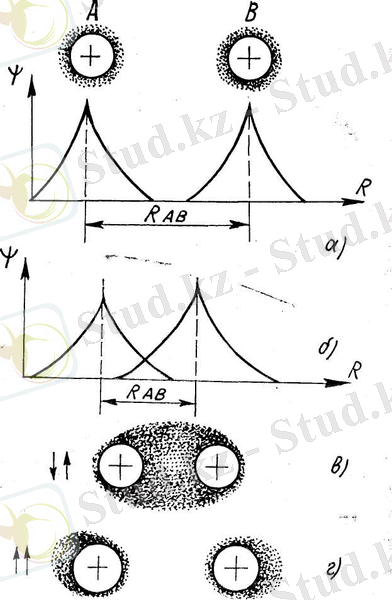
4. 3-сурет
Система үшін Шредингер теңдеуі:
 (4. 4)
(4. 4)
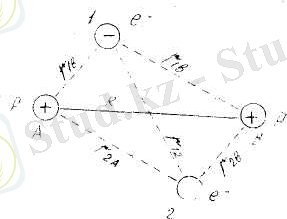
4. 4-сурет
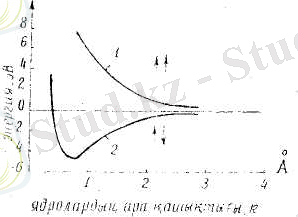
4. 5-сурет
4. 3 және 4. 5-суреттерден электрондар спиндері параллель болғанда системаның жалпы энергиясы артып атомдардың электрондық бұлттары бір-бірінен тебіледі екен, яғни бұл жағдайда молекула құрауға мүмкіндік болмайды.
Атомдар ара қашықтығы үлкен болғанда (4. 3 а-сурет) толқындық функциялары бір-бірін жаппайды. Электрондар спиндерінің бағдарлануы система энергиясына ешкандай әсер етпейді. Егер атомдар жақындасып толқындық функциялары бір-бірін жабатын болса, спиндерінің бағдарлануы системаның жалпы энергиясына бірқатар үлесін қосады. Міне, осы энергия үлесін айырбас энергиясы деп атайды. Оның пайда болуы, III тараудын 20-шы параграфында айтылған, пара-пар бөлшектердің бір-бірінен айырмашылығы болмауынан. Айырбас энергиясы кванттық механика заңдарынан туады, классикалық физика тұрғысынан түсіндіру мүмкін емес. Айырбас энергиясы әр уақытта бір-біріне жақын орналасқан пара-пар системаларда пайда болады.
Сутегі атомдары орнықты молекула құраған кезде ең жақын келетін ара қашықтығы, яғни байланыс ұзындығы
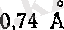 (4. 4-сурет), ал атомдар арасындағы байланыс энергиясы 4, 72 эВ (4. 5-сурет) . Ковалентті байланыста болатын молекулалардың мысалы ретінде су молекуласын алуға болады. Атомдар арасындағы байланысты сызықтар түрінде көрсетеді Н - Н. 4. 6-суретте су молекуласының байланысты схема түрінде көрсетілген. Оттегінің L қабықшасында екі дара электрон бар. Әрбір электрон сутегі атомымен коваленттік байланыс түзеді.
(4. 4-сурет), ал атомдар арасындағы байланыс энергиясы 4, 72 эВ (4. 5-сурет) . Ковалентті байланыста болатын молекулалардың мысалы ретінде су молекуласын алуға болады. Атомдар арасындағы байланысты сызықтар түрінде көрсетеді Н - Н. 4. 6-суретте су молекуласының байланысты схема түрінде көрсетілген. Оттегінің L қабықшасында екі дара электрон бар. Әрбір электрон сутегі атомымен коваленттік байланыс түзеді.
Әрине, ядролар арасындағы байланыс ұзындығы схемадағыдай қатып қалған емес, тек электрондар таралуының бағдарлануына байланысты есептелген орташа ұзындық. Молекулаға сырттан әсер етпесе электрондық конфигурациясы, яғни электрондардың кеңістікте орналасуы тепе-тең конфигурация болады. Молекуланың тепе-тең конфигурация түрлері: сызықтық-барлық ядролар бір түзудің, яғни молекула осінің бойында орналасады, мысалы, СО
2
(көміртегі қос тотығы) ; жазық емес ядролар кеңістіктік құрылым түзеді, мысалы, аммиак. Байланыс ұзындықтары,
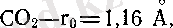 ал аммиакта
ал аммиакта
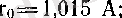 валенттік бұрыш, суда -
валенттік бұрыш, суда -
 (4. 8 а-сурет), себебі сутегі ядролары бір-бірін тебеді. Осыған қосымша, молекула энергиясы, электрондардың берілген конфигурациясында, ядролардың молекуланып жалпы масса центріне қатысты әр түрлі тербелісіне және айналысына байланысты. Тақырыптың басында айтып кеткен тербеліс Е тб және айналыс Е
айн
энергиялары молекула энергиясының жалпы байланысына енуі керек. Егер біз молекуланы гармоникалық осциллятор деп есептесек, онда оның тербеліс энергиясы
(4. 8 а-сурет), себебі сутегі ядролары бір-бірін тебеді. Осыған қосымша, молекула энергиясы, электрондардың берілген конфигурациясында, ядролардың молекуланып жалпы масса центріне қатысты әр түрлі тербелісіне және айналысына байланысты. Тақырыптың басында айтып кеткен тербеліс Е тб және айналыс Е
айн
энергиялары молекула энергиясының жалпы байланысына енуі керек. Егер біз молекуланы гармоникалық осциллятор деп есептесек, онда оның тербеліс энергиясы
 (4. 5)
(4. 5)
мұндағы v - тербелістік кванттық сан, w - тербеліс жиілігі, v үшін іріктеу ережесі:
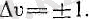 (4. 6)
(4. 6)
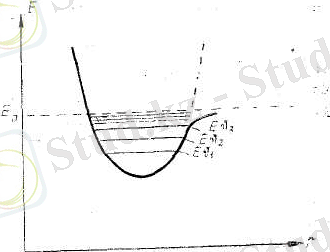
Қарастырып отырған молекуланың потенциалдық энергиясының өзгеру қисығы 4. 7-суретте берілген. Тербелістің кішкене мәңдерінде параболамен сәйкес келеді және диекреттік

4. 6-сурет
4. 7-сурет
және т. с. с. деңгейлер түзеді. Тербеліс интенсивтігі үлкейгенде Е
тб
энергиялық деңгейлер қоюланып шекке Е
0
-ге ұмтылады, яғни диссоциацияланған молекуланың энергиясына ұмтылады. Күрделі көпатомды молекулалардың тербелісін валенттік және деформациялық тербелістерге жіктейміз. Валенттік тербеліс кезінде байланыс ұзындығы өзгереді, ал деформациялықта - байланыс бұрыштары өзгереді. Мысалы, судың екі валенттік (Н-М бағытында) және бір деформациялық (О бағытында) тербелісі бар (4. 8 а-сурет) Молекуланы белгілі бір w
айн
бұрыштық жылдамдықпен айналатын, I - инерция моменті бар система деп қарастырайық (4. 8 б-сурет) . Оның импульс моменті М
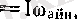 ал энергиясы
ал энергиясы
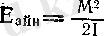 (механика курсынан) . Бұл кванттық системаның импульс моменті дискреттік мәндер қабылдайды:
(механика курсынан) . Бұл кванттық системаның импульс моменті дискреттік мәндер қабылдайды:
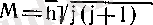
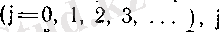 - импульс моментінің кванттық саны - айналма сан. Сонда молекуланың айналмалы қозғалысының энергиясы;
- импульс моментінің кванттық саны - айналма сан. Сонда молекуланың айналмалы қозғалысының энергиясы;
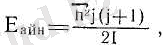 (4. 7)
(4. 7)
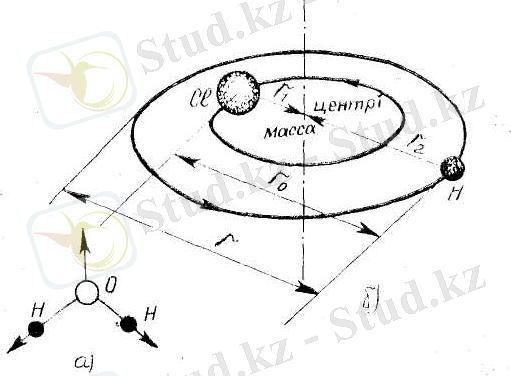
4. 8-сурет
I - молекуланың инерция центрі арқылы өтетін оське қатысты инерция моменті, j - кванттық сан. Ол үшін іріктеу ережесі:
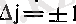 Сонымен, молекуланың толық энергиясы (4. 1) формуласындағы энергиялар мәндерін қойсақ
Сонымен, молекуланың толық энергиясы (4. 1) формуласындағы энергиялар мәндерін қойсақ
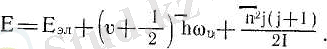 (4. 8)
(4. 8)
Осыған сәйкес екі атомды молекуланың жалпы энергетикалық деңгейлерін қарастырсақ (4. 9-сурет), молекуланың тек кана екі электрондық деңгейлерін аламыз,
 және
және
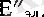 Олардың арасы алшақ. Тербелісті қозғалыстың энергетикалық деңгейлерінің арасы
Олардың арасы алшақ. Тербелісті қозғалыстың энергетикалық деңгейлерінің арасы
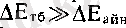 айналмалы қозғалыстың энергетикалық деңгейлеріне қарағанда анағұрлым үлкен шама.
айналмалы қозғалыстың энергетикалық деңгейлеріне қарағанда анағұрлым үлкен шама.


4. 9-сурет
МОЛЕКУЛАЛЫҚ СПЕКТРЛЕР
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz