Атом құрылысының кванттық теориясы: электрондық конфигурация мен периодтық заң


ДӘРІС 3
Атом құрылысы
Дәрістің мақсаты: Атом құрылысының кванттық моделін терең ұғыну және оны периодтық заңмен байланыстыра білуді қалыптастыру.
Дәріс жоспары:
- Электронның және радиоактивтілік құбылысының ашылуы.
- Атом құрылысының күрделілігі.
- Атом құрылысы жөніндегі алғашқы теориялар.
- Атом құрылысының кванттық теориясының негіздері. Электронның кванттық сандары.
- Электронның энергетикалық деңгейлер мен деңгейшелерге, орбитальдарға орналасу реті. Энергияның минимум болу шарты. Элементтердің электрондық формулалары. Валенттік электрондар.
- Атом құрылысының кванттық теориясы тұрғысынан элементтердің периодтық заңы. Периодтық заңның қазіргі заманғы анықтамасы.
1811 ж ағылшын ғалымы Джон Дальтон элементтер кішкене ұсақ бөлшектерден - атомдардан тұрады деген гипотезаны ұсынған. ХІХ ғасырдың соңына дейін атом бөлінбейтін бөлшек деп есептелінген. 1897 ж ағылшын физигі Джон Томсон теріс зарядталған бөлшек - электронды ашып атом құрылысының бірінші теориясын (1904 ж) ұсынған. Томсон бойынша: “Атом біркелкі тығыздықпен орналасқан оң зарядтардан тұратын сфераны құрайды. Электрондар осы оң зарядтар арасында еркін қозғалыста болады. Оң зарядтар мен электрондардың мөлшері бір-бріне тең, сондықтан атомның заряды жок. ”
Электрондар барлық заттарда болады. Электрондар зат жанғанда жалынында болады, затты қыздырғанда, жарық және рентген сәулелерімен сәулелендіргенде бөлінеді. Металдардың электрөткізгіштігін электрондар қамтамасыз етеді. Электр тоғы - электрондардың бір бағыттағы қозғалысы.
Дальтонның теориясын экспериментті түрде 1907 ж ағылшын физигі Эрнст Резерфорд тексерген. Ол үшін ол әдейі құрастырылған приборда жұқа алтын қаңылтыршаны α-бөлшектермен атқылап. α-Бөлшектердің басым бөлігі өзінің траекториясын өзгертпей қаңылтаршадан өтіп кеткен, тек өте аз бөлігі кейін қайтқан, яғни қаңылтаршаның өң зарядтарымен соқтығысып траекториясын 180 о - қа өзгерткен. Резерфорд тәжірибе нәтижелеріне есептеулер жүргізу арқылы оң зарядтың диаметрі 10 -13 см екендігін анықтап, атом құрылысының екінші теориясын - планетарлық теорияны (1911 ж) ұсынған . Резерфорд бойынша: “Атом оң зарядталған ядродан және теріс зарядталған электрондардан тұрады. Атом құрылысы күн жүйесіне ұқсас: ядро күн тәрізді атомның қақ ортасында орналасқан, өте аз көлемді алады. Атомның массасы ядроның массасына тең. Электрондар планеталар тәрізді ядродан алшақта айналып жүреді. ”
1920 ж Резерфордтың шәкірті Чэдвик α-бөлшектердің траекториясының әртүрлі элементтердің ядроларымен соқтығысуы нәтижесінде өзгеруін зерттеу арқылы ядроның заряды элементтің периодтық жүйедегі реттік номеріне тең екендігін анықтады. Ядроның заряды протондардың санымен және элементтің реттік номерімен мынадай байланыста:
ядро заряды = протондар саны = элементтің реттік номері
Ядро оң зарядталған протондардан және нейтрал бөлшек - нейтрондардан тұрады. Протонның массасы нейтронның массасына тең:
m (протон) = m (нейтрон)
Ядродағы протондар мен нейтрондардың массаларының қосындысы элемент атомының массасына тең:
m (атом) = m (ядро) =
 m (протондар + нейтрондар)
m (протондар + нейтрондар)
Атомның массасына электрондар үлес қоспайды, себебі электронның массасы өте аз шама:
m (электрон) =
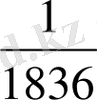 m (протон) ; m (электрон) =
m (протон) ; m (электрон) =
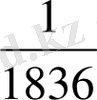 m (нейтрон)
m (нейтрон)
Атом электронейтрал бөлшек, себебі - ядро заряды электрондар санына тең:
протондар = ядро = электрондар = элементтің реттік
саны заряды саны номері
Атом құрылысының кванттық теориясының негіздері . Атомның орбитальдық моделін Дания ғалымы Нильс Бор 1913 ж ұсынды. Бор Резерфордтың планетарлық моделіне, Эйнштейннің жарық кванттары жөніндегі іліміне (1905), Планктың сәулеленудің кванттық теориясына (1900) сүйенді. Планктың теориясы бойынша заттар электромагниттік сәуле энергиясын жеке порциялар - кванттар түрінде сіңіреді немесе бөледі. Бор өзінің теориясын постулаттар күйінде түйіндеді:
- Электрон ядроны белгілі бір шеңберлі тұрақты (стационар) орбита арқылы ғана қозғала алады.
- Электрон стационар орбита бойынша қозғалғанда энергия бөлінбейді.
- Электрон стационар орбитадан басқа орбитаға өткенде энергия сіңіріледі.
- Электрон басқа орбитадан стационар орбитаға қайта келгенде энергия бөлінеді.
Электрон стационар орбитада болғанда атом қалыпты жағдайда болады. Қалыпты жағдайда атом өте ұзақ бола алады. Электрон басқа орбитаға көшкенде атом активтелген (қозған) жағдайға көшеді. Активтелген жағдайда атом ұзақ уақыт бола алмайды. Атомның активтелген жағдайда өмір сүру уақыты 10 -5 с шамасынан аспайды.
1924 ж француз ғалымы Луи де Броиль толқындық-корпускалалық қасиет тек жарық фотондарына ғана емес барлық микробөлшектерге тән деген идеяны ұсынды. Де Броиль бойынша микробөлшектердің қозғалуын толқындық процесс деп қарастыру керек. Көптеген ғалымдардың (Шреденгер, Гейзенберг) ғылыми ізденістері бұл гипотезаның дұрыстығын дәлелдеп электронның толқындық және бөлшектік қасиеттерге ие екендігін көрсетті. Бұл ұлы ғалымдардың ғылыми ізденістері атом құрылысының кванттық теориясын онан әрі дамытты. Атомда электрондар энергетикалық деңгейлерге орналасады, әрбір деңгейлер деңгейшелерге бөлінеді, ал әрбір деңгейшелерде орбитальдар (ұяшықтар) болатындығы жөнінде көзқарас қалыптасты. Электрондардың қозғалу орбитасы шеңберлі емес эллипсті деген тұжырым жасалды.
Атом құрамындағы электронның жағдайын сипаттау үшін төрт кванттық сан ұсынылды: басты квант саны (n), орбиталь квант саны (l), магнит квант саны (m l ) және спин квант саны (m s ) .
Басты квант саны (n) электрон орналасқан энергетикалық деңгейдің номерін көрсетеді. Басты квант саны 1, 2, 3, 4, 5, 6, 7 мәндеріне ие бола алады. Электрон орналасқан орбита ядродан алшақтаған сайын басты квант санының мәні өседі. Мысалы n = 1 болса, электрон ядроға ең жақын энергетикалық деңгейде, ал n = 7 болса, электрон ядродан ең алшақ энергетикалық деңгейде болады. Басты квант санының мәні өскен сайын, яғни электрон ядродан алшақтаған сайын, электронның энергия қоры арта түседі, атомдық орбитальдардың көлемі ұлғая түседі, сондықтан электрондар атомды оңай тастап кете алады. Сыртқы энергетикалық деңгейдегі электрондарды валенттік электрондар деп атайды. Валенттік электрондар - химиялық байланыс түзуге қатысатын электрондар. Валенттік электрондардың саны элемент орналасқан топ номеріне тең болады. Энергетикалық деңгейді толтыру үшін қажет электрондардың саны мына формуламен анықталады:
N = 2n 2
Осындағы n - басты квант сан.
Атомның электрондармен толтырылатын энергетикалық деңгейлерінің саны элемент орналасқан периодтың номеріне тең:
Энергетикалық
деңгей саны
Орбиталь квант саны (l) көрсетеді:
- энергетикалық деңгейдегі деңгейшелердің түрлерін;
- электрон бұлттарының формасын.
Орбиталь квант сандарының мәні 0 мен n - 1 аралығындағы бүтін сандарға өзгереді. Деңгейшелер төрт түрге (s, p, d, f) бөлінеді. Деңгейшедегі орбитальдар саны мына формуламен (2 l + 1) анықталады. Деңгейшенің әрбір түрінде орналасатын электрондар саны мына формула бойынша есептеледі:
N = 2 (2 l + 1),
осындағы l - орбиталь квант саны.
деңгей
шеде
Магнит квант саны (m l ) электрон орбитальдарының кеңістіктегі бағытының (ориентациясының) жалпы санын, яғни деңгейшедегі электрон орналасатын ұяшықтар (орбитальдар) санын көрсетеді. Магнит квант саны орбиталь квант санымен ( l ) тығыз байланысты, сандық мәні өзгереді мына аралықта: - l . . . , - 2, - 1, 0, +1, +2, . . . + l . Орбиталь квант санының мәніне байланысты магнит квант сандарының өзгеруін мына кестеден көруге болады:
Магнит квант сандары
(m l )
Спин квант саны (m s ) электрондардың өз осіне қатысты айналу бағытын сипаттайды. Сандық мәні екеу ғана ( + ½ және - ½) болуы мүмкін.
Атомның электрондық қабықшасының электрондармен толтырылу ережелері.
Паули принципі: Атомда төрт кванттық сандары да бірдей екі электрон болуы мүмкін емес. Осы себептен әрбір орбитальда (ұяшықта) спиндері қарама-қарсы екі электрон ғана орналасады.
Гунда ережесі: Бір деңгейшеде орналасқан электрондардың спиндерінің қосындысының абсолют мәні максимум болуы керек, сонда атом энергиясы төмен тұрақты жағдайда болады. Осы ережеге сәйкес деңгейшенің орбитальдарына (ұяшықтарына) электрондар параллель спинмен жеке-жеке орналастырылады. Орбитальдар жеке электрондармен толтырылғаннан кейін келесі ретте қарама-қарсылы спинді электрондар орналастырылады.
Клечковский ережесі: Энергетикалық деңгейлер мен деңгейшелер атомның энергиясы минимум болу принципіне сәйкес басты квант саны мен орбиталь квант санының қосындысының (n + l) артуы бойынша электрондармен толтырылады . Атомның электрондармен толтырылу реті көрсетіліп жазылған формула элементтің электрондық формуласы деп аталады. Төмендегі кестеде кейбір элементтердің электрондық формулалары келтірілген:
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz