Ферменттер: анықтамасы, дамуы, бөлініп алынуы, активтігін өлшеу және химиялық құрамы


ФЕРМЕНТ ДЕГЕН НЕ!
Фермент дегеніміз - белоктық зат, ол организмдегі түрлі химиялық реакцияларды тездетуші. Химиялық реакциялардың жүрісін тездетушілерді катализаторлар деп атайтыны белгілі. Осыған сәйкес ферменттерді биологиялық катализаторлар деп те атайды, өйткені, олар тірі материяда әрекет жасайды. Фермент (латынның тілінде fermentum - ашу деген мағына береді) деген терминмен қатар әдебиетте энзим (грек тілінде - enzym, en - ішкі, zyme - ашытқы деген мағына береді) деген сөз де қолданылады.
Ферменттерді және олар катализдейтін реакцияларды зерттейтін биохимия бөлімі энзимология деп аталады. Ферменттер жөніндегі ілім қалай дамыды? Фермент қатысатын процестермен адам өте ерте кездерден бері-ақ таныс болатын. Тіпті ерте заманнын. өзінде-ақ қантты заттарды ашыту жолымен спирттік ішімдіктер алғаны белгілі. Ферменттер қатысатын про-цестерді ғылыми тұрғыдан зерттеу XVII ғатрдык орта кезінен басталады. Осы кезде Гельмонт қанты бар сұйық заттардың ашуы ерекше қоздырушылар көмегімен жүріетінін анықтаған. Осыдан кейін Лавуазье ашу кезінде қант түгелдей көмір кышқыл газға және спиртке айналатынын аныктады.
XIX ғасырдың ортасында кейбір фермент препараттары (уыт-тан - амилаза, карын сөлінен - пепсин, т. 6. ) бөлініп алынды. Сөйтіп, катализ және катализаторлар жөніндегі ілім жарықка шықты (Берцелиус және басқалар) . Бұл кезде атқарылған зерттеу жұмыстары ферменттердің химиялық зат екенін, олардың негізі биологиямен байланысты екенін дәлелдеді.
Луи Пастер спирттің ашу процесін зерттеп мынадай қорытындыға келеді: ашу процесін жүргізетін химиялық заттар емес, ашытқының, яғни тірі клеткалардың тіршілік әрекеті болып табылады. Ол ферменттер тірі ашыткыдан ажырамайды, олармен біртұтас деп санады. Ашуға қатысты мұндай көзқарас 1897 ж. Бухнер ашқан тамаша жаңалыққа дейін ұзақ уақыт сақталып, келді. Ол құрамында тірі клеткалар жоқ ашытқы сөлін сумен бөліп алады. Осы сөлдің өзі-ақ қантты тез ашытып, спиртке және көмір қышқыл газға айналдырғанын көреді. Осылайша қантты ыдыратып ашытатын ашытқының тірі клеткалары емес, керісінше олар жасап шығарған фермент (химиялық зат) екенін дәлелдейді. Ферменттің қантты ашыткы өнімдеріне айналдыратын катализатор екенін анықтайды.
Спиртті ашу кезіндегі қатализатордын химиялык. табиғатын
анықтау ферментті процестер жөніндегі зертгеуді алға апаруға дем беруші үлкен күш болды және соның нәтижесінде көптеген ферменттер бөліп алынып зерттелді. Ферменттер әсерінің теориясы (Э. Фишер, 1890 ж. ), ферментті реакциялардың кинетикасы (Л. Михаэлис пен М. Ментен, 1913 ж. ) жөніндегі жұмыстар жарык көрді. XX ғасырдың бас кезінде И. П. Павлов және оның әріптестері ас қорытушы ферменттердің белоктық табиғаты жө-нінде өте маңызды мәліметтер алады. Олар иттің қарынындағы сөлдің активтігі онын қүрамындағы белоктарға банланысты еке-нін анықтады. Қарын сәлінде белок аз болса, онда пепсин де шағын мөлшерде болды. Өз мәліметтерін және баска да ғалым-дардың зерттеулерін талдай келіп, Павлов ферменттер дегені-міз - белоктық заттяр деген қорытындыға келді.
Ең алғаш таза ферментті 1926 ж. жас биохимик Дж. Самнер кристалл түрінде алды. Ол канавалия деген өсімдік дәнінен уреаза ферментін бөліп алып, онын кристалдарының белоктан түратынын анықтайды. Бұдан кейін 1930 ж. Дж. Нортроп пепсіш кристалдарын, ал келссі жылы сол Нортроп пен М. Кунитц екеуі кристалды трипсииді бөліп алады. Осы екі ферменттіц екеуі де белок екен. Қазіргі кезде кристалдык, түрде жүздеген фермент
алынды. Зсрттеліп табылған ферменттердін саны №Ір 2000 ша-масынан асады. Олардың бәрі де белокты заттар.
ФЕРМЕНТТЕРДІ БӨЛІП АЛУ ЖӘНЕ ТАЗАРП
Ферменттер адамның, жануарлардын, өсімдіктеріік тканьде-рінде және микроорганизмдерде синтезделіп жасалады. Фермент-ті бөліп алу үшпК ол кәп кездесетін материалды ішикізатты) тандап алу керек. чігер фермент алынатью матервал жануар ткані болса, онда ол\каньді басқа бөліктерден бөліп ажыратады және қанын жуып тайартады. Тандап/альшған материалдағы ферменттер бүзылып кқтаеу үшін, оиъі төменгі температурада (2-8°С) үнтак. тайды. Шыланша үнгақталған біртектсс массаны центрифугаға салып өңдеиді. Осы/езде фермент оши сүйық бө-лігіне (центрифугатқа) «'геді деушөгшдіпі тастапды.
Ферменттер белоктык. зкттар болғандықтан, оларды алу үшін белокты бөліп шығаратын^әдісті қолданады. Белокты шөктіріп түнбаға түсірудін біріншідегегіндс центрифугатка аммоний сульфатын немесе орган^катішк ертікіштерді (этил спнртін неме-се ацетонды) қосады. Бұй кезіш. ферменттермен қоса бүкіл бе-локтар дерлік түнбаға тесіріледп^Бүдан кейін ферменттерді епті-лікпен бөліп алу ү^ш^ әдісін қолда-нады. Әсіресе әр түдлі смолаларХ олардын ішінде ерімейтін ДЭАЭ-целлюлоза кен. түрде қолданыоады.
Полиакриламидті, крахмалды немьсе агарлы гелде жүргізі-летінэлектрофоі^езәдісімен деферменттқрді бөліп алуға болады.
Осыдан кейш бөліп алынған фермент препаратынык біртекті тазалығын те/середі. Ферменттің тазалық дәрежесі онын. меншік-ті активтілшмен бағаланады, бүл кезде ферменттіц активтілігін 1 мг белокқа шағып есептейді. Әдетте ферментті тазарту жүмы-сын, осы іетің келесі кезеңінде олардык меншікті активтілігі одан әрі артпайтындай деңгейге дейін немесе электрофорездеу, гель-сүзу, ионалмасу хроматография не ультрацентрифугалау кезінде тек бір ғана белок компоненті бөлінгенғе дейін жүргізе береді.
ФЕРМЕНТТІҢ АКТИВТШІПН ӨЛШЕУ
Бвліп алынған таза фермент өзінің ферменттік активтіліхімен бағаланады. Ферменттік активтілік дсгеніміз белгілі фермент белшегінің квмсгімен накты уакыт ішінде альшған субстрат ша-масы. Мысалы, а-амилазаньщ осындай қасиетін зерттеп білу үшін 25 С С жағдайында және 1 минут ішінде 1 мг фермент ыды-ратқан крахмал мелшерін анықтау қажет.
Фермент активтілігінің өлшемі жөнінде энзимологияда мыпа-дай ұғымдар кабылданған. Ферменттін халыкаралық өліпемі Ө бас әрпімен («елшем» деген сөздіц немесе V (агылшын тілін-де - ІІпіі; деген сөздіц бас әрпімен) белгіленеді.
Ферменттің халықаралық өлшемі дегеніміз - фермент әсері-нің колайлы жағдайында (рН, субстрат концентрациясы, т. б. ), 25°С температурада бір минут ііпінде субстраттың бір микромо-лін (1 мкмол 10 6 мольгс тсц) катализдеп өндей алатын фермент мелшері.
Меншікті активтілік дегеніміз - ферменттік прспараттагы бір мг белокқа тиісті фермент өл-шсмнің (Ө) шамасы; ол мкмоль 1 мин мг белок деп керсетіледі. Меншікті активтілік ферменттік препараттың тазалық өліиемі: фермент таззртылған сайын, ол арта түседі және фермент таза күйге жеткенде, ол көрсеткіш ен жоғары және тұрақты болады.
Катализдік активтілік (символы - кат) дегеніміз -стандарт-ты жағдайда 1 моль субстратты 1 с уақыт ішінде өндеп өзгерте алатын фермент мөлшері болып табылады.
Ферментті препаратта белоктың бар екенін Кьельдал әдісімен (жалпы азотты анықтап, ол көрсеткішті 6, 25 санына көбейтеді), немесе Лоуридің колориметриялык әдісімен анықтайды, ал тұ-нық және боялмаған ерітінділерде 280 нм ксзінде Варбург пен Христианның спектрофотометриялык, әдісі бойынша анықтайды.
ФЕРМЕНТТЕРДІҢ ХИМИЯЛЫҚ ҚҰРАМЫ ЖӘНЕ ҢҰРЫЛЫМЫ
Сонымсн, фермеит дегеніміз биохимиялык. реакциялар ксзін-де катализдік активтілік көрсететін белоктар екені белгілі бол-ды. Ферменттердің бәрі де улкен молекулалы қосылыстар, олар-дыц молекулалық массасы (м. м. ) 10 мыңнан 1 миллионға дсйін, тіпті одан да көп шамаға жетеді. Мысалы, кейбір ферменттердің молекулалық массасын карастырып көренік:
Рибонуклеаза, ұйқы безінікі 12 640
Химотрипсин, ұйқы бсзінікі 23 000
Пепсин. шошка қарьпгыныкі 34 000
Гексокиназа, бауырдыкі 100 000
Фосфорилаза., бауырдыкі 185 000
Каталаза, бауырдьткі 232 000
Уреаза 480 000
Глутаматдегидрогеназа, бауырдыкі 1 000 000
Синтетаза, май қышкылдарыныкі 2 300 000
Барлық басқа белоктар спяқты, ферменттер де химиялық кұ-рамы бойынша екі топка бөлінеді. Олар қарапайым ферменттер және күрделі ферменттер.
Қарапайым фермснттер дегеніміз - қарапайым белоктар, олар гидролиз кезінде амин қышқылдарына ғаиа ажырап бөлі-неді. Қарапайым ферменттерге мыналар жатады: рибонуклеаза, пепсин, трипсин, химотрипсин, папаин, амилазалар жоне гидро-лаза класына жататын басқа да ферменттер.
Күрделі ферменттер дегеніміз - күрделі белоктар. Күрделі фермспттср екі беліктен: белоктык, жәнс белоктык смес бөліктен түрады. Ферменттердің белоктық бөлігі апофермент деп, ал бе-локтық емес белігі простетикалық іоп немесе кофактор деп ата-лады. Апофсрмснт кофакторсыз (простетикалық топсыз) активті болмайды. Күрделі ферменттердін, кофакторлары мсталл ионда-ры немесе белоктық емес органикалык заттар. Мұндағы металл иондары активаторлар деп аталады. Активаторлар мына иондар: N8+, К+, Ғе 2 +, Ғе 3+ , Си 2 +, Со 2+ , 2п 2 ^-, М§ 2 +, Мп 2+ , Мі 2+ , Мо 2 -. 180 шамасынан астам ферментте металл иондары активатор қыз-метін атқарады.
Қофактор (простетикалық топ) белоктык емес зат болған-дықтан кофермент деп аталады. Кофермептті толығырақ карас-тьфамыз, өйткені ол ферменттік реакцияларда айтарлықтай қыз-мет аткарады.
Қоферменттер (латын тіліндегі Ко - бірге және фермент деген сөзден шыққан) - құрамында белок жоқ органикалык қосылыстар, олар апорферментпен тығыз байланысқан. Фер-мснттің мықты байланысқан кофакторы - простетикалық топ. Көптеген ферменттердің активтігі үшін екі фактордың да - ме-талл иондарының да, простетикалық топтың да (немесе кофер-менттің) болуы қажет.
Қоферменттер - төменгі молекулалы заттар, олар жоғары температураға төзімді келеді және ферменттің белоктык бөлігі-нен оңай ажырайды. Мысалы, диализ кезінде осылай болады. Олар сөзсіз қажетті кофактор ретінде фермснттердің катализдік жүмысына қатысады.
Қөптеген ферменттер витаминге жатады немесе витаминдер туындысы болып табылады. Коферменттерге активтік тобы бар витаминдер - тиаминпирофосфат (Ві витаминніц туындысы), никотинамидті коферменттер (РР витамині бар) жатады. В 2 , Вв, Віг витаминдері жәнс басқа да витаминдер кіреді. Сондықтан да витаминнің жеткіліксіз болуы коферменттердін. синтезін бұзады, соның салдарынап тиісті ферменттердін түзілуі тежеледі. Осы-даи кенііі зат алмасу бұзылады және адам мен жануарлар орга-нпзмі бірқалыпты тіршілік етс алмайды.
Витаминдік емес коферменттер дс бар, мысалы, металлпор-фириндер (цптохромдагы гемдер), нуклеотидтер (УДФ-глюко-за), пептидтер (глутатион), т. б. осындай коферменттер. Мүндай коферменттер зат алмасудың аралық өнімдерінен түзіледі және әрқашан да организмде болады.
Биохимиялық реакцняларда кофермснттер скі турлі қызмет атқарады:
- Күрделі фермент кұрамында субстраттың (субстрат деге-німіз фермент әсер ететін зат) катализдік өңделіп өзгеруіне ка-тысады, бұл ксздс кофермент оның активті ортасына енеді;
- Бір субстраттан екінші субстратқа (немесе баска фермспт-ке) электрондарды, протондарды немесе жске химиялық топтар-ды тасымалдайды.
Төменде кофермснттердің сипаттамасы берілген.
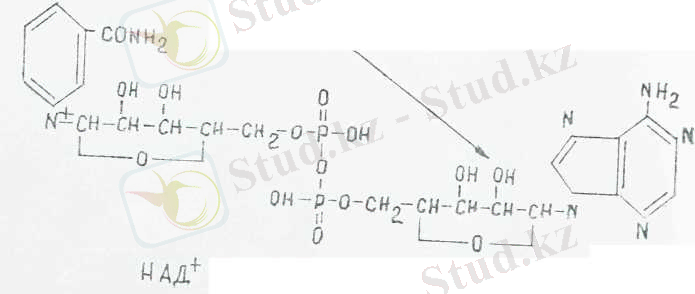
1. немесе пиридиндік коферменттер НАД + және НАДФ+ (НАД + - , НАДФ~ - ) . Бул кофер-менттсрдің активті белігі никотинамид (РР витамині) болып та-былады, оның модекуласында пиридин сақинасы бар және ол пиридиндік коферменттер деп аталады.
НАД+ және НАДФ^ қандай да бір арнайы белоктармен (апорфер. менттермен) қосылып, тиісті ферменттер тузеді. Мыса-лы. пиридиндік дегидрогеназаны түзеді, ол фермент субстраттан сутегі атомдарын бөліп алып, тотықтырады. НАД + коферменті кұрылым формуласы мынадай:
 косрерменті, тотықцан турі
косрерменті, тотықцан турі
гидроксил сносфатпен курделі зфир береді
НАД және НАДФ НАДФ~ молекуласында бул молекуласындағы пиридин сакинасында азот төрт валентті, бұл коферменттердің тотыккан түрі былай жазылады: НАД+ және НАДФ + . Биологиялық жолмен тотыккан кезде Н~ гидрид ионы (протон мен екі электрон) және Н~ про-тоны субстраттан бәлініп шығады. Бөлініп шыққан Н" гидрид-ионы НАД+ немесе НАДФ+ байланысады да, НАДН және НАДФН коферменттеріне дейін тотыксызданады ал Н + протоны ерітіндіге ауысады. Осыған байланысты НАД^ пен НАДФ 4 " екеуінін тотықсыздану рсакциясы былай жазылады:
НАД+ +Н Н НАДФ+ + Н-
+ Н+ +- НАД - Н + Н+ + Н+^НАДФ-Н + Н+
НАД+ пен НАДФ+ тотықсызданған кезде пиридиннің төрт валентті азоты уш валенттіге ауысады және субстраттағы ги-дрид-ион С 4 куйдегі никотинамндтік сақииаға ауысады. Тотық-қан (I) және тотықсызданған (II) НАД пен НАДФ екеуіиің фор-муласы төмендс келтірілген, мұндағы Рч - коферменттің қалды-ғын білдіреді.
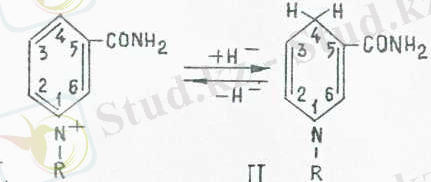
НАД+ және НАДФ+ коферменттері әдетте клеткада бос кү-йінде болады, бір ферменттен екіншісіне ауысып отырады. Олар көпшілік дегидрогеназада тек катализдік реакция кезінде ғана ферменттің белоктық бөлігімен байланысады. Сонымен катар кұрамындағы бұл коферменттер үнемі активті. орталықта бола-тын дегидрогеназалар да бар. Биохимиялык реакциялар кезінде НАД = Н және НАДФ = Н сутегі атомдарын басқа қосылыстарды тотықсыздандыруға оцай береді. Олар осылайша тотығу-тотық-сыздану реакцияларына қатысады.
НАД+ коферментіне қарағанда, НАДФ^ коферментінде бір фосфат тобы артық болады, ол топ, аденинмен байланыскан ри-бозаныц гидрокснл тобымен этерленген, НАД" 1 " пен НАДФ^ т- дерінің құрылымы жөнінде жақын қосылыс, бірінен-бірі түзіле алады, бірақ бірін-бірі алмастыра алмайды. Мұндағы жағдай мынадаіі: бір апофсрменттер тек НАД^-қа ғана тән, екінші апо-ферменттер НАДФ + -қа ғана тән. Сондықтан да бұл дегидроге-наза - ортурлі субстратты тотыктырады. Мысалы, глутар кыш-кылы НООС-СН 2 -СН 2 -СН 2 -СООН НАД- коферментінін қа-тысуымен тотығады, ал лимон қышқылы НООС-СгЬ-СОН -
і
соон
-СНг-СООН НАДФ+ коферментінің катысуымен тотығады.
Осы жерде мынаны аііту керек. рН = 7 кезде (организмпіц ішкі ортасы осындап) органнкалық қышкылдар толық диссоіша-цияланып, иондарға ажырайды. Мысалы аспарапш қышқылы, глутамнн қышкылы диссоциацияланғанда аниондар мен протон-дар тузеді. Олардың аниондары аспартат, глутамат деп аталады.
НООС-СН 2 -СН 2 -СООН: Аспарагин қышқылы
-ООС-СН 2 -СН 2 -СОО- + 2Н-
Аспартат
Сондықтан бұл амин қышқылдары, катиондардың болғанына қарамай, аспартат, глутамат деп аталады.
Сол сияқты биохимияда - ат жалғауы басқа кышқылдарға қатысты да пайдаланылады. Мысалы, ацетат (сірке қышқылы), лактат (сүт қышқылы) пируват (пирожүзім кышқылы), окса-лат, сукцинат, малат, фосфат, аденилат және т. с. с. Мұндай тер-минология ферменттер атауына катысты да қолданылады. Мы-салы, лактатдегидрогеназа.
әсер етуімен жүретін лактаттың то-тығуын карастырып көрейік, мұндағы кофсрмент НАД+.
фермент
СН 3 -СНОН-СОО- + НАД+ -+
-► СН 3 -СО- СОО- + НАД- Н + Н+
Пируват
НАД~ және НАДФ + коферменттері гликолиз, клетка тыныс-тануы, фотосинтез сияқты процестерде, сол сияқты сүт қышқыл-ды ашу мен спиртті ашу кездерінде маңызды қызмет аткарады.
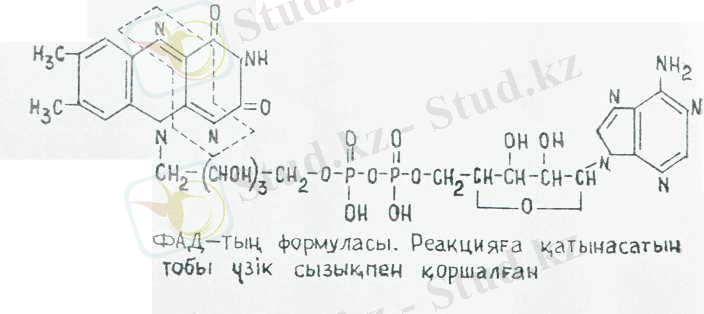
2. ФАД және ФМН флавиндік коферменттер.
(ФАД - , ФМН - флавинмонону-клеотид) . ФАД және ФМН коферменттері әртүрлі апофермент-термен байланысады да, флавопротеидті ферменттер - флавин-дік дегидрогеназа түзеді. Қазіргі кезде флавопротеидтердің саны 80 шамасына жетеді және олардың көпшілігінде ФАД бар. ФАД және ФМН екеуі апоферменттермен мықты байланыскан және НАД + және НАДФ+ екеуінен айырмасы, катализдік реакция ке-зінде ферменттің белоктық бөлігіне байланысқан күйінде кала-ды. Сондықтан оларды простетикалық топтар деп атаііды. ФАД
және ФМН екеуі топтарды бір ферменттен (субстраттан) екін-шісіне ауыстырып, алмастыру қызметін атқармайды.
ФАД және ФМН коферменттердің актнвті бөлігі рибофлавин (В, витамині), онда изоаллоксазин сакинасы оар.
ФМН коферментінің ФАД коферментінен айырмасы - оньщ аденилді нуклеотиді болмайды, В 2 витамині құрамындағы рнои-толдыналғашкы спиртті тобымен фосфат этерификацияланады.
Флавиндік дегидрогеназа (белок-ФАД) сутегі атомын оө-ліп алу жолымен (екі протон мені екі электрон) субстратты то-тыктырады бүл кезде кофермент ФАД-Н 2 (белок- ФАД-Н 2 ) айналады Мысалы, ферменттердін осындай тобына жататын сүкцинатдегидрогеназа сукцинатты қанықпаған фумаратқа де-йін тотықтырады, субстраттан шыккан сутегінін екі атомы да ФАД-пен байланысады:
-ООС-СН 2 -СН 2 -СОО- + белок = ФАД-^
у -ООС-СН = СН-СОО- + белок- ФАД = Н 2Қайтымды тотығу реакциясы жәие флавиндік коферменттер-дің тотықсыздануы аллоксазин сақинасына әсер етеді. Бұл жағ-даіісутсгі атомдарын бөліп шығару және косып алу жолымен іске асады. Формулада бұлар үзік сызыкты квадраттар арқылы берілген.
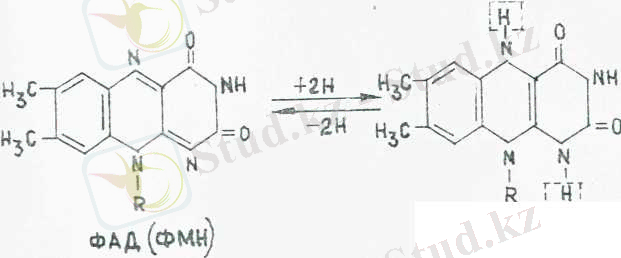
ФАД-Н 2 (ФМН-Н 2 )
Кейбір флавопротеидтердің активті орталығы қүрамына ме-талл иондары (Ғе, Мо, Си) енеді. Олар реакцияда электрондар-ды ауыстырып, алмастыру қызметін атқарады. Мьтсалы, ксакти-ноксидазада молибден, темір бар.
Рибофлавин және екі коферменттің екеуі де сары түске боял-ған, олар тотықеыздану кезіпдс лейкотурге ауысады да, бояуы
жоғалып кетеді.
Флавопротеидтер НАД-Н-дан немесе тотығатын субстрат-тан сутегі атомдарын митохондриядағы тыныстану тізбегіне ауыстырып жеткізуші сияқты қызмет атқарады. Осылайша мо-лекулалық оттегімен оларды суға дейін тотықтыруға қатысады.
Сондықтан пиридиндік (анаэробты) дегидрогеназадан бөліп флавиндік дегидрогеназаны аэробты деп атайды.
3. ТПФ немесе ГДФ коферменті (ТПФ - тиаминппрофосфат, ТПФ - тпаминдифосфат) ТПФ коферменті Ві витаминінің туын-дысы, оның тиазол сақинасында күкірт бар. Ол апоферментпен мықты байланыскан болады және простетикалық топ деп сана-лады. ТПФ молекуласындағы активті бөлік - тиазол сақинасы-ның -СН тобы, сол топтың көмегімен ол субстратпен байланы-сады.
ТПФ апоферментпен байланысып, декарбоксилаза түзеді, ол ке-тоқышқылдан көмір қышқыл газдың бөлінін шығуын катализ-дейді. Бұл реакциялар кезінде карбоксилдік топпен тікелеіі бай-ланысқан көміртек - кеміртектік байланыс бұзылады. Мысалы, ашытқы клеткаларында пирожүзім қышқылын декарбоксилдеуді пируватдекарбоксилаза ферменті мынадай схема бойынша ката-лиздейді.
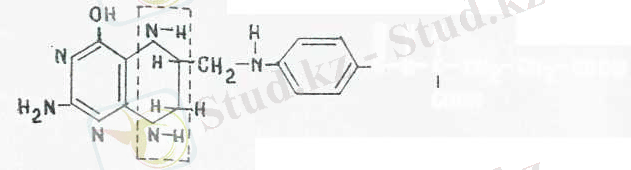
4. Кобамидтік кофермент. Бұл коферменттін активті бөлігі хикиялық құрамы ен, күрделі витамин - Ві 2 витамині. Ві 2 ви-тамині молекуласында коррин циклы бар, ол төрт пиррол сақи-насынан турады, сақиналар бір-бірімен өзара байланысады. Циклдың дәл ортасында кобальт атомымен байланысқан циан тобы орналасады. Сондықтан бұл витамин цианкобаламин деп аталады. Кобамидтік коферменттерде. циан тобы болмайды, оның орнын метил мен 5'-дезоксиаденозин басады. Осыған сәй-кес мынадай екі кофермент тузіледі: метилкобаламин жәие 5'- (5'-ДоАК)
Кобамидтік ферменттер өзіне сәнкес апоферменттермен қосы-лып, кобамидтік ферменттер тобын құрайды. Оидай фермснттер тобы мынадай реакцияларды катализдейді: 1) метилкобамидті ферменттер трансметилдену процесіп катализдейді, мысалы, ме-тионин, холин, А коферменті және басқа қосылыстардың биосин-тезі кезінде метил тобының алмасып ауысуы; 2) кобамидтік фер-менттер 5'-ДоАК коферменттерімен бірге заттар молекуласы арасында сутегі атомдарының алмасып ауысуын және жаңа кә-міртек-көміртектік байланыс түзілуін катализдейді. Атап айткан-да бұл ферменттер пуриндік және пиримидиндік негіздердің тү-зілуіне қатысады.
5. Пиридоксиндік коферменттер. Бұл коферменттердің негізі В 6 витамині, коферменттің қүрамына бір-біріне ұқсас үш қосы-лыс: пиридоксин (пиридоксол), пиридоксаль және пиридоксамин кіреді. Ол үшеуі біріне-бірі оңай айналады.
В 6 витаминнін, негізгі активті туындысы пиридоксаль-5-фос-фат болып саналады, онын өзі біркатар пиридоксальдік фермент-тердің коферменті. Пиридоксаминфосфатта коферменттік қыз-мет атқарады.
Пиридоксиндік коферменттер азот алмасуға қатысатын көптеген ферменттің жасалуы үшін қажет. Пиридоксальдік фер-менттер 30 шамасынан астам әр түрлі рсакцпяларды катализ-дейді. 1) Осы ферменттердің негізгі қызметінің біреуі амин қышқылдарын трансаминдеумен (қайта аминдеу) байланысты. Амин тобының сс-кетокышқылға ауысуын жәнс бұл кезде жаңа аміш қышқылдарының түзілуін аминотрансфераза катализдейді. Бүл реакцияны 19, 37 ж. совет ғалымдары А. Браунштейн мен М. Крицман ашқан болатын. 2) Бұл коферменттер амин қыш-қылдарының декарбоксилденуін каталдиздейтіп лиазалар қүра-мына және гликогенді ыдырататын фосфорилаза күрамына кіреді.
р н н II I I
с-м-с-сн 2 -сн 2 -соон
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz