Ферменттер: анықтама, бөлініп алу мен тазарту, активтілікті өлшеу және химиялық құрылым


ЖОСПАР
ФЕРМЕНТ ДЕГЕН НЕ!2
ФЕРМЕНТТЕРДІ БӨЛІП АЛУ ЖӘНЕ ТАЗАРТУ4
ФЕРМЕНТТІҢ АКТИВТІЛІГІН ӨЛШЕУ5
ФЕРМЕНТТЕРДІҢ ХИМИЯЛЫҚ ҚҰРАМЫ ЖӘНЕ ҚҰРЫЛЫМЫ6
ФЕРМЕНТ ДЕГЕН НЕ!
Фермент дегеніміз - белоктық зат, ол организмдегі түрлі химиялық реакцияларды тездетуші. Химиялық реакциялардың жүрісін тездетушілерді катализаторлар деп атайтыны белгілі. Осыған сәйкес ферменттерді биологиялық катализаторлар деп те атайды, өйткені, олар тірі материяда әрекет жасайды. Фермент (латынның тілінде fermentum - ашу деген мағына береді) деген терминмен қатар әдебиетте энзим (грек тілінде - enzym, en - ішкі, zyme - ашытқы деген мағына береді) деген сөз де қолданылады.
Ферменттерді және олар катализдейтін реакцияларды зерттейтін биохимия бөлімі энзимология деп аталады. Ферменттер жөніндегі ілім қалай дамыды? Фермент қатысатын процестермен адам өте ерте кездерден бері-ақ таныс болатын. Тіпті ерте заманның өзінде-ақ қантты заттарды ашыту жолымен спирттік ішімдіктер алғаны белгілі. Ферменттер қатысатын процестерді ғылыми тұрғыдан зерттеу XVII ғасырдың орта кезінен басталады. Осы кезде Гельмонт қанты бар сұйық заттардың ашуы ерекше қоздырушылар көмегімен жүретінін анықтаған. Осыдан кейін Лавуазье ашу кезінде қант түгелдей көмір қышқыл газға және спиртке айналатынын анықтады.
XIX ғасырдың ортасында кейбір фермент препараттары (уыттан - амилаза, қарын сөлінен - пепсин, т. 6. ) бөлініп алынды. Сөйтіп, катализ және катализаторлар жөніндегі ілім жарыққа шықты (Берцелиус және басқалар) . Бұл кезде атқарылған зерттеу жұмыстары ферменттердің химиялық зат екенін, олардың негізі биологиямен байланысты екенін дәлелдеді.
Луи Пастер спирттің ашу процесін зерттеп мынадай қорытындыға келеді: ашу процесін жүргізетін химиялық заттар емес, ашытқының, яғни тірі клеткалардың тіршілік әрекеті болып табылады. Ол ферменттер тірі ашытқыдан ажырамайды, олармен біртұтас деп санады. Ашуға қатысты мұндай көзқарас 1897 ж. Бухнер ашқан тамаша жаңалыққа дейін ұзақ уақыт сақталып, келді. Ол құрамында тірі клеткалар жоқ ашытқы сөлін сумен бөліп алады. Осы сөлдің өзі-ақ қантты тез ашытып, спиртке және көмір қышқыл газға айналдырғанын көреді. Осылайша қантты ыдыратып ашытатын ашытқының тірі клеткалары емес, керісінше олар жасап шығарған фермент (химиялық зат) екенін дәлелдейді. Ферменттің қантты ашытқы өнімдеріне айналдыратын катализатор екенін анықтайды.
Спиртті ашу кезіндегі катализатордын химиялық табиғатын анықтау ферментті процестер жөніндегі зерттеуді алға апаруға дем беруші үлкен күш болды және соның нәтижесінде көптеген ферменттер бөліп алынып зерттелді. Ферменттер әсерінің теориясы (Э. Фишер, 1890 ж. ), ферментті реакциялардың кинетикасы (Л. Михаэлис пен М. Ментен, 1913 ж. ) жөніндегі жұмыстар жарық көрді. XX ғасырдың бас кезінде И. П. Павлов және оның әріптестері ас қорытушы ферменттердің белоктық табиғаты жөнінде өте маңызды мәліметтер алады. Олар иттің қарынындағы сөлдің активтігі оның құрамындағы белоктарға байланысты екенін анықтады. Қарын сөлінде белок аз болса, онда пепсин де шағын мөлшерде болды. Өз мәліметтерін және баска да ғалымдардың зерттеулерін талдай келіп, Павлов ферменттер дегеніміз - белоктық заттар деген қорытындыға келді.
Ең алғаш таза ферментті 1926 ж. жас биохимик Дж. Самнер кристалл түрінде алды. Ол канавалия деген өсімдік дәнінен уреаза ферментін бөліп алып, оның кристалдарының белоктан түратынын анықтайды. Бұдан кейін 1930 ж. Дж. Нортроп пепсин кристалдарын, ал келссі жылы сол Нортроп пен М. Кунитц екеуі кристалды трипсииді бөліп алады. Осы екі ферменттің екеуі де белок екен. Қазіргі кезде кристалдық түрде жүздеген фермент алынды. Зерттеліп табылған ферменттердің саны 2000 шамасынан асады. Олардың бәрі де белокты заттар.
ФЕРМЕНТТЕРДІ БӨЛІП АЛУ ЖӘНЕ ТАЗАРТУ
Ферменттер адамның, жануарлардың, өсімдіктердің тканьдерінде және микроорганизмдерде синтезделіп жасалады. Ферментті бөліп алу үшін ол көп кездесетін материалды (шикізатты) тандап алу керек. Егер фермент алынатын материал жануар ткані болса, онда ол тканьді басқа бөліктерден бөліп ажыратады және қанын жуып тазартады. Тандап алынған материалдағы ферменттер бұзылып кетпеу үшін, оны төменгі температурада (2-8°С) ұнтақтайды. Осылайша ұнтақталған біртектсс массаны центрифугаға салып өңдейді.
Ферменттер белоктық заттар болғандықтан, оларды алу үшін белокты бөліп шығаратын әдісті қолданады. Белокты шөктіріп тұнбаға түсірудің біріншіден центрифугаға аммоний сульфатын немесе органикалық ертікіштерді (этил спиртін немесе ацетонды) қосады. Бұл кезде ферменттермен қоса бүкіл белоктар дерлік тұнбаға түсіріледі. Бұдан кейін ферменттерді ептілікпен бөліп алу үшін ион алмасу хроматография әдісін қолданады. Әсіресе әр түрлі смолалар олардың ішінде ерімейтін ДЭАЭ-целлюлоза кең түрде қолданылады.
Полиакриламидті, крахмалды жүргізілетін электрофорез әдісімен де ферменттерді бөліп алуға болады.
Осыдан кейін бөліп алынған фермент препаратының біртекті тазалығын тексереді. Ферменттің тазалық дәрежесі оның меншікті активтілігімен бағаланады, бұл кезде ферменттің активтілігін 1 мг белокқа шағып есептейді. Әдетте ферментті тазарту жұмысын, осы істің келесі кезеңінде олардың меншікті активтілігі одан әрі артпайтындай деңгейге дейін немесе электрофорездеу, гель-сүзу, ионалмасу хроматография не ультрацентрифугалау кезінде тек бір ғана белок компоненті бөлінгенге дейін жүргізе береді.
ФЕРМЕНТТІҢ АКТИВТІЛІГІН ӨЛШЕУ
Бөліп алынған таза фермент өзінің ферменттік активтілігімен бағаланады. Ферменттік активтілік дегеніміз белгілі фермент бөлшегінің көмегімен нақты уақыт ішінде алынған субстрат шамасы. Мысалы, а-амилазаның осындай қасиетін зерттеп білу үшін 25 С С жағдайында және 1 минут ішінде 1 мг фермент ыдыратқан крахмал мөлшерін анықтау қажет.
Фермент активтілігінің өлшемі жөнінде энзимологияда мынадай ұғымдар қабылданған. Ферменттің халықаралық өлшемі Ө бас әрпімен («өлшем» деген сөздің бас әрпімен) белгіленеді.
Ферменттің халықаралық өлшемі дегеніміз - фермент әсерінің қолайлы жағдайында (рН, субстрат концентрациясы, т. б. ), 25°С температурада бір минут ішінде субстраттың бір микромолін (1 мкмол 10 6 мольге тең) катализдеп өңдей алатын фермент мөлшері.
Меншікті активтілік дегеніміз - ферменттік препараттағы бір мг белокқа тиісті фермент өлшемнің (Ө) шамасы; ол мкмоль 1 мин мг белок деп көрсетіледі. Меншікті активтілік ферменттік препараттың тазалық өлшемі: фермент тазартылған сайын, ол арта түседі және фермент таза күйге жеткенде, ол көрсеткіш ен жоғары және тұрақты болады.
Катализдік активтілік (символы - кат) дегеніміз -стандартты жағдайда 1 моль субстратты 1 с уақыт ішінде өндеп өзгерте алатын фермент мөлшері болып табылады.
Ферментті препаратта белоктың бар екенін Кьельдал әдісімен (жалпы азотты анықтап, ол көрсеткішті 6, 25 санына көбейтеді), немесе Лоуридің колориметриялық әдісімен анықтайды, ал тұнық және боялмаған ерітінділерде 280 нм кезінде Варбург пен Христианның спектрофотометриялық әдісі бойынша анықтайды.
ФЕРМЕНТТЕРДІҢ ХИМИЯЛЫҚ ҚҰРАМЫ ЖӘНЕ ҚҰРЫЛЫМЫ
Сонымсн, фермент дегеніміз биохимиялық реакциялар кезінде катализдік активтілік көрсететін белоктар екені белгілі болды. Ферменттердің бәрі де үлкен молекулалы қосылыстар, олардың молекулалық массасы (м. м. ) 10 мыңнан 1 миллионға дсйін, тіпті одан да көп шамаға жетеді. Мысалы, кейбір ферменттердің молекулалық массасын қарастырып көренік:
Рибонуклеаза, ұйқы безінікі 12 640
Химотрипсин, ұйқы бсзінікі 23 000
Пепсин, шошка қарыныныкі 34 000
Гексокиназа, бауырдыкі 100 000
Фосфорилаза., бауырдыкі 185 000
Каталаза, бауырдыкі 232 000
Уреаза 480 000
Глутаматдегидрогеназа, бауырдыкі 1 000 000
Синтетаза, май қышқылдарыныкі 2 300 000
Барлық басқа белоктар сияқты, ферменттер де химиялық құрамы бойынша екі топқа бөлінеді. Олар қарапайым ферменттер және күрделі ферменттер.
Қарапайым ферменттер дегеніміз - қарапайым белоктар, олар гидролиз кезінде амин қышқылдарына ғаиа ажырап бөлінеді. Қарапайым ферменттерге мыналар жатады: рибонуклеаза, пепсин, трипсин, химотрипсин, папаин, амилазалар жоне гидролаза класына жататын басқа да ферменттер.
Күрделі ферменттер дегеніміз - күрделі белоктар. Күрделі ферменттер екі беліктен: белоктық және белоктык емес бөліктен тұрады. Ферменттердің белоктық бөлігі апофермент деп, ал белоктық емес белігі простетикалық топ немесе кофактор деп аталады. Апофсрмент кофакторсыз (простетикалық топсыз) активті болмайды. Күрделі ферменттердің кофакторлары металл иондары немесе белоктық емес органикалық заттар. Мұндағы металл иондары активаторлар деп аталады. Активаторлар мына иондар: N8+, К+, Ғе 2 +, Ғе 3+ , Си 2 +, Со 2+ , 2п 2 ^-, М§ 2 +, Мп 2+ , Мі 2+ , Мо 2 -. 180 шамасынан астам ферментте металл иондары активатор қызметін атқарады.
Кофактор (простетикалық топ) белоктык емес зат болғандықтан кофермент деп аталады. Коферментті толығырақ қарастырамыз, өйткені ол ферменттік реакцияларда айтарлықтай қызмет атқарады.
Коферменттер (латын тіліндегі Ко - бірге және фермент деген сөзден шыққан) - құрамында белок жоқ органикалық қосылыстар, олар апорферментпен тығыз байланысқан. Ферменттің мықты байланысқан кофакторы - простетикалық топ. Көптеген ферменттердің активтігі үшін екі фактордың да - металл иондарының да, простетикалық топтың да (немесе коферменттің) болуы қажет.
Коферменттер - төменгі молекулалы заттар, олар жоғары температураға төзімді келеді және ферменттің белоктық бөлігінен оңай ажырайды. Мысалы, диализ кезінде осылай болады. Олар сөзсіз қажетті кофактор ретінде ферменттердің катализдік жұмысына қатысады.
Көптеген ферменттер витаминге жатады немесе витаминдер туындысы болып табылады. Коферменттерге активтік тобы бар витаминдер - тиаминпирофосфат (Ві витаминнің туындысы), никотинамидті коферменттер (РР витамині бар) жатады. В 2 , Вв, Ві витаминдері және басқа да витаминдер кіреді. Сондықтан да витаминнің жеткіліксіз болуы коферменттердің синтезін бұзады, соның салдарынан тиісті ферменттердің түзілуі тежеледі. Осыдан кейін зат алмасу бұзылады және адам мен жануарлар организмі бірқалыпты тіршілік ете алмайды.
Витаминдік емес коферменттер де бар, мысалы, металлпорфириндер (цитохромдағы гемдер), нуклеотидтер (УДФ-глюкоза), пептидтер (глутатион), т. б. осындай коферменттер. Мұндай коферменттер зат алмасудың аралық өнімдерінен түзіледі және әрқашан да организмде болады.
Биохимиялық реакцияларда коферменттер екі түрлі қызмет атқарады:
- Күрделі фермент құрамында субстраттың (субстрат дегеніміз фермент әсер ететін зат) катализдік өңделіп өзгеруіне қатысады, бұл кезде кофермент оның активті ортасына енеді;
- Бір субстраттан екінші субстратқа (немесе басқа ферментке) электрондарды, протондарды немесе жеке химиялық топтарды тасымалдайды.
Төменде коферменттердің сипаттамасы берілген.
1. немесе пиридиндік коферменттер НАД + және НАДФ+ (НАД + - , НАДФ~ - ) . Бұл коферменттердің активті белігі никотинамид (РР витамині) болып табылады, оның молекуласында пиридин сақинасы бар және ол пиридиндік коферменттер деп аталады.
НАД+ және НАДФ+ қандай да бір арнайы белоктармен (апорферменттермен) қосылып, тиісті ферменттер түзеді. Мысалы. пиридиндік дегидрогеназаны түзеді, ол фермент субстраттан сутегі атомдарын бөліп алып, тотықтырады. НАД + коферменті құрылым формуласы мынадай:
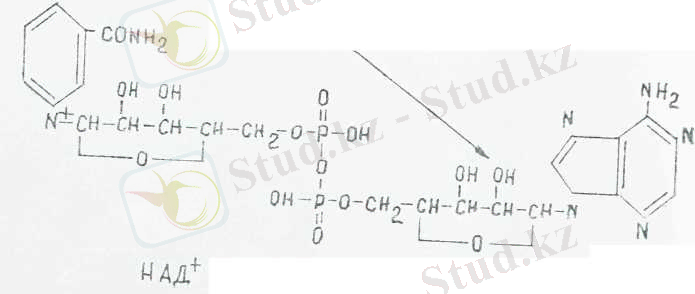 коферменті, тотыққан түрі
коферменті, тотыққан түрі
НАД және НАДФ НАДФ+ молекуласында бұл молекуласындағы пиридин сакинасында азот төрт валентті, бұл коферменттердің тотыққан түрі былай жазылады: НАД+ және НАДФ + . Биологиялық жолмен тотыққан кезде Н~ гидрид ионы (протон мен екі электрон) және Н~ протоны субстраттан бөлініп шығады. Бөлініп шыққан Н" гидридионы НАД+ немесе НАДФ+ байланысады да, НАДН және НАДФН коферменттеріне дейін тотықсызданады ал Н + протоны ерітіндіге ауысады. Осыған байланысты НАД+ пен НАДФ + екеуінін тотықсыздану реакциясы былай жазылады:
НАД+ +Н Н НАДФ+ + Н-
+ Н+ +- НАД - Н + Н+ + Н+НАДФ-Н + Н+
НАД+ пен НАДФ+ тотықсызданған кезде пиридиннің төрт валентті азоты үш валенттіге ауысады және субстраттағы гидрид-ион С 4 күйдегі никотинамидтік сақииаға ауысады. Тотыққан (I) және тотықсызданған (II) НАД пен НАДФ екеуіиің формуласы төменде келтірілген, мұндағы Рч - коферменттің қалдығын білдіреді.
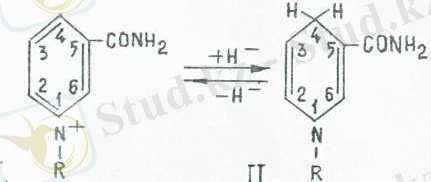
НАД+ және НАДФ+ коферменттері әдетте клеткада бос күйінде болады, бір ферменттен екіншісіне ауысып отырады. Олар көпшілік дегидрогеназада тек катализдік реакция кезінде ғана ферменттің белоктық бөлігімен байланысады. Сонымен қатар құрамындағы бұл коферменттер үнемі активті орталықта болатын дегидрогеназалар да бар. Биохимиялық реакциялар кезінде НАД = Н және НАДФ = Н сутегі атомдарын басқа қосылыстарды тотықсыздандыруға оңай береді. Олар осылайша тотығу-тотықсыздану реакцияларына қатысады.
НАД+ коферментіне қарағанда, НАДФ+ коферментінде бір фосфат тобы артық болады, ол топ, аденинмен байланысқан рибозаның гидроксил тобымен этерленген, НАД" 1 " пен НАДФ+ т- дерінің құрылымы жөнінде жақын қосылыс, бірінен-бірі түзіле алады, бірақ бірін-бірі алмастыра алмайды. Мұндағы жағдай мынадай: бір апоферменттер тек НАД+-қа ғана тән, екінші апоферменттер НАДФ+-қа ғана тән. Сондықтан да бұл дегидрогеназа - әртүрлі субстратты тотықтырады. Мысалы, глутар қышқылы НООС-СН 2 -СН 2 -СН 2 -СООН НАД- коферментінің қатысуымен тотығады, ал лимон қышқылы НООС-СгЬ-СОН -
і
соон
-СНг-СООН НАДФ+ коферментінің қатысуымен тотығады.
Осы жерде мынаны айту керек. рН = 7 кезде (организмнің ішкі ортасы осындағы) органикалық қышқылдар толық диссоциацияланып, иондарға ажырайды. Мысалы аспарагин қышқылы, глутамнн қышқылы диссоциацияланғанда аниондар мен протондар түзеді. Олардың аниондары аспартат, глутамат деп аталады.
НООС-СН 2 -СН 2 -СООН: Аспарагин қышқылы
-ООС-СН 2 -СН 2 -СОО- + 2Н-
Аспартат
Сондықтан бұл амин қышқылдары, катиондардың болғанына қарамай, аспартат, глутамат деп аталады.
Сол сияқты биохимияда - ат жалғауы басқа қышқылдарға қатысты да пайдаланылады. Мысалы, ацетат (сірке қышқылы), лактат (сүт қышқылы) пируват (пирожүзім кышқылы), оксалат, сукцинат, малат, фосфат, аденилат және т. с. с. Мұндай терминология ферменттер атауына қатысты да қолданылады. Мысалы, лактатдегидрогеназа.
әсер етуімен жүретін лактаттың тотығуын қарастырып көрейік, мұндағы кофсрмент НАД+.
фермент
СН 3 -СНОН-СОО- + НАД+ -+
-► СН 3 -СО- СОО- + НАД- Н + Н+
Пируват
НАД+ және НАДФ + коферменттері гликолиз, клетка тыныстануы, фотосинтез сияқты процестерде, сол сияқты сүт қышқылды ашу мен спиртті ашу кездерінде маңызды қызмет атқарады.
2. ФАД және ФМН флавиндік коферменттер.
(ФАД - , ФМН - флавинмонону-клеотид) . ФАД және ФМН коферменттері әртүрлі апоферменттермен байланысады да, флавопротеидті ферменттер - флавиндік дегидрогеназа түзеді. Қазіргі кезде флавопротеидтердің саны 80 шамасына жетеді және олардың көпшілігінде ФАД бар. ФАД және ФМН екеуі апоферменттермен мықты байланыскан және НАД + және НАДФ+ екеуінен айырмасы, катализдік реакция кезінде ферменттің белоктық бөлігіне байланысқан күйінде қалады. Сондықтан оларды простетикалық топтар деп атайды. ФАД
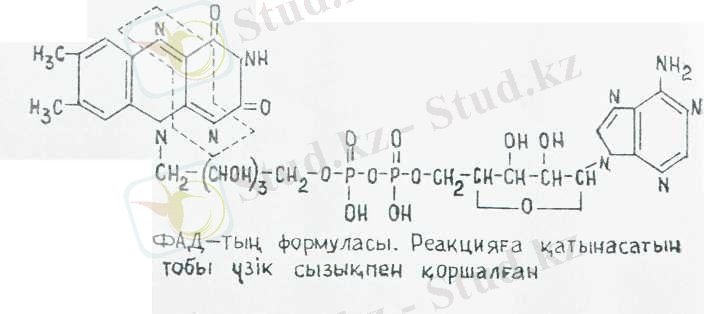
және ФМН екеуі топтарды бір ферменттен (субстраттан) екіншісіне ауыстырып, алмастыру қызметін атқармайды.
ФАД және ФМН коферменттердің актнвті бөлігі рибофлавин (В, витамині), онда изоаллоксазин сақинасы бар.
ФМН коферментінің ФАД коферментінен айырмасы - оның аденилді нуклеотиді болмайды, В 2 витамині құрамындағы рноитолдың алғашқы спиртті тобымен фосфат этерификацияланады.
Флавиндік дегидрогеназа (белок-ФАД) сутегі атомын бөліп алу жолымен (екі протон мені екі электрон) субстратты тотықтырады бұл кезде кофермент ФАД-Н 2 (белок- ФАД-Н 2 ) айналады Мысалы, ферменттердің осындай тобына жататын сукцинатдегидрогеназа сукцинатты қанықпаған фумаратқа дейін тотықтырады, субстраттан шыққан сутегінін екі атомы да ФАД-пен байланысады:
-ООС-СН 2 -СН 2 -СОО- + белок = ФАД-
-ООС-СН = СН-СОО- + белок- ФАД = Н 2
Қайтымды тотығу реакциясы жәие флавиндік коферменттердің тотықсыздануы аллоксазин сақинасына әсер етеді. Бұл жағдай сутегі атомдарын бөліп шығару және қосып алу жолымен іске асады. Формулада бұлар үзік сызықты квадраттар арқылы берілген.
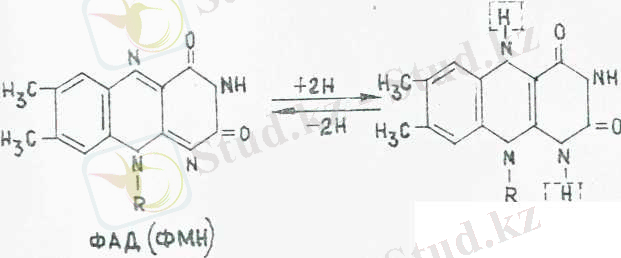
ФАД-Н 2 (ФМН-Н 2 )
Кейбір флавопротеидтердің активті орталығы құрамына металл иондары (Ғе, Мо, Си) енеді. Олар реакцияда электрондарды ауыстырып, алмастыру қызметін атқарады. Мысалы, ксактиноксидазада молибден, темір бар.
Рибофлавин және екі коферменттің екеуі де сары түске боялған, олар тотықеыздану кезінде лейкотүрге ауысады да, бояуы жоғалып кетеді.
Флавопротеидтер НАД-Н-дан немесе тотығатын субстраттан сутегі атомдарын митохондриядағы тыныстану тізбегіне ауыстырып жеткізуші сияқты қызмет атқарады. Осылайша молекулалық оттегімен оларды суға дейін тотықтыруға қатысады.
Сондықтан пиридиндік (анаэробты) дегидрогеназадан бөліп флавиндік дегидрогеназаны аэробты деп атайды.
3. ТПФ немесе ГДФ коферменті (ТПФ - тиаминппрофосфат, ТПФ - тпаминдифосфат) ТПФ коферменті Ві витаминінің туындысы, оның тиазол сақинасында күкірт бар. Ол апоферментпен мықты байланыскан болады және простетикалық топ деп саналады. ТПФ молекуласындағы активті бөлік - тиазол сақинасының -СН тобы, сол топтың көмегімен ол субстратпен байланысады.
ТПФ апоферментпен байланысып, декарбоксилаза түзеді, ол кетоқышқылдан көмір қышқыл газдың бөлінін шығуын катализдейді. Бұл реакциялар кезінде карбоксилдік топпен тікелей байланысқан көміртек - көміртектік байланыс бұзылады. Мысалы, ашытқы клеткаларында пирожүзім қышқылын декарбоксилдеуді пируватдекарбоксилаза ферменті мынадай схема бойынша катализдейді.
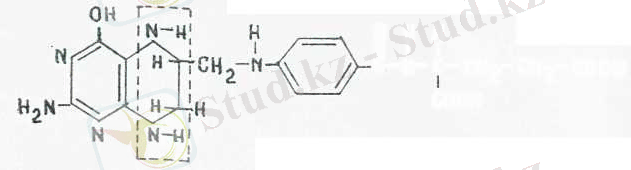
4. Кобамидтік кофермент. Бұл коферменттің активті бөлігі химиялық құрамы ең күрделі витамин - Ві 2 витамині. Ві 2 витамині молекуласында коррин циклы бар, ол төрт пиррол сақинасынан тұрады, сақиналар бір-бірімен өзара байланысады. Циклдың дәл ортасында кобальт атомымен байланысқан циан тобы орналасады. Сондықтан бұл витамин цианкобаламин деп аталады. Кобамидтік коферменттерде циан тобы болмайды, оның орнын метил мен 5'-дезоксиаденозин басады. Осыған сәйкес мынадай екі кофермент тузіледі: метилкобаламин және 5'- (5'-ДоАК)
Кобамидтік ферменттер өзіне сәнкес апоферменттермен қосылып, кобамидтік ферменттер тобын құрайды. Ондай ферменттер тобы мынадай реакцияларды катализдейді: 1) метилкобамидті ферменттер трансметилдену процесін катализдейді, мысалы, метионин, холин, А коферменті және басқа қосылыстардың биосинтезі кезінде метил тобының алмасып ауысуы; 2) кобамидтік ферменттер 5'-ДоАК коферменттерімен бірге заттар молекуласы арасында сутегі атомдарының алмасып ауысуын және жаңа көміртек-көміртектік байланыс түзілуін катализдейді. Атап айтқанда бұл ферменттер пуриндік және пиримидиндік негіздердің түзілуіне қатысады.
5. Пиридоксиндік коферменттер. Бұл коферменттердің негізі В 6 витамині, коферменттің құрамына бір-біріне ұқсас үш қосылыс: пиридоксин (пиридоксол), пиридоксаль және пиридоксамин кіреді. Ол үшеуі біріне-бірі оңай айналады.
В 6 витаминнің негізгі активті туындысы пиридоксаль-5-фосфат болып саналады, оның өзі бірқатар пиридоксальдік ферменттердің коферменті. Пиридоксаминфосфатта коферменттік қызмет атқарады.
Пиридоксиндік коферменттер азот алмасуға қатысатын көптеген ферменттің жасалуы үшін қажет. Пиридоксальдік ферменттер 30 шамасынан астам әр түрлі рсакцпяларды катализдейді. 1) Осы ферменттердің негізгі қызметінің біреуі амин қышқылдарын трансаминдеумен (қайта аминдеу) байланысты. Амин тобының сс-кетоқышқылға ауысуын және бұл кезде жаңа амин қышқылдарының түзілуін аминотрансфераза катализдейді. Бұл реакцияны 1937 ж. совет ғалымдары А. Браунштейн мен М. Крицман ашқан болатын. 2) Бұл коферменттер амин қышқылдарының декарбоксилденуін каталдиздейтін лиазалар құрамына және гликогенді ыдырататын фосфорилаза құрамына кіреді.
р н н II I I
с-м-с-сн 2 -сн 2 -соон
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz