Химияға кіріспе: материя, атом-молекулалық теория, периодтық жүйе және бейорганикалық қосылыстар


Кіріспе
Химия - материалдық әлемінде оның түрлерінің әртүрлілігі және олардың айналуы құбылыстарын зерттейтін жаратылыстану ғылымдарының бірі: Материя объективтік шындықты бейнелейтін философиялық категория адам санасына тәуелсіз, бірақ адам сол арқылы тәжірибие мен теориялқ зерттеуді бақылау құрал ретінде танып біледі.
Материяның негізі өмір сүру түрлері - зат және өріс. Зат дегеніміз өзіне тән массасы болатын бөлшек түріндегі материяны бір түрі. Өріс - бұл энергиямен сипатталатын материяның жеке бір түрі
Химияда зат дегеніміз берілген жағдайда *** анықталған физикалық қасиеті бар материяны жеке бір түрі. Мысалы, су, темір, күкірт. Қазіргі кезде алты милионнан аса әртүрлі табиғи және жасанды жолымен алнған заттар белгісі. Олардың барлығы химиялық эементтер қосылыстарынан түзілген. Химия - химиялық қосылыстардың қасиетін, құрылысын және құрамын зерттейді. Олардың алыну жолдарын өңдейді.
Көмір тек қосылыстары өте көп және олардың басқа элементтердің қосылыстарынан біршама айырмашылқтары бар. Сондықтан, көміртек қосылыстарының химиясы, органикалық химия деп аталатын жеке аймаққа бөлінген. Бейорганикалық химияға барлық басқа элементтер арасындағы өзара байлаысты оқыту жатады. Құрамында көміртек болмайтын үш жүз мыңнан аса қосылыстар кездеседі.
- Химияның маңызды түсініктері.
Химия ғылымының негізгі атом - молекулалық оқыту, материаның сақталу заңы, Д. И. Менделеевтің химиялық элементтерінің периодтық заңы химиялық құрлыс теориясы болп табылады.
Атом - молекулалық оқыту ғылыми теория ретінде ХІХ ғасырдың ортасында бекітіледі бұл теорияның негізгі ережелері мыналар:
- Барлық заттар молекуладан немесе иондардан және атомдардан тұрады.
Атом - оң зарядталған атом ядросынан және теріс заря зарядталған электрондардан тұратн электронейтрал бөлшек.
Атомдар молекула түзе отырып өзара әрекеттесуі мүмкін.
Молекула - заттың химиялық.
Қасиеттерін сақтап тұратын ең кіші бөлігі: ион - молекулалық немесе атомның беріп жіберген және қосып алған электрондар электрлік зарядталған бөлшегі
- Зат құрамына кіретін молекулалар атомдар және иондар үздіксіз қозғалыста болады. Химиялық бөлшектер арасында өзара таратылу мен тебу күштері болады. Бөлшектердің қозғалу жылдамдығы, әрбір затта болатын жылу энергиясыың қорына негізделген және заттың агрегаттық күйіне де байланысты болады.
- Барлық заттар, жай және күрделі заттар деп бөлінеді. Бір элемент атомынан түзілген заттар жай заттар деп аталады. Әр түрлі элемент атомдарынан түзілген заттар күрделі заттар деп аталады.
- Физикалық құбылыстар кезінде молекула құрамы өзгеріссіз қалады. Химиялық айналымдар кезінде бір молекуладан басқа молекулалар түзіледі. Атомдардың молекуладан айырмашылығы, химиялық реакцияларыда өзгермейді. Атом материалының химиялық бөлісуінің шегі болып табылады.
Жеке бір түрін айтады. Элементтерді химиялық белгілерімен жазу қабылданған. *** химиялық белгілер жүйесі қолданылады: әрбір элемент, латынша аталуының бір немесе екі әрпімен белгіленеі. Мысалы, мыс - Сирчит - Си, көміртек - Carbonium - С, химиялық белгі элемент аталуын көрсетуі де мүмкін, бір элемент атомы. Жай және күрделі заттардың молекулаларының құрамы химиялық формалар көмегімен бейнеленеді.
Зат құрамына кіретін химиялық элементтерді оларға сәйкес символдармен көрсетеді, ал элемент символының оң жағына төменге - әрбірэлементтің атомдар санын (индексін) көрсетеді.
Мысалы, жай зат 0 2 - оттегінің формуласы, оттегі молекуласының екі атомнан тұратынын көрсетеді. Н 2 SО 4 - күкір қышқылының формуласы, бұл молекуланың сутегінің екі атомнан, күкірттің бір атомнан, оттегінің төрт атомнан тұратынын көрсетеді. Жай зат түсінігін химиялық элемент түсінігімен шатастырмау маңызды. Жай зат пен химиялық элемент айырмашылығы аллотропия құбылыстары мысалында түсіндіруге болады, яғни элемент қасиеттерінде бірнеше жай заттау түрінде болуы мүмкін. Мысал, «0» оттегі элементі молекуласы екі атомнан тұратын 0 2 - (оттегі) жай зат түрінде болуы мүмкін, және молекуласы үш атомнан тұратын 0 3 (озон) жай зат түрінде де болуы мүмкін. Жай заттар, түсі, дәмі, тығыздығы және балқу температурасы т. с. с. қасиеттерінен сипатталады. Химиялқ элемент - бұл атомдар түрі. Химиялық элементтерді, атомдар қасиетерінен сипаттауға болады: ядро заряды, массасы, өлшемі, валенттілігі. Масса - ядро зарядынан кейінгі екінші маңызды сипаты болып табылады. Атомның нақты массасыграммен көрсетілген (килограммен) және Ма (Х) деп көрсетіледі, мұндағы х - элемент символы.
Мысалы, сутек, оттек, көміртек атомдарының массасы тең:
Элементтер атомдары массаның өз мәндерін еске ұстап, оларды пайдаланып әртүрлі есептер шығару қолайсыз.
Сондықтан атомдар массасының бірлігі ретінде - көміртегі атом массасының 1/12 бөлігі қабылдады. Бұл өлшем бірлік - массасының атомдық бірлігі деп аталады, және ол *** тең:
Берілген элемент атомның массасы, көміртегі атомы массасының 1/12 бөлігінен неше есе ауыр екенін көрсететін өлшем - салыстырмалы молекулалық массасы деп аталады - Ar (х) (r - индексі - relative - сөзінің бас әрпі «салыстырмалы» деген сөзді білдіреді) .
Атомның массасы, массасының атомдық бірлігінде көрсетілген элементтерді салыстырмалы атомдық массасына тең. Мысалы:
Элементтердің салыстырмалы атомдық масалары анықталған және Д. И. Менделеевті таблицасында сәйкес элементтер символдарнда орналасқан. Заттың салыстырмалы молекулалық массасы оның құрамына кіретін элементтердің салыстырмалы атомдық массаларының қосндысына тең.
Мысалы үшін:
Берілген заттың молекуласыны массасы, 12с көміртегі атомының массасының 1/ 12 бөлігінен неше есе ауыр екенін көрсететін өлшем - салыстырмалы молекулалық масса деп аталады.
мұндағы, Mm (х) - молекула массасы.
Атомдар бір - бірімен өздерінің валенттіліктеріне сәйкес қосылады.
Валенттілік - берілген элемент атомдарының басқа элемент атомдарының белгілі бір санын қосып алу қабілеті. Сутегі атомы бір валентті болып саналады, егер элемент атомы екі сутегі. Атомын қосып алса онда екі валентті, ал үш атом қосып алса үш валентті болып саналады.
Химиялық формулаларды графикалық түрде көрсетуге болады. Сонда элемент валенттілігін сызқшалармен белгілейді.
Мысалы:
Молекулаларда барлық валенттіліктер қаныққан болу керек, сондықтан бос сызықшалар - валенттілік - болуы мүмкін емес. Сонымен, сутегінің оттегімен қосылысына әр екі валентті оттегі атомына, екі бір валентті сутегі атомы сәйкес келу керек, ал үш валентті азот жағдайында - үш сутегі атомы болу керек.
Бұл жағдайда химиялық заттардың молекулаларының формулалары сәйкес элементтердің атомдарының валенттілігі негізінде құралады. Атомдардың валенттілгі, әрбір нақты зат құрамында тұрақты.
Сондықтан молекулалардан тұратын әрбір таза зат алыну жолына қарамастан сандық және сапалық құрамы тұрақты болады. Бұл құрам тұрақтылық заңы.
Бір заттың басқа заттарға айналуы химиялық құбылыс немесе химиялық реакция деп аталады. Химиялқ реакцияларды бастапқы заттармен алынған өнңмдерді формула түрінде жазып, химиялық теңдеу алады.
Химиялық реакциялардың тедеуін құрастыру маңызды екі принципке негізделген: 1) Кез - келген заттардың құрамы белгілі бір формулалармен жазылады; 2) Заттар арасындағы әрекеттену. Зат массасы сақталу заңына сәйкес жүреді. Химиялық айналуларда реакцияларға кіріскен заттардың массасы реакция нәтижесінде тіркелген заттардың массасына тең болады.
Химиялық реакциялар үшін зат массасы сақталу заңының мәні, атом массасы тұрақты, химиялық бөлінбейді және химиялық реакциялар кезінде бір молекуладан екінші молекулаға өтеді.
Химиялық теңдеулерді жазу кезінде бұл мүмкіндік тиісті коэффициенттерді қою жолымен сақталады.
Мысалы: күкірт қышқылы мен натрий гидроксидінің әрекетесуінен натрий сульфаты мен су айналады.
Мұнда заттар бастапқы мен реакция өнімдерінің формулалары элементтерді валенттілігі ержелеріне сәйкес жазылғанмен берілген химиялық реакция толық реакция теңдеуі болып табылмайды себебі зат массасынң сақталу заңы сақталмайды.
Теңдеуді құру үшін әрбір элемент атомдарының саны теңдеудің сол және оң жағында бірдей болу керек, бұл үшін бастапқы заттар мен реакция өімдерінің формулалары алдына *** коэффициенттерін қою керек. Біздің мысалымзда реакцияның толық теңдеуі мынадай болады.
Д. И. Менделеевтің периодтың заңы және химиялық элементтердің периодтық жүйесі.
ХІХ - ғасырдың ортасында алпыстан аса элемент ашылып зерттелді. Зертеушілер химиялық элементтер арасындағы өзара байланысты көрсетуге тырысты. Элементтерді классификациялауға, бірінші А. ***, сосын Я. Берцемеиус ұсыныс жасады. Элементтерді металдарға және металл еместерге болу пайда болды. Бұл болу, элементтер қасиеттерінің сапалық сипаттамалары негізінде жүзеге асырылды. Ғалымдар, элементтер қасиеттеріндегі айырмашылқтардың себептерін іздеу кезінде, элементтердің сапалық қасиеттерімен, сандық қасиеттерін сандық қасиеттерін байланыстыру қажеттілігін көрсететін элементтердің негізгі сандық қасиеті оның салыстырмалы атомдықмассасы болып табылады. Зерттеулер элементтер қасиеттерінің байланысын және олардың атомдық массаларын оқуға бағытталады. Д. И. Менделеевтің элементтерді жүйеге келтіруді негізі етіп оларды атомдық массаларын алды. Д. И. Менделеев элементтерді атомдық массаларыны өсу ретімен орналастырып, олардың қасиеттерінің өзгеруіндегі заңдылықтарды анықтады. Бұдан мынадай қорытынды шығарды: элементтерді атомдық масаларының өсу ретімен орналастырғанда, олардың қасиеттерінің периодты түрді қайталап келіп отыратынын байқады.
Бұл нені білдіреді? Элементтерді салыстырмалы атомдық массаларының өсу ретімен орналастырып, элементтер қасиеттерінің өзгеруін қарастырамыз:
Бұл қатарда, ** - активті сілтілік металл, ** ауыспалы қасиеті көрсетеді, бор - металл емес элемент, көміртек, азот, оттек, фтор - бұларда металл еместік қасиет көрсетеді. Фтордан кейін неон - газ.
Салыстырмалы атомдық массасның өсу реті бойынша орналастырғанда неоннан кейін натрийдің алдыңғы металл емес элементтерден айырмашылығы бірдей байқалады және ал металды қасиетіне ұқсас болады.
Егер элементтерді атомдық массаларының өсу ретімен орналастыруды жалғастырсақ:
Онда Na - натрий мен магнийдің металдық қасиетінен, алюминийдің екі жақты қасиетіне және ** метал еместік қасиетінің хлорға дейін өсуі байқалады. Бұл біртіндеп өзгеру, органда аяқталады да, одан кейін орналасқан калий литий мен натрийдің қасиетін қайталады.
Егер, элементтердің қасиеттерінің біртіндеп өзгеруі бойынша орналасқан көлденең қатарды бірінен кейін бірі орналастырса онда қасиеттері ұқсас элементтер бір тік қатарға түседі.
Химиялық элементердің, қасиетердің периодты өзгеруінің мәні Д. М. Менделеевтің периодтық заңында бейнеленеді.
Элементтердің қасиеттері, сондай-ақ олардың қосылыстарының формулалары мен қасиетері элементтердің атомдық массаларының мөлшеріне периодты түрде тәуелді болады. Периодтық заңды графикалық бейнелеу үшін көптеген варианттар бар. Д. И. Менделеев ұсынғанхимиялық элементтерді периодтық жүйесінің қысқа түрі классикалық түрі болып табылады.
Нағыз металлдық қасиет бірте - бірте өзгеріп бейметалдық қасиетке ауысатын, салыстырмалы атомдық массаларының өсуі бойынша орналасқан элементтердің көлденең қатарын период деп атайды. Қасиеттері бойынша ұқсас элементтер орналасқан тік қатарлы (столбец) «топ» деп атайды. Периодтар мен топтардың қиылысқан жерінде ұяшықтар түзіледі. Әрбір химиялық элемент, таблицада белгілі бір ұяшықта орналасады.
Таблицаның қысқа түрінде жеті период бар: 1, 2, 3 - период қысқа период деп, бір қатардан тұрады, 4, 5, 6- шы период ұзын период деп аталады, әрқайсысы екі қатардан тұрады, 7 - ші период аяқталмаған.
Таблицада тігінен сегіз топ орналасқан. Әр топ екі топшадан тұрады - негізгі А және қосымша В. Периодтық жүйеде барлық элементтер бірінен кейін бірі ретпен нөмірленген.
Таблицадағы элементтің нөмірі оның реттік немесе атомдық деп аталады.
Атом химиялық бөлінбейді, бірақ физикалық бөлініп, дискретті құрлысты болады. ХІХ - ғасырдағы физиктердің экспериментальдық жұмыстары, электронейтральды атомдардың теріс зарядталған бөлшек - электрондардан және оң зарядталған бөлшек - протондардан тұратынын көрсетті.
Электрон атомының жеңіл элементарлы бөлшегі, 1, 602 х 10
-19
кл теріс зарядты болады. Электрон зарядын жуықтап -1ге тең деп қабылдайды. Электронның массасы 9, 1095 х 10
-28
г те ал ең жеңіл элемент сутегі атомының 1/1836 бөлшегін құрайды. Электронды
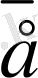 әрпімен белгілейді. Сутегі атомын жоғалтқанда электрондарда +1 - ге тең болатын оң зарядты бөлшек түзіледі. Ол протондар деп аталады.
әрпімен белгілейді. Сутегі атомын жоғалтқанда электрондарда +1 - ге тең болатын оң зарядты бөлшек түзіледі. Ол протондар деп аталады.
Протон заряды, электрон заряды белгісі бойынша қарама - қарсы және абсаенеттік өлшем бойынша тең болады, ал массасы 1, 673 х 10 -24 г - ға тең. Протонды Р символымен белгіленеді.
Э. Резерфорд, атом орталығында болатын оң зарядты тығыз бөлшекті эксперимент жүзінде көрсетті. Бұл бөлшек атом ядросы деп аталады.
1933 жылы, ядро құрамына кіретін нейрон деп аталатын электрлі нейтральды бөлшек табылады.
Оның массасының протон массасыга тең: 1, 675 х 10 -24 , нейронды n символымен белгіленеді.
Атом ядросының құрамына кір етін элементарлы бөлшектер - протондар мен нейрондар - нуклондар деп аталады. Атом ядросы мынадай маңызды параметрлермен сипаталады: ядро заряды - Z, массалық сан А.
1913 жылы Г. Мозли, ядроға протондар соның, яғни атом ядросының заряды периодтық жүйедегі элементтің реттік нөмеріне сәйкес келетінін тапты. Бұл жағдайда, элементтің реттік нөмері - Z, ядродағы протондар санын анықтайды. Массалық сан
- А - протондар мен нейтрондар қосындысын анықтайды: А = Z + N. Қазіргі кезде, атом ядросының және оның сипаттамаларының мынадай жалпы қабылданған кқріністері болады.
Символдың төменгі сол жағына ядро заряды қойылады, ал жоғарға жағына массалық сан қойылады. Мысалы, көміртек атомының ядросы былай
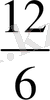 С белгіленеді. Бұл, ядро зарядының 6-ға массалық санының - 12 ге ал нейтрондар санының - N - массалық сан мен ядро зарядының айырмасына тең екенін білдіреді.
С белгіленеді. Бұл, ядро зарядының 6-ға массалық санының - 12 ге ал нейтрондар санының - N - массалық сан мен ядро зарядының айырмасына тең екенін білдіреді.
1910 жылы Ф. Содди, ядрода протондардың бірдей саны, ал нейтрондар саны әр түрлі болатын бір элемент болатынын тапты. Мұндай, бірдей протондар саны бар, бірақ массалық сандар әртүрлі болатын атомдар изотоптар деп аталады. Мысалы оттегі
изотоптар түрінде кездеседі.
Химиялық элементтің салыстырмалы атомдық массасы жеке изотоптардың олардың табиғатта таралуына байланысты атомдардың орташа арифметикалық салыстырмалы атомдықмассасына тең. Мысалы хлор изотоптары болып табылады.
Табиғатта хлор атомының 76% - нің массалық саны 35 және 24%, - 37% болады. Бұдан. Хлор атомының салыстырмалы атомдық массасы: - ке жақындаған.
Периодтық жүйеде әрбір элемент элемент символы көрсетілген, оның ядро зарядына тең болатын реттік нөмері және салыстырмалы белгілі бір торға орналасқан.
2. 1. Д. И. Менделеевтің периодтық жүйесінде элементтердің орналасуы бойынша қасиеттерін анализдеу
Әрбір период, біріншісінен басқасы сілтілік металдардан басталып, инертті газдармен аяқталады, кіші периодтарға бір элементтер басқа элементке өтуі кезінде олардың қасиеттерінде біршама ауытқулар байқалады. Үлкен периодтарда металдық қасиеттен бейметалдық қасиетке өту баяу жүреі.
Әрбір топтың негізгі топшасына кіші периодтардың элементтері жатады, және олар қасиеттері бойынша үлкен период элементтеріне ұқсас болады. (1 топ) . Қосымша топша тек үлкен период элементтерінен тұрады.
Негізгі топша элементерінің, қосымша топша элементтерінен қасиеттері бойынша біршама айырмашылықтары бар, әсіресе бұл бірінші, ІІ және VІІ топтың негізгі топшасы типтік бейметалдар, ал қосымша топша - металдық қасиет көрметеді.
Бірақ, үшінші топта барлық элементтері қасиеттері бойынша ұқсас. Топтарда элементтің реттік нөмері өскен сайын металдық қасиеті артып, бейметалдық қасиеті келеді.
Элементтердің көпшілігі металдар, Металдар, І және ІІ топта, сондай-ақ барлық топтардың қосымша топшаларында орналасқан.
Металдар үшін, жай заттар сияқты электр өткізгіштік, жылу өткізгіштік, металдық жылтыр, созылғаштық тән.
Металдар химиялық реакцияларды тотықсыздандырғыштар, оксидтер, негіз қасиеті болатын гидрооксидтер түзеді.
Металдық қасиет, периодтық, жүйенің сол жағындағы төменгі бұрышына орналасқан элементтерден түзілген жай заттарда айқын көрінеді. Таблицаның оң жағында, жоғары бұрышқа орналасқан элементтер бейметалдар. Металл емес элементтерден түзідге жай заттар, электр тогы мен жылуды нашар өткізеді.
Металл емес оксидтерге, қышқылдар класына жататын гидроксидтер жатады.
Металдық элементтер, металл емес элементтерден бордан астатқа дейін жүретін диагональ сызығымен бөлінген. Бұл сызық басында металдық та, металеместік те қасиет көрсететін элементтер орналасқан. Оларға, бор, креминет, германий, мышьяк, сурьма, теллур және астат жатады және олар жартылай металдар деп аталады. Сонымен, период ішінде типтік металдан, типтік бейметалға өту біртіндеп екі жақты табиғатты элементтер арқылы жүреді.
- Элементтер қосылстары.
Жай және күрделі бейорганикалық заттарды классификациясы.
Химиялық элементтер, құрамы мен қасиеті жағынан көптеген қосылыстар түзеді. Осы қосылыстар көптүрлілігін талдау үшін классификация түзіледі. Классификация - бұл оқылатын заттарды олардың кең тараған белгілері бойынша және басқа затардан немесе кластардан айырмашылықтары бойынша топтарға бөлу. Мұндай жағдайда, классификациалаудың негізгі принципі - бұл кейбір белгіліердің бөлінуі және кейбір таңдалғанбелгілердің болмауына байланысты объектілердің бөлінуі: Мысалы, бейорганикалық қосылыстардың құрамын негізге алатын болсақ, алда оларды жай заттарға және күрделі заттарға бөлуге болады.
Жай затарды қасиеттері бойынша мателдарға *** және металл еместарге *** бөледі. Күрделі заттарды құрамы және қасиеті бойынша негігі кластарға бөлуге болады: оксидтер, негіздер, қышқылдар, тұздар.
Бейорганикалық заттарды классификациялаудың схемасы.
Қосылыстарға атомның күйін сипаттау үшін «тотығу дәрежесі» түсінігі қолданылады.
Тотығу дәрежесі -
Оксидттер - екі элемент атомынан тұратын және оның біреуі «-2» тотығу дәрежесін көрсететін оттегі болатын күрделі қосылыс.
Негіздер - құрамына оң тотығу дәрежесін көрсететін металлдар мен «-1» дәрежесі оң - гидроксид тобы кіретін қосылыс.
Қышқылдар - молекуласы сутегі «Н +1 » ионнан және қышқыл қалдығынан тұратын қосылыс.
Тұздар - құрамына металл иондармен қышқыл қалдығы кіретін қосылыс.
3. 1 Оксидтер.Оксидтердің формулаларын құрастыру.
Элементтердің белгілі тотығу дәрежелері бойынша қосылыстардың формулаларын құрастыру үшін мына ережелерді есте сақтау керек:
- Сутегінің қосылыстарда тотығу дәрежесі негізінен «+1» ге тең, (активті металдардың гидридтерін *** және *** есептелгенде)
- Оттегінің қосылыстарында тотығу дәрежесі «-2»-ге тең (*** қоспағанда) .
- Элементтің жоғары оң тотығу дәрежесі элемент орналасқан топтық нөмеріне тең, Мысалы, **
- Металл емес элементтердің төменгі теріс тотығу дәрежесі 8 минус топ нөмірінен тең. Мысалы азот үшін:
***
- Атомдардың жай заттарда тотығу дәрежесі ***
- Молекуладағы барлық элемент атомдарының тотығу дәрежесінің алгебралық қосындысы нөлге тең, яғни кез - келген молекула электронейтральды.
**
**
- Банарлы қосылыстарда, үнемі элементтердің біреуі оң, екіншісі теріс тотығу дәрежесін көрсетеді.
Оксидтер - оттегі «-2» тотығу дәрежесін көрсететін бинарлы қосылыс, ал мұндағы екінші элемент оң тотығу дәрежесін көрсетеді.
Элементтердің жоғары оксидтерінің формулаларын құрастыру кезіндегі операциялардың жүйелілігі мналар:
- Элементтің эимиялық символы және оттегі қатар жазылады: бірінші элемент, сосын оттегі. Мысалы, ванадийді жоғары оксидінің формуласын былай жазу керек: ***
- Ванадий бесінші топта орналасқан сондықтан оның жоғары оң тотығу дәрежесі +5. Оттегі оксидтерінде «-2» тотығу дәрежесін көрсетеді. Элемент символдарының жоғары жағына +5 -2 тотығу дәрежелерін жазамыз. ***
- Элемент символдарының төменгі оң жағына ваннадиттің барлық атомдарының оң тотығу дәрежелері қосылған және оттегінің барлық атомдарының теріс тотығу дәрежесінің қосындысы алынған цифрларды жазамыз (бұл жағдайда ***) бұл нәтижесінде электронейтралды молекула түзуге әкеледі.
**
**
Сонымен ІІІ - период элементтерінің оксидтерінің оксидтерінің жоғары тотығу дәрежелері мәндеріне байланысты түрде болады.
Егер элемент топ нөмеріне сәйкес емес тотығу дәрежесін көрсететін оксид түзсе, онда бұл оксидтің аталуында бейнеленеді: Мысалы, (ІІІ) азот оксиді
Оксид формуласы бойынша, оны түзейтін элементтің тотығу дәрежесін анықтауға болады. Мысалы, азот оксидіндегі ** азоттың тотығу дәрежесін аықтау оксидтегі оттегінің тотығу дәрежесі «-2» болғандықтан, оттегінің бес атомының тотығу дәрежесінің қосындысы . Оксид молекуласы электронейтральды болу үшін, азоттың екі атомының тотығу дәрежесінің қосындысы (+10) болу керек, бұдан азоттың бір атомының тотығу дәрежесі ке тең.
Атомдардың астына сәйкес тотығу дәрежелерін көрсетеміз.
**
**
Жаттығу:
- Элементтердің жоғару оң тотығу дәрежелерін көрсетеміз: алюминий, *** молибденнің, скандий, көміртектің, селеннің кадлийдің, қорғасынның, фосфордың, каллцийдың, техницийдің және вольфрамның.
- Келтірілген элементтердің ішінен жоғары тотығу дәрежесі ға тең элементтерді көрсетіңіз: азот, күкірт, хром, сурьма, қалайы, индий, берилмий, бермилий, марганец, ниобий.
- Мына элементтердің жоғарғы оксидттердің формулаларын құрастрңыз: скандий, цирканий, хлор, ниобий, көміртек, хром, марганец, цезий, фосфор, осмий.
Оларды атаңыз
- ** формуласына сәйкес келетін барлық элементтерді атаңыз.
- ** период элементтерінің жоғарғы оксидтерінің формулаларын құрастырыңыз.
3. 1. 1. Оксидтердің наменклатурасы.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz