Электролиз және электрохимиялық процестер: қағидалар, механизмдер және өнеркәсіптік қолданылуы


ЖОСПАР
Электролиз. 1
Иондық топтың тізбектілігі. 6
Электролиздегі екінші процестер. 8
Электролиз заңдары10
Балқымалардың электролизі11
Органикалық қосылыстардың эллектрохимиялық тотықсыздануының процесстері. 13
Гальваникалық әдістің негізін қорғаныш жабындарында түсіндіру. 13
Аккумуляторлар. 16
Отын элементінің проблемасы17
Кейбір гальваникалық элементтердің өнеркәсіп пен транспортта қолдануы. 20
Ішкі тізбектігі электрохимиялық процесстер. 20
Эксперименттік бөлім21
Әдебиеттер. 23
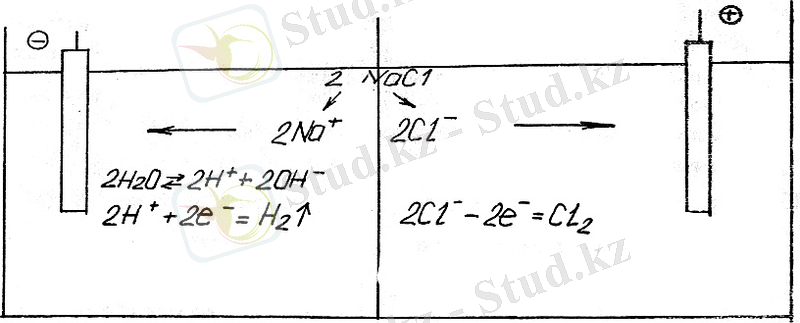
Электролиз.
Электролиз дегеніміз ерітінді немесе балқыған электролит арқылы электр тоғын өткізгенде электродтарда жүретін тотығу-тотықсыздану процессі.
Бұл процесстер химиялық энергияның электр энергиясына айналуынан шығады.
Электролизді іске асыру үшін сыртқы тұрақты ток көзінің оң полюсіне бір электрод жалғастырылады. Бұл электрод анод деп аталады. Анод + тотығу процессі жүреді. Басқа электрод сыртқы тұрақты ток көзінің теріс полюсіне жалғасады. Бұл электрод катод деп аталады. Катодта - тотықсыздану процессі жүреді.
Электролиз анодтары 1) ерімейтіндер, 2) ерітіңдер, болып бөлінеді.
Ерімейтін анод электролизінде металл бөлінеді. (электростракция) .
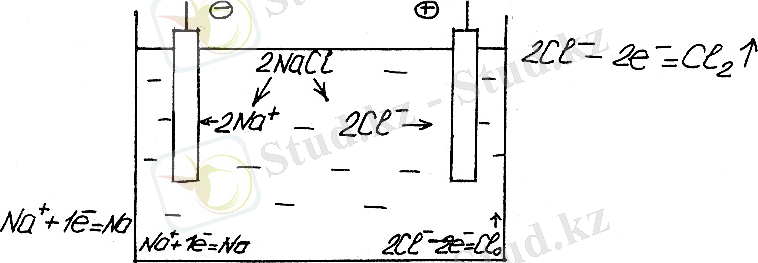
Ерімейтін электродтағы хлор сутек ерітіндісінің электролиз схемасын қарастырамыз.
диафрагма
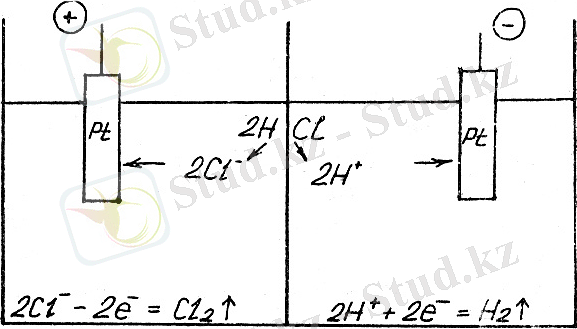
Ерімейтін анодтар алтыннан, пластинадан, графиттен және басқалардан жасалады. Ерімейтін анод электролизінде ион түрінде ерітіндіге өтпейді.
Берілген жүйеде электродтардын біреуі электролитттік ұяшықта сутектік электрод, ал екіншісі-хлорлы электрод деп аталады.
Бұл электродтардың стандарттық потенциалдары мынаған тең:
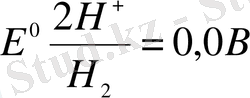 және
және
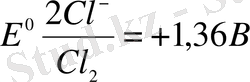
ЭҚК=
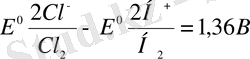
Сірә, бұл ЭҚК-і сыртқы электр көзінен қарама-қарсы жаққа бағытталған ЭҚК-ін жеңу керек.
Электролизде сутек ионы мен хлор ионы топ процессі үшін ток кернеуінің күшею жиынтығы мен электролит кедергісін жеңуде соңғысына ЭҚК-ін қосу керек.
Катодтық асқын кернеу - катодқа жіберілетін қосымша кернеу (мұнда катод потенциалы теріс жаққа қарай ығысады) .
Анодтық асқын кернеу - анодқа қосымша кернеу (мұнда анод потенциалы оң жаққа ығысады) .
Е і ток арқылы өтетін электрод потенциалы Е 0 тоғы жоқ электрод потенциалынан айрылады.
1) Егер электролиз кезінде электродта тек қана бір реакция жүрсе, (мысалы, катодтағы металл ионының тоғы), онда Е і - Е 0 = η болады, бұл айырмашылық асқын кернеу деп аталады.
2) Егер электролиз кезінде электродта біруақытта 2 немесе одан да көп реакция жүрсе, онда Е і - Е 0 = η поляризация деп аталады.
Бірінші жағдайда асқын кернеу мен поляризация бірдей болады. Асқын кернеу электродтвқ процесс өткен кезде кедергі болады.
Катодтағы асқын кернеуде ескертіледі, судағы ерітіндіде гидраттанған тоқтың өтуі анодта энергия шығынымен байланысты, ал сонымен бірге катод бетіндегі ерітіндіден метал иондарын тасымалдау, кристалдық торда түзілген атомдарға енеді.
Катодтық сияқты анодтық асқын кернеуде электрод материалдарынан, беттік күйінен, электродтағы ионды алып тастаған табиғаттан және электрод аудан бірілгендегі ток күшінен тұрады.
Катодтық асқын кернеу сутегі бөлнгендегі өте үлкен мағынаға ие болады. Платинада нөлге жақын болып, ал басқа электродтарда белгілі өлшемге ие болады. (акад. А. Н. Фрумкин) .
Электролиз басталғанда жалпы ұсынылатын электролиттік ұяшықта сыртқы электр көзінің кернеуі кернеулер айырмасы деп аталады. Басқа мысалдар - су электролизі, электрөткізгішті ұлғайту үшін суға Na 2 SO 4 тұзы қосылады. Ерімейтін электрод Pt-ны аламыз. Катод пен анод процессінде тотығу және тотықсыздану реакцияларын келтіру мүмкін.
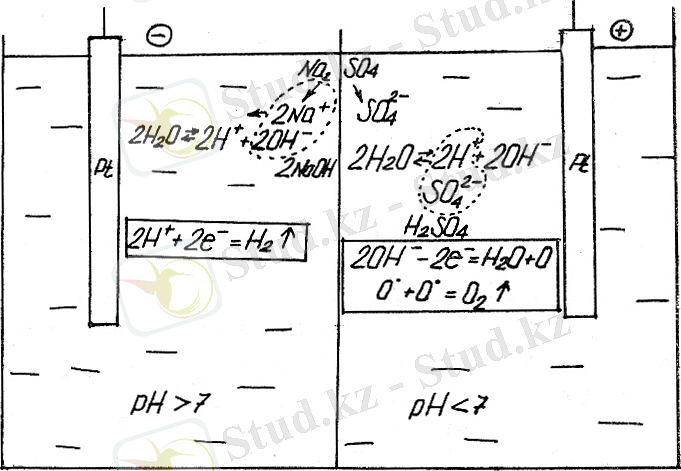 диафрагма
диафрагма
Катодта сутегі, ал анодта - өттегі бөлінеді.
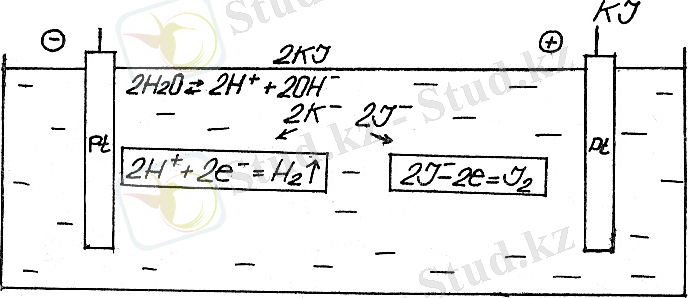 Үшінші мысал - KJ судағы ерітіндінің электролизі.
Үшінші мысал - KJ судағы ерітіндінің электролизі.
2) Еритін анодтағы электролиз.
Еритін анодтар - электролиз, процессі кезінде бөлінетін, немесе ерітіндіде иондар түріне өтетін электродтар.
Еритін анод электролизі металлдардың жоғары жиілігін алу үшін, соын ішінде электролиттік тазартылған мыс алу үшін қолданылады.
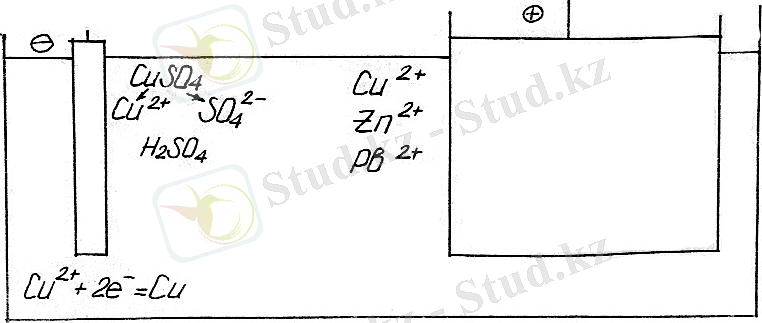
Қышқылданған H 2 SO 4 электрөткізгіштігі өсуі үшін CuSO 4 электролизін қарастырамыз.

Еритін анодта реалдық процесстер крделі, себебі еру иондар сольватациясы мен басқа процесстерде жүреді.
Катодтық процесс: Cu 2+ +2e - =Cu.
Анодтық процесс: Руда еріген өттегі параллель болып
Cu-2e - =Cu 2+ тотықсызданады /Н 2 О/ құрамы өседі.
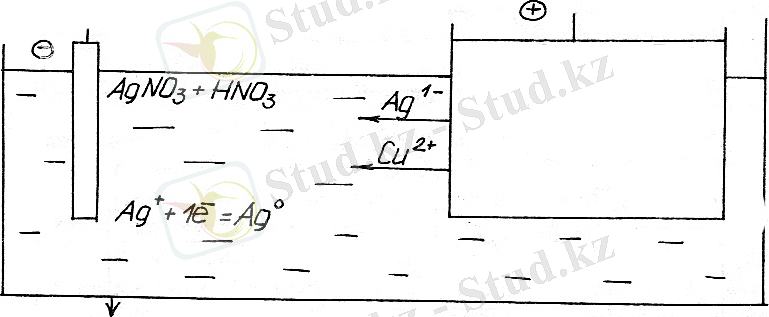
Еритін анодтар электролиттік тазартылған күмісте де қолданылады.
Тазартылған алтын және басқа металлдарда өтеді.
Судағы ерітіндіде металл тұздары арқылы электр тоғы һткенде электрод потенциалы -0, 41в, - кіші катодта металл иондары емес, ал су молекулалары.
Мысалы судағы ерітіндінің электролизі.
Иондық топтың тізбектілігі.
1. Сутектің асқын кернеу мен сутектік электродтың тепе-теңдігі.
Электролит ерітіндісіне платинадан жасалған электродты салсақ, қаныққан газ күйіндегі сутектен мыналар белгілі болады, сутегі иондары мен атомдарының адсорбциялануы, молекулалар арасындағы тепе-теңдіктердің орналасуы шығады.
Н 2 2Н 0 2Н + +2е -
Потенциал ерітіндідегі а н сутегі иондарының активтілігі мен ерітінді үстіндегі газ түсетін сутегінің порциалдық қысымнан тұрады да мына теңдеумен анықталады.
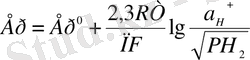
Сутегі электродының тепе-теңдігі үшін жалпы қабылданған электродтық потенциалдар өлшемінің анықтамасында Ер нөлге тең деп саналады.
Электрод арқылы ток өткенде (І) тепе-теңдік бұзылады, электрод бетінде ток бағытына байланысты молекулярлық сутегінің түзілуімен электрохимиялық реакцияда сутегі иондарының тотықсыздануы немесе сутегінің қайтымды реакциядағы ионизациясы жүреді. (егер электрод анодта қызмет етсе), (егер электро катодта қызмет етсе) .
Электрод потенциалы тепе-теңдік мәнінен бірінші жағдайда теріс жаққа, ал екінші жағдайда оң жаққа, ал екінші жағдайда оң жаққа η к =Ер-Е (3) немесе η а =Е-Ер (4) ток өтетін потенциал асқын кернеуге қарай қозғалады.
Асқын кернеу катод реакциясы үшін η к теріс, ал анод реакциясы үшін η а оң болады.
Асқын кернеу өлшемдері мыналардан тұрады.
- табиғаттағы металл электродтары.
- Ерітіндінің құрамы.
- Температура және басқа факторлар.
Мысалы.
Көптеген берілген тәжірибелерде жүргізілгендей, электродтардың
көбісі біріншіге жақындап, асқын кернеу өлшемі арасындағы сызықтық байланыс пен ток тығыздығының логарифмесін байқауға болады
η = а + b * 2, 3lgi
Тафел теңдеуі
а константасы асқын кернеудегі тоқтың тығыздығының өлшемі. Өлшем бірлігі
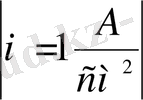 тең, табиғаттағы металл электродтарынан оның бетіндегі күйден, ерітіндінің құрамы мен температурадын тұрады.
тең, табиғаттағы металл электродтарынан оның бетіндегі күйден, ерітіндінің құрамы мен температурадын тұрады.
b - константасы табиғаттағы металдан немесе ерітінді құрамынан аз тұрады.
 -қа жақын мәні көптеген металлдар үшін қабылдайды.
-қа жақын мәні көптеген металлдар үшін қабылдайды.
Механизм реакциясы түсіндіру үшін b мен
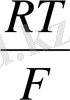 арасындағы өлшемдер қатынасын қою керек, мұндай байланыс (6)
арасындағы өлшемдер қатынасын қою керек, мұндай байланыс (6)
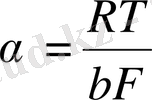 қатынасымен жиі анықталады.
қатынасымен жиі анықталады.
мұндағы α - бірқанша тұрақтылық онда (5) теңдеу (7) түрді қабылдайды.
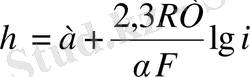
Көптеген металлдар үшін α=0, 5.
Мысалы. Мырыш сульфатының қышқыл ерітіндісі электролизінде катодта бірінші кезек сутегі иондары бәсеңдеп
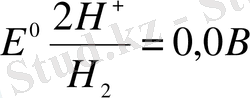 , ал потенциал
, ал потенциал
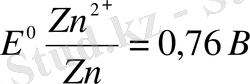 , бірақ асқын кернеу сияқты мырышта сутегі өте үлкен - 1, 1 в, онда көрсетілген жағдайда мырыш бөлінеді.
, бірақ асқын кернеу сияқты мырышта сутегі өте үлкен - 1, 1 в, онда көрсетілген жағдайда мырыш бөлінеді.
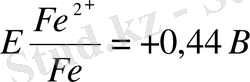 дегенмен асқын кернеу сияқты (0, 5в) мұнда да сутегі бөлініп шығады.
дегенмен асқын кернеу сияқты (0, 5в) мұнда да сутегі бөлініп шығады.
Электролиздегі екінші процестер.
Мырыш (Zn 2+ ) ионының катодтағы тотықсыздануының электродтық процесстерін қарастырамыз.
Мырыш металлдың электртерістігі катодта сутегі ионының топтарын күтуге болады, мырыштың шөгуін емес.
Бұл қышқыл ерітіндіден мырыштың шөгуін катодта мүмкіндік береді. Мырыш электродындағы реакцияда басты электродтарды сульфатты қышқыл ерітіндісіне салғанда, мырыш ионынан тұратын төмендегілер:
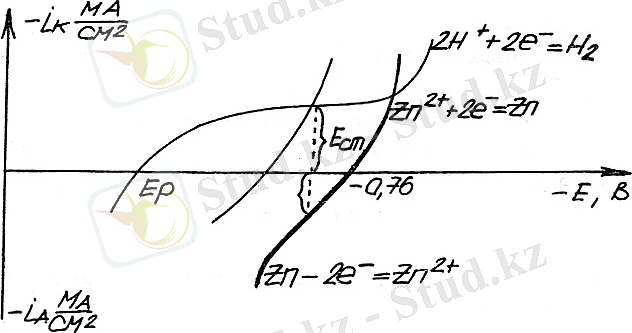
Е ст - компромистық (стационарлық) потенциал.
Катодтағы тоқтың тепе-теңдігі мен иондық тобы Н + және анодтағы тоқтың мырыш ионизациясы сипатталады. Қисық сызықта көрсетілгендей: 1) алғашқыда сутегі бөлінеді; 2) сонан соң белгісіз, Н 2 мен Zn, Н 2 бөлінгенде қосымша процесстер деп аталады.
Металлдардың бөліну технологиясының басқару мысалдарын қарастырамыз. Сутегі мен никелдің бірігіп бөлінген қисық сызықта схемасы:
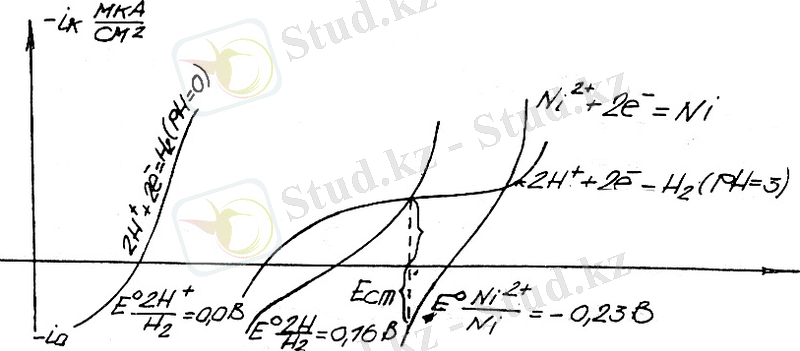
Суреттегі 1-ші қисық сызық рН=0 болғандағы сутегінің бөліну реакциясына жауап береді. 2-ші қисық сызық осы реакциядағы рН-та. 3-ші катод қабатына жауап береді. Сутегі электродының тепе-теңдік потенциалы электртерістік мәні көп жаққа қарай қозғалады шамамен - 0, 1 в. Көрсетілгендей рН=0 болғанда катодта никелдің қанша рет бөлінгенінен шықпайды; рН=3 болғанда тепе-теңдік потенциалының қозғалысы мен асқын кернеудің өсуі сутегі бөлінетін реакцияда көбінесе никель бөлінетіні пайда болады.
Байланысқан екі металлдың бірілгін қалпына келуі орынға ие болатын, негізгі сызықта жоғарыда көрсетілген металл мен сутегінің қалпына келу үшін сәйкес келеді. Алынған құйманың структурасы металлдар концентрациясымен анықталады. Алынған құйма катиондар разрядын жеңілдетеді.
Сайланған ерітіндіге сәйкес келетін және катод потенциалын берілген құймалар құрамынан алуға болады. Мысалы, темірден жасалған бұйымдарға электролиз болатындар мыс құймасы мырышпен (латунь) мырыш қалайымен (бронза және т. б. ) .
Электролиз заңдары
Электролит арқылы өткен ток мөлшері мен электролиз кезінде бөлінген заттардың арасындағы сандық байланысты Фарадей заңдары көрсетеді.
Анодта тотығатын немесе катодта тотықсызданатын заттың мөлшері заттың электрохимиялық эквиваленті мен жүріп өткен тоқ мөлшеріне тура пропорционал m=KQBm.
мұндағы 1) Q=it (жүріп өткен толық мөлшері)
2) F=Ne - (электрон зарядандағы Авогадро санының көбейтіндісі)
3)
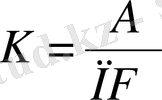
Жалпы түрін былай көрсетуге болады.
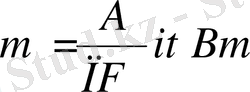 ; і - ток өлшемі, А;
; і - ток өлшемі, А;
Q - кулон
t - жүріп өткен тоқтағы уақыт
П - электрон сандары, тотығуды қабылдайтын немесе
тотықсыздануды беретін
Bm - тоқ шығымы.
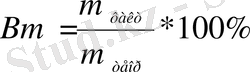
т теор . - қатысатын теория жүзіндегі заттың мөлшері, т теор = K*Q электрохимиялық процессте.
Көп жағдайда реалдық электрохимиялық процесстердің мөлшері шынында затқа әсерін тигізетіндерден теориялық есептеу шамаларынан айрылады.
Шындығында әсерін тигізетін заттың ауытқу дәрежесінің мөлшері теориялық өлшемнен, Фарадей заңы бойынша есептеуден, ток шығымы бойынша сипатталады.
Балқымалардың электролизі
Балқымалардың электролизін бос күйндегі натрий мен калийдің бөлінуінен бұдан 150 жыл бұрын Г. Деви қолданған болатын.
Балқытылған қосылыстардың электролизі көптеген металлдардан, құймалардан және металл еместерден алынуы мүмкін болады.
Өнеркәсіпте бұл әдіспен алудың мәні, негізінде металл өндірістері үшін электродтық потенциалдың электртерістігі көп болып судағы ерітіндіден алуға мүмкін болмайды.
Бұл жоғары емес балқу температурасы мен жоғары химиялық активтікке игеретін жеңіл металлдар деп аталатын топқа жатады.
Балқытылған электролиттер процессі судағы ерітіндінің электролиттері сияқты электрохимия заңымен байланысады.
Дегенмен жоғары температурада химиялық реакцияның жылдамдығы тез өседі. Электролит пен электролиз өнімдері сонымен қатар электрод материалдары мен электролиздер өзара әсерін тигізеді.
Сондықтан жай реакциялар күрделі реакцияға айналады.
Әдетте, электролиттер жеке балқытылған қосылыстардан емес, ал қоспалардан тұрады деп аталады.
Соңғысынан мынаны таңдаймыз берілген температура процессі үшін электролиз өте төмен рационалда жүреді.
Керекті жағдайда электролит құрамын сайлау үшін мыналар болады, негізгі электродтық процесстерді бұзбау үшін өзінің электрохимиялық құрамына қосу керек.
Мысалы. 1. Балқыманың электролизі.
Негізгі күрделілігіне мыналар жатады 800 0 С-та балқиды, ал Na Т пл =883 0 С болады.
Бұл температурада бәрі түгелімен бұға айналады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz