Атом құрылысы және электрондардың кванттық сипаттамалары


Атом құрылысы туралы шағын мәліметтер
Заттың химиялық қасиеттері химиялық реакция кезінде табиғи қарапайым құрамдас бөліктерімен, олардың мөлшері мен химиялық құрылысымен, сонымен қоса қоршаған және сыртқы орта әсерімен анықталады. Сондықтан химиялық процестерді тереңірек түсініп, химиялық реакцияның теңдеулерін дұрыс жазу үшін химиялық элементтердің атом құрылысын білу қажет.
Атом күрделі құрылысты: ол оң зарядты ауыр орталық ядродан және оны айнала қозғалатын теріс зарядты әлдеқайда жеңіл бөліктерден тұрады. Атом оң және теріс зарядты электрондар арасында әсер ететін электр күштерімен ұсталып тұрады.
Атом ядросының заряды көлемі бойынша периодтық системадағы элементтің реттік номеріне сәйкес; электрондар саны ядро зарядына тең. Атом жалпы алғанда нейтралды, ядро зарядтарының теріс заряд көлемі оң зарядпен жабылады. Атом ядросының өлшемі атом өлшеміне қарағанда аз, бірақ оның барлық салмағы ядрода (
Барлық элементтердің атомдардың ядросы, сутегінің жеңіл изотопының ядросынан басқа, протон және нейтрондардан тұрады. Бұл бөлшектердің барлығы нуклондар деп аталады.
Протон (P немесе
Нейтрон (n немесе
Протон және нейтрон жай ғана бөлшектің-нуклонның әртүрлі квантты жағдайлары. Ядродағы протон саны Z ядросының оң заряд көлемін анықтайды. Ядро құрамына кіретін A=Z+N; А-масса саны Z протондарының және N нейтрондарының қосындысына тең. Бұдан, кез-келген элемент атомының ядросындағы N нейтрондар саны A масса саны мен Z протондар санының айырмасына тең: N=A-Z. мысалы, магнийдің атом ядросының масса саны 24, реттік номері 12, онда оның нейтрон саны N=A-Z=24-12=12.
Химиялық элементтердің әртүрлілігі протондардың біртекті санымен, бірақ нейтронның әртүрлі санымен сипатталады, олар изотоптар деп аталады. Мысалы, 35(
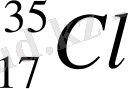 ) массалы хлор изотопының ядросында нейтрондар 18, ал 37(
) массалы хлор изотопының ядросында нейтрондар 18, ал 37(
Атомдарының масса саны бірдей, бірақ зарядтары әртүрлі элементтер изотопы изобара деп аталады. Мысалы:
Әрине, изобаралар әртүрлі қасиетке ие. Қазіргі кезде Д. И. Менделевтің периодтық заңы былай қалыптасқан: элемент қасиеттері, сонымен қоса форма және олардың қосылыс қасиеттері атом ядро зарядының көлемінен периодты тәуелділікте.
Атом индивидуалдығы оның ядросының бүтіндігі сақталғанша сақталады. Атом бірнеше электрондарды бере алады және белгілі бір мөлшердегі электрон санын қосып ала алады және оның индивидуалдығы сақталып қала береді. Ядро құрамы өзгергенде атом сипаты да өзгереді. Ядролы реакция көмегімен бір элемент атомдарынан басқа элемент атомдарын алуға болады.
Атом және молекуланың электрлік, оптикалық және химиялық қасиеттерін анықтайтын электронды бұлттарды, атом ядросын айнала қозғалатын электрондар түзеді.
Электрон (
Атомдағы электрондардың барлық ауыр қозғалыстары төрт кванттық сандарымен сипатталуы мүмкін.
Басты квантты сан n берілген энергетикалық деңгейдегі электрон энергиясын, оның ядродан қашықтығын, атом орбиталының өлшемін сипаттайды. Басты квантты сан келесі мәндерді қабылдай алады:
Сандық мағынасы . . . 1 2 3 4 5 6 7…. .
Әріптік мағынасы . . . KLMNOPQ
n=1 электронның ең аз мәніне сәйкес; n артқан сайын электронның жалпы энергиясы артады.
Басты кванттық сан (n) белгілі бір мәнімен сипатталған электрон қалпын атомдағы электронның энергетикалық деңгейі деп атайды. n=1болғанда электрон бірінші энергетикалық деңгейде болады, ал n=4 болғанда төртінші энергетикалық деңгейде (немесе N деңгейінде) болады. Басқаша айтқанда, бірдей n мәніне ие атомдағы электрондарды энергетикалық деңгей немесе электрон қабаты деп атаймыз.
Орбиталды квантты сан l .
Атом спектрлерін зерттеу нәтижесі, электронның бір деңгейден екіншісіне өтуіне жауап беретін спектрлі линиялар көбіне жіңішке структураны, яғни, жақын орналасқан бірнеше бөлек линияларды тауып отыратыны анықталған. Егер бір спектрлі линияның пайда болуы электронның бір энергетикалық деңгейден екіншісіне өтуімен түсіндірілсе, онда спектрлі линияның созылуы, пайда болуы керек бір линияның орнына екі немесе одан да көп жақын орналасқандарының пайда болуы берілген энергетикалық деңгейдің электрондарының кейбір байланыс энергияларының айырмашылығымен түсіндіріледі. Басқаша айтқанда, атом электрондары белгілі бір энергетикалық деңгей шегінде өздерінің энергетикалық деңгейімен ерекшеленеді.
Берілген энергетикалық деңгей үшін мүмкін болатын деңгейасты саны деңгей номерімен және n мәніне тең. n=1 болғанда деңгейасты біреу, оған сиятын электрондардың максималды саны 2(
 лектрон(барлығы 18 электрон-
лектрон(барлығы 18 электрон-
Байланыс энергиясындағы бұндай айырмашылықтар берілген энергетикалық деңгейдің электрондарының энергетикалық жағдайындағы айырмашылықтарды көрсетіп тұратын екінші квантты сан l енгізуді қажет етті. l саны электрон бұлтының формасын анықтайды, сонымен қоса орбиталды момен-электронның ядроны айнала қозғалысының М санында анықтайды:
Мұндағы h- Планк тұрақтысы,
l- дің әртүрлі мәнімен сипатталатын электрон қалпын атомдағы электрондардың энергетикалық деңгейасты деп аталады. Яғни, деңгейасты деп электронның бірдей мәнді l атауға болады.
Деңгейастын әріптермен белгілейді:
Орбиталды квантты сан l . . . 0, 1, 2, 3
Энергетикалық деңгейасты. . s p d f
Осылайша, l= 0, 1, 2, 3 болғанда электрондар сәйкесінше s-, p-, d-, f- деңгейастында болады. Әртүрлі деңгейасты электрондары s-, p-, d-, f- электрондары деп аталады.
n-нің әрбір мәні үшін квантты сан келесі мәндерді қабылдайды:
а басты квантты сан l орбиталды квантты сан Орбиталдың белгіленуі
1 0 1s
2 0, 1 2s, 2p
3 0, 1, 2 3s, 3p, 3d
4 0, 1, 2, 3 4s, 4p, 4d, 4f
Квантты механикадағы электрон бейнесі сферада ядроны айнала жағылған, ядродан біраз алшақ; ол тығыздығы электрон табу мүмкіндігіне пропорционал электрон бұлтын түзеді. Электрон бұлтының белгілі бір сызылған шекарасы жоқ. Сондықтан ядродан үлкен қашықтықта да, азда болса, электрон табу мүмкіндігі бар. Яғни, (n=1) бірінші энергетикалық деңгейде орналасқан электрон үшін орбиталдың бір ғана формасы мүмкін болады, n=2 үшін екі орбитал формасы, n=3 үшін үш және т. с. с. l =0 (s-электроны) жағдайында, орбиталды момент, атом ядросына қатысты электрон қозғалысының саны, нөлге тең. Бұл электрон ядроны айнала емес, ядродан перифериге қарай және керісінше қозғалған жағдайда мүмкін болады.
Бірінші санмен басты квантты санның мәні жазылады, содан кейін әріппен-орбиталды квантты сан көрсетіледі.
Магнитті квантты сан. Электронның тұйықталған орбитал бойымен қозғалуы магнит алаңының пайда болуымен байланысты. Қозғалыстың орбиталды момент саны қозғалыстағы электронның магнит алаңымен тығыз байланысты. Яғни, электрон қозғалысыныңмагнитті сипаттамасы орбиталды квантты сан l -мен байланысты.
Магнитті квантты саны орбиталдың кеңістіктегі орнналасуын сипаттайды. Орбиталдың кеңістіктегі орналасу саны магнитті квантты m санымен анықталады. Квантты сан l - дің әрбір берілген мәні үшін магнитты квантты сан кез-келген толық сандар, оң және теріс мәндер және нолдіде қабылдай алады. Магнитті квантты санның берілген l -дегі мүмкін болатын мәндерінің саны 2 l +1. Мысалы, l= 2 m 2 l+ 1=2*2+1=5 (-2, -1, 0, +1, +2) мәніне ие; l= 3 m 2 l +1=2*3+1=7 (-3, -2, -1, 0, +1, +2, +3) жеті мәнге ие; Яғни, l- дің әртүрлі мәнінде m мүмкін мәндерінің саны әртүрлі. 2 l +1 тең магнитті квантты санның мәнінің саны-бұл берілген деңгейасты электрондары бар энергетикалық жағдай.
Яғни, s-элетрондары ( l =0) (2 l +1=1) қалыпқа ие, p-электрондары ( l =1) (2 l +1=3) үш қалыпқа ие, d-электрондары ( l =2) және f-электрондары ( l =3) сәйкесінше 5 және 7 қалыпқа ие. Барлық үш p-орбиталының электрон бұлттары сәйкесінше x, y және z координат остерінде созылған, сондықтан да оларды
Жұлындық квантты сан s. Атом спектрлерін зерттеу нәтижесі, n, l квантты сандарынан басқада m электроны өз осін айнала қозғалатындығы анықталды. Бұл қозғалыс “жұлын” деген атқа ие болды. Былайша айтқанда, оны өз осін сағат тілімен немесе сағат тіліне қарама-қарсы қозғалысы деп елестетуге болады. жұлынды квантты сан s тек екі мәнге ғана ие бола алады: +1/2 және -1/2.
Атомдағы электрондарды орналастыру схемасын жазу кезінде энергетикалық жағдайды квантты ұяшықтармен, оларды төртбұрыш түрінде белгілейді. Схемадағы квантты ұяшық n, l , m квантты сандарынының белгілі бір мәнімен сипатталатын электрон орбиталын білдіреді. Бұл ұяшықтарда электрондар бағдармен белгіленеді, бадардың бағыты электрон жұлынының орентациясы болып табылады. Бұдан, схемадағы әрбір ұяшық үшін белгілі бір орбитал сәйкес келеді. Бос ұяшық-бос орбитал.
Әсер ететін атом ядролары химиялық реакция кезінде өзгеріссіз қалатындықтан, электрондардың орналасуы мен қасиеттеріне, олардың ішінде атомның химиялық қасиеттерін ескертетіндеріне тоқталамыз.
Атомдағы электрондардың орналасуы келесі басты жайлармен анықталады: 1) Паули принципі бойынша, 2) кіші энергия принципі бойынша, 3) Гунд ережесі бойынша.
Паули принципі. 1925 жылы швед физигі Паули, атом спектрлерін зерттеу кезінде, соның аты берілген Паули принципін: атомда барлық төрт квантты сандардың мәнімен сипатталатын екі немесе оданда көп электрондар болуы мүмкін емес , деген ереже орнатты. Мысалы, бірдей квантты n, l, m санды электрондар міндетті түрде жұлындарымен ерекшеленуі керек. Егер басты квантты сан n-ге тең болса, онда Паулс принципіне сәйкес, бұл деңгейдегі электрондардың максималды саны N
Деңгейасты квантты ұяшықтарға бөлінеді. әрбір деңгейастындағы ұяшықтар саны m-нің мүмкін мәндерінің санымен анықталады.
Параллель жұлынды электрондарды ↓↓ белгіленеді, антипараллельді жұлынды электрондар қарама-қарсы бағыттағы бағдарлармен ↓↑ белгіленеді және қосарланғандар деп аталады.
Паули принципіне сәйкес, энергетикалық ұяшықта бір немесе екі қарама-қарсы жұлынды электрондар болуы мүмкін.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz