Комплексті қосылыстар: Вернер теориясы, координациялық құрылым және байланыс теориялары


КОМПЛЕКСТІ ҚОСЫЛЫСТАР
Валенттік жайындағы ілім химияға әбден орныққаннан кейін қарапайым химиялық қосылыстардың барлығы қарапайым не атомдық қосылыстар және комплексті немесе молекулалық қосылыстар деп екіге бөлінді.
Біздің осы уақытқа дейін оқып келген қосылыстарымыздың басым көпшілігі элементтердің атомдарының қосылуынан түзілген атомдық қосылыстар. Бірақ осымен қатар біз кейбір күрделі қосылыстармен де таныспыз, олар: кристаллогидраттар (Na 2 SO 4 10Н 2 О), аммиакаттар (СиSО 4 4NН 3 ), ашудас (КАl(SО 4 ) 2 12Н 2 О), тиоарсенаттар (Nа 3 АsS 4 ), криолит (Nа 3 АlҒ б ), фторосиликаттар (Na 2 SіҒ 6 ) . кремний фторлы сутек қышқылы (Н 2 SіҒ 6 ) .
Осы келтірілген күрделі қосылыстар комплексті қосылыстар қатарына жатады, олар - жеке молекулалардың қосылуынан түзілген молекулалық қосылыстар.
Мысалы:
NН 3 + НСІ = NН 4 С1
СиSО 4 + 4NН 3 = Си5О 4 4NН 3 көк түсті
СоСl 2 + 2НС1 = СоСl 2 2НСl сия көк түсті
СоС1 2 + 4КС 5 = СоС1 2 4КСК 5 көк түсті
Комплексті қосылыстар туралы ілімнің негізін жасаган Швейцария ғалымы Альфред Вернер (1893 жыл) . Вернердің пікірі бойынша қосылыстарды бірінші ретті (қарапайым) жэне жоғары ретті деп екі топқа бөлуге болады. Жоғары ретті қосылыстар бірінші ретті (қарапайым) қосылыстардың өзара бірігуі нәтижесінде түзіледі. Олардың кейбіреулері қатты күйінде де және еріген күйінде де тұрақты болады, ал енді біреулері қатты күйінде тұрақты болғанымен, ерітіндіде құрам бөліктеріне ыдырап кетеді. Мысалы Nа2SіҒ 6 және СиSО 4 4NН 3 катты және еріген күйінде тұрақты, ал АІ2(SО4) зК 2 SО 4 24Н2О қатты күйінде тұрақты, ерітіндіде алюминий А1 3+ , калий К + жөне сульфат SО 4 2 ' иондарына ыдырайды. Мұндай қатты күйінде де және еріген күйінде де тұрақты болып келетін жоғары ретті қосылыстар комплексті қосылыстар деп аталады.
Комплексті қосылыспен танысу үшін мынадай мысал келтірейік. НҒ мен SіҒ 4 реакцияласқанда:
2НҒ+ SіҒ 4 = Н 2 SiҒ 6
кремний фторсутек қышқылы түзіледі. Мұндай химиялық қосылыстың түзілуін валенттікке сай химиялық байланыстың түрлерімен түсіндіре алмаймыз, шынында НҒ мен SіҒ 4 молекулаларының құрамындағы атомдардың валенттіктері қанық, бұл молекулаларда химиялық байланыстың негізі - электрон жүбын түзетін не бұлттары тоғысып қаптасатын жалқы электрон жоқ. Солай бола түрса да екі газ жап-жақсы реакцияласады, су ерітіндісінде екеуі түгел қосылады.
Мүндағы қосылысудың ретін түзілген Н2SіҒб қасиеттері көрсетеді; бүл екі негізді күшті қышқыл, былай диссоциацияланады:
Н 2 SіҒ 6 = 2Н + SіҒ 6 2
SіҒ 6 2 ионының түзілуі бейтарап молекула SіҒ 4 фтор ионымен Ғ- қосылысатындығын көрсетеді.
Демек, SіҒ 4 құрамындағы кремний НҒ құрамындағы Ғ- ионын өзіне тартып алады. Осы арадағы теріс зарядты фтор иондары, әрине, кейін тебіседі, бірақ оң зарядты кремнийдің оларды өзіне тартуы басым болғандықтан, оң 4 зарядты бір кремний теріс зарядты алты фтормен бірігіп, өткенде көрсеткендей комплекс түзеді, ол комплекс теріс 2 зарядты ион болып шығады. Комплекс иондары өдетте квадрат жақшаға алып жазылады.
Құрамында осындай комплекс ионы бар қосылыстар комплексті қосылыстарға жатады.
Комплексті қосылыстар жайындағы Вернердің жүмысы координациялық теория деп аталады. Жоғарыда келтірілген комплексті қосылыстардың анықтамасын Вернер үсынған.
XX ғасырдан бастап комплексті косылыстарды жете тексерген теориялар біздің елімізде шықты, бұл салада үлкен еңбек сіңірген орыс ғалымдары Д. И. Менделеев, Н. С. Курнаков, әсіресе Л. А Чугаев және осы кезде академик И. И Черняев, т. б.
Лев Александрович Чугаев Мәскеуде туған. Мәскеу университетін бітірген. Әуелгі кезде органикалық химиямен айналысқан, 1907-жылы Л. А. Чугаев Петербург университетінің бейорганикалық химия кафедрасын меңгеруге сайланады. Л. А. Чугаевтың шәкірттері комплексті қосылыстарды зерттеушілер
ЛЛ. Чуваевтың платиналық, металдардың химиясы жөнінде істеген жұмыстары ерекше, сол металдарды алу әдістерінің осы күнгі теориялык, негізі Чугаевтан шыққан. Ғылым академиясында 1918-жылы платина институтын ұйымдастыруга да Чугаев көп еңбек етті.
Координациялық теория бойынша комплексті қосылыста орталық орын алып тұрған ион, не атом (біздің мысалымызда кремний) комплекс түзуші деп аталады. Мысалы, мына қосылыстар СиSО 4 4NНз не РtCl4 2КС1 комплексті қосылыстар болады. Бұлардағы [Си(NНз) 4] SO4, К 2 [Рt(Сl) б] мыс және платина иондары комплекс түзуші.
Комплекс түзушінің айналасына, соның әсері жететіндей жақындатқанда жиналған, яғни координацияланған иондарды, не молекулаларды лигандтар (ligare - байланыстыру), аддендтер деп атайды. Міне, осылар (комплекс түзуші мен лигандтар) бірігіп, комплексті қосылыстардың ішкі сферасын құрайды. Ішкі сфераға араласпай қалған иондар комплекс түзушіден алысырақ орналасады, олар комплексті қосылыстың сыртқы сферасын құрайды. Комплексті қосылыстарды жазғанда олардың ішкі және сыртқы сфераларын айырып көрсету үшін ішкі сфераны жоғарыда айткандай квадрат жақшаға алады. Мысалы,
[Pt(NH3) 4Cl2], [NH4] Cl
Комплексті қосылысты суда еріткенде сыртқы сферадағы иондар диссоциацияланып кетеді. Сондықтан оның комплекс ионмен байланысы иондық болады. Енді ішкі сферадағы координацияланған иондар болсын, не молекулалар болсын, олар комплекс түзушімен байланысқан қалпында диссоциацияланбайтын комплекс болып кала береді. Мысалы, РtСl 4 4NНз сияқты аммиакат комплексті қосылысы
[Pt(NH3) 4Cl2] Cl2 былай диссоциацияланады:
[Pt(NH3) 4Cl2] Cl2=[Pt(NH3) 4Cl2] 2+ + 2Cl-
Комплекстің ішкі сферасында координацияланатын лигандар бейтарап, бірақ полюсті молекулалар болуы мүмкін, сонымен қатар бүлар аралас болуы да мүмкін, мысалы СrClз5NHз дұрысында мынадай комплексті қосылыс [Cr(NH3) 5Cl] Cl2 Комплекстік ионның заряд саны сыртқы иондар зарядының қосындысына тең, бірақ кері мәнді болады, мысалы Н 2 ЗіҒб комплекстік ионы теріс екі валентгі, себебі сыртқы сферада оң бір валентті сутектің екі ионы бар. [Pt(NH3) 4Cl2] Cl2 қосылысында комплекстік ион екі валентті, [Pt(NH3) 2Cl4] қосылысында сыртқы сфера жоқ, сондықтан бұл қосылыс суда диссоциацияланбайды, яғни электролит емес.
Комплексті қосылыстың құрамы белгілі болса, комплекс түзушінің зарядын табу қиын емес. Ол үшін комплексті қосылыстың формуласына кіретін басқа иондардың барлығының зарядтарының алгебралық қосындысын шығарып, оған теріс мән қояды, мысалы комплекс ион оң екі валентті [Pt(NH3) 4Cl2] Сl 2 оның қосындысы (4*0) +(2-) + (2-) = (4-), демек, бұл арада комплекс түзуші платина оң төрт валентті.
Осы уақытқа дейін оқыған және алдымызда окитын атомдық (қарапайым) қосылыстардың жалпы санына карағанда комплексті қосылыстардың саны әддеқайда көп. Өйткені, біріншіден элементтердің көпшілігі, оның ішінде металдар, әсіресе қосымша топтардағы металдардың барлыгы, комплекс түзуші бола алады. Екіншіден, комплекстін, ішкі сферасына лиганд ретінде кіретін бөлшектер өте көп, олар:
1. Құрамында оттек бар қосылыстар - су (комплексті қосылыс - кристаллогидраттар түзеді), спирттер (алкоголяттар түзеді), қышқыддар (ацидаттар түзеді), альдегидтер мен кетондар да комплекстің ішкі сферасына
кіре алады.
Құрамында азот бар қосылыстар - аммиак - (аммиакаттар түзеді), органикалық аминдер (аминаттар түзеді), нитридтер, амидтер т. б. қосылыстар да ішкі сфераға кіре алады.
Құрамында күкірт бар қосылыстар - сульфидтер, тиоспирттер, тиоэфирлер т. б. қосылыстар да ішкі сфераға кіріп комплекс түзеді.
Түздар және тұздардың қос қосылыстары.
Полигалогенид, полисульфид қосылыстар.
Күрделі қышқылдар гетерополиқышкылдар) . Химияда неше комплекс түзуші әрқайсысы осы аталған лигандтармен комплекс түзе алады. Осының өзінен комплексті қосьшыстардың қаншалықты кеп екендігін байкауға болады.
Координациялық сан және комплексті қосылыстардың құрылымы.
Бос орбитальдары бар атомдар немесе металл иондары әдетте комплекс түзушілер бола алады, яғни, лигандтармен байланыс құру кезінде комплекс түзушілер акцептордың функциясын атқарады.
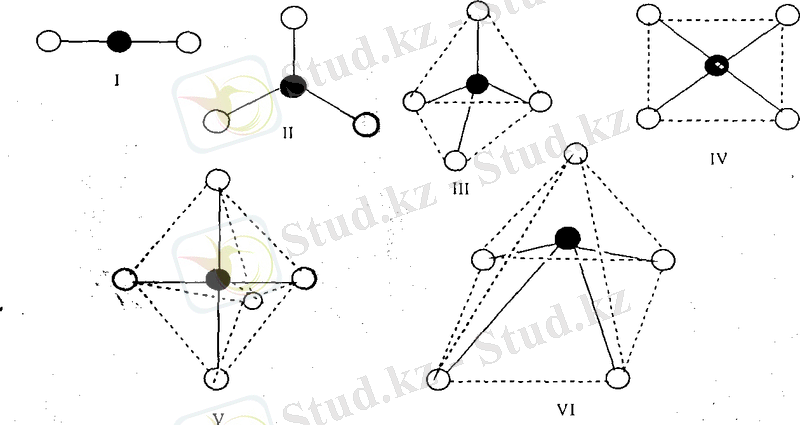
Орталық атомның төңірегіне лигандтардың орналасуы әр түрлі, ол комплекс түзушінің лигандтардың қандай санын ұстап қалуына, яғни оның координациялық санына (К. С. ) байланысты. Әртүрлі комплекс түзушілерде координацияяық сан 2-ден 10-га дейін өзгереді, 4 және 6 сандары жиі, 8 және 2 сандары сирек кездеседі. Координациялық саны 2 бір валентті күміс Аg (I), алтын Аu (I) және мыстың Сu(І) комплексті
қосылыстары жиі кездеседі. Мысалы, [СиCl2] - [Аg(NH3) 2] +. Мүндай комплекстерде орталық атом мен екі лиганд бір түзудің бойына орналасады, демек, құрылысы түзу сызықты болады. 18. 1. сурет.
- орталық атом
- лиганда
Координациялық сан 3 сирек кездеседі. Мысал ретінде сынаптың мынадай комплексті қосылысын: [(СН 3 ) 3S] [НgI3] келтіруге болады. Комплекс тузушінің координациялық саны 4 болғанда комплексті ионның құрылысы тетраэдр немесе квадратты болып келеді
Жазық квадратты комплекстерді әдетте, D-металдар түзеді. Мысалы, [Pt(NНз) 4 ] 2+ , [РtСl 4 ] 2+ , және т. б.
Координациялық саны 5 болып келетін комплекстер онша көп емес. Мұндай комплекстердің құрылысы үшбұрышты бипирамида немесе квадратты пирамида сияқты болады Ең жиі кездесетін координациялық сан 6. Мүндай комплекстердің құрылымы октаэдр сияқты. Алтыдан үлкен координациялық сандар сирек кездеседі. Ондай комплекстерді 5- және 6-периодтағы D-металдар, лантаноидтар және актиноидтер түзеді. Келесі суреттерде жиі кездесетін құрылымы тетраэдр (а), жазық квадрат (б), сонымен қатар октаэдр комплекстердің мысалы келтірілген.
Құрылымы октаэдр комплекстерді бейнелеудің екі түрі көрсетілген, металл иондарының координациялық саны 6-ға тең.
Құрылымы октаэдр комплекстерді бейнелеудің екі түрі көрсетілген, металл иондарының координациялық саны 6-ға тең.

Құрылымы октаэдр комплекстерді бейнелеудің екі түрі көрсетілген, металл иондарының координациялық саны 6-ға тең.
Комплекс иондарының беріктігі әр түрлі болады, мысалы К 2 [РtСlб] дағы [РtСl 6 ] 2 - ионы берік ион, ол түз суға ерігенде бүл ион диссоциацияланбайды, ерітіндіде Рt 4+ не Cl- иондары білінбейді, ал енді [Cd(NНз) з] СІ2 түзының ерітіндісінде Cl- иондарымен қатар Сd 2+ иондары және NНз молекулаларының бар екендігі білінеді,
Шынында да қос тұздар мен комплексті тұздардың арасында үлкен айырмашылық жоқ. Қос тұзды координациялық ішкі сферасы берік емес, тұрақсыз комплексті қосылыс деп қарауымыз керек. Бұл екеуінің негізгі айырмашылығы еріген кезде қос тұздар құрамындағы барлық иондарға д ассоциацияланады:
КАl(SО 4 ) 2 = K+ Al3+ + 2SO42-
ал комплексті тұздар комплекс ион түзеді.
К 2 [РtCб] = 2К+ [РtСl6] 2-
Сондықтан қос тұздарды комплексті түздардан айырмашылығын көрсету үшін К2ІСuСІ4] деп жазбайды, СиСl2*2КСl деп жазады.
Неғүрлым К т мәні кіші болса, соғұрлым комплексті ионның беріктігі арта түседі.
Бірнеше бөлшектердің бірігіп, үлкен комплексті ионның түзілуі - көбіне экзотермиялы болады, өйткені жаңа байланыстар түзіп, жүйе экзотермиялық тұрақты күйге ауысады. Ал ретсіздік дәрежесіне келсек, керісінше, көп жағдайда оның кемігенін керер едік яғни, ол ионның түзілуіне кері әсерін тигізеді.
Комплексті қосылыстардағы химиялық байланыстың табиғаты
Қазіргі кезде комплексті қосылыстардағы байланыстың табиғатын қарастыратын үш теориялық әдіс бар:
1) валенттік байланыс әдісі, 2) кристалдық өріс теориясы, 3) молекулалық орбитальдар әдісі.
Валенттік байланыс әдісі. Валенттік байланыс әдісі бойынша орталық атом мен лиганд донорлы-акцепторлы жолмен байланысады. Әдетте, орталық атом байланыс түзуге бос орбитальдарын, лиганд пайдаланылмаған электрон жұбын (басқаша екі электронды орбиталін) жұмсайды. Демек, орталық атом (ион) - акцептор, лиганд - донор. Молекула немесе ион лиганд рөлін атқару үшін оның құрамындағы атомның пайдаланылмаған электрон жүбы болу керек. Атап өткендей, комплекс түзушілер әдетте металдардың иондары бола алады, себебі олардың бос валенттік орбильдары болғандықтан, олар Льюис қышқылдарының (электрондық жүптардың акцепторлары) ролін атқара алады. Бөлінбеген электрон жүптары бар болғандықтан, лигандтар Льюис негіздерінің қасиеттерін көрсетеді (электрондық жұптардың донорлары) .
Орталық атомның бос орбитальдарының саны оның комплексті қосылыстағы координациялық санына тең болады. Енді осы тұрғыдан кобальт катионы Со 3+ аммиак молекуласымен әрекеттескенде пайда болатын
Сo3+ + 6NH3 = [Со(NН 3 ) б] 3+
Комплексті ионның [Со(NН 3 ) б] 3+
түзілуін қарастырайық. Кобальт катионының кобальт атомынан
Со
Зd7
4s
2
4р° 583
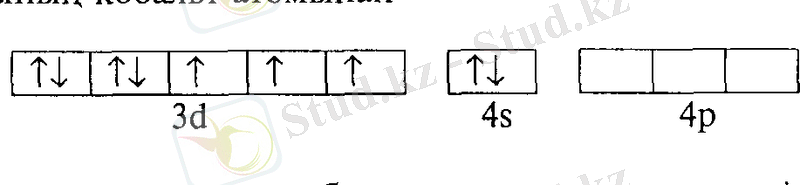
үш электроны кем, сондықтан кобальт катионының валенттік қабатының электрон құрылысы мынадай:
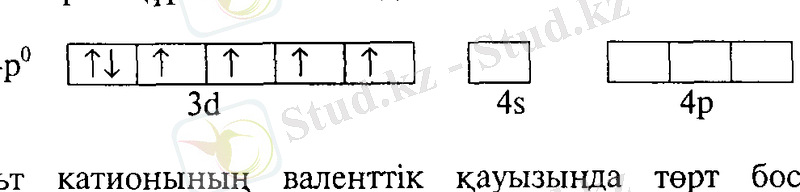 Со
3+
Зd
6
4s
0
4р°
Со
3+
Зd
6
4s
0
4р°
Кобальт катионының валенттік қауызында төрт бос орбиталь бар (бір "4s" және "4р" орбиталь) . Кобальт катионының қоздыру арқылы 3 сі-деңгейшесіндегі жалқы электрондарды өзара жұптастырып, бос орбитальдар санын алтыға дейін жоғарылатуға болады:
Жұлдызша (*) белгісі кобальт катионының қозған күйде екенін көрсетеді. Қозған күйдегі кобальт катионының алты бос орбиталі: екі "ЗсГ, бір "4б" және үш "4р" орбитальдары бар. Аталған бос орбитальдар байланыс түзуге қатыспастан бұрын сі 2 5р 3 -гибридті орбитальдарға айналады.
Кобальт катионының аталған алты орбиталі аммиак молекуласының құрамындағы азот атомының екі электронды орбиталімен (басқаша пайдаланылмаған электрон жүбымен) жүптасқанда комплексті катион [Со(] ЧН 3 ) б] 3+ түзіледі. Кобальт катионының гі 2 зр 3 -гибридті орбитальдары октаэдр төбесіне бағытталғандықтан, түзілген комплекстің құрылысы октаэдр болады.
Сонымен валенттік байланыс әдісі бойынша комплексті қосылыстағы орталық атом (ион) мен лиганд арасындағы байланыс - донорлы-акцепторлы жолмен түзілетін коваленттік байланыс. Комплексті ионның кеңістіктегі құрылысы орталык атомның байланыс түзуге жұмсайтын бос орбитальдарының типіне байланысты. Орталық атом байланыс түзуге ар-гибридті екі орбиталін пайдаланса - сызықтық, зр -гибридті уш орбиталін пайдаланса жазық үшбұрышты, $р 3 -гибридті төрт орбиталін пайдаланса тетраэдрлік, скр 2 -гибридті төрт орбиталін пайдаланса квадратты комплекстер - сІзр 3 -гибридті бес орбиталін пайдаланса үшбүрышты бипирамида тәрізді комплекс, й 2 зр 3 -гибридті алты орбиталін пайдаланса октаэдрлік комплекс түзіледі, т. с. с. (18. 1. -сурет) .
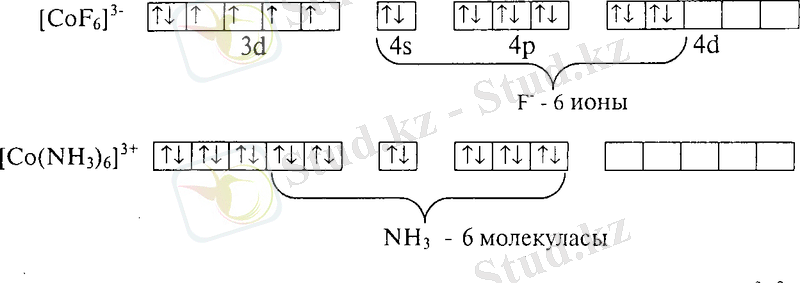
Валенттік байланыс әдісі комплексті қосылыстардағы орталық атомы мен лиганд арасындағы байланыстың түзілу механизмін және комплекстердің кеңістіктегі құрылысын түсіндіре алады. Енді валенттік байланыс әдісі комплексті қосылыстардың магниттік қасиеттерін қалай түсіндіреді екен, соны қарастырайық. Тәжірибелік деректер бойынша үш валентті кобалытың аммиакты комплексі [Со(ЫН 3 ) б] 3+ диамагнитті, жалқы электрондары жоқ, ал фторокомплексі [СоҒб] 3 -парамагнитті, төрт жалқы электроны бар. Бұл құбылысты түсіну үшін аталған комплекстердің түзілуінің жолдарын қарастырамыз. Бос күйіндегі кобальт катионының төрт жалқы электроны бар, ал аммиакты комплекс құрамындағы сі 2 $р 3 -гибрвдті кобальт катионының жалқы электрондары жоқ, сондықтан [Со(1ЧН 3 ) б] 3+ диамагнитті. Фторкомплекстегі жалқы
электрондардың саны бос күйіндегі кобальт катионыныкі сияқты төртке тең, яғни, тәжірибелік деректер бойынша фторокомплекс [СоҒб] 3 " түзілгенде Со 3+ ионының Зсі-орбитальдары өзгеріссіз қалады. Ал қалыпты күйіндегі кобальт катионының Со 3+ бар болғаны терт бос орбиталі бар, алты лиганд (фтор иондары) қосып алу үшін тағы да екі бос орбиталь қажет. Жетіспейтін екі орбитальді кобальт катионы 4й-деңгейшесінен алады, яғни, фторкомплексте байланыс түзуге кобальт ионының бір "48", үш "4р" және екі "4сГ орбитальдары катысады:
Аталған орбитальдар гибридтенгенде алты зр 3 с1 2 -орбитальдар түзіледі.
Аммиакты комплексте кобальт катионы байланыс түзуге ішкі Зсі-орбитальдарын, фторокомплексте сыртқы 4сі-орбитальдарын пайдаланады. Орталық атомның ішкі й-орбитальдарының қатысуымен түзілген комплекстер "ішкі орбитальды" комплекстер, ал сыртқы сі-орбитальдардың қатысуымен түзілетін комплекстер "сыртқы орбитальды" комплекстер деп аталады. Біздің мысалымызда аммиакты комплекс Со(^Н
3
) б
3+
-ішкі орбитальды комплекс, ал фторокомплекс СоҒ
6
3
'-сыртқы орбитальды комплекс. Ішкі орбитальды комплекстер түзілгенде жалқы электрондар саны азаяды, сондықтан ішкі орбитальды комплекстер басқаша аз спинді комплекстер деп те аталады. Сыртқы орбитальді комплекстерде орталық атомның сі-дендейшесі өзгермейді, жалқы электрондар бос ионда қанша болса комплекстің құрамында сонша болады. Сыртқы орбитальды комплекстердегі жалқы электрондар саны ішкі орбитальды комплекстердегіден көп болғандықтан, оларды коп спинді комплекстер деп атайды. Комплекс түзушінің ішкі орбитальді немесе сыртқы орбитальды болуы, комплекс түзуші лигандтың табиғатына байланысты болады. Бірақ валенттік байланыс теориясы комплекс қандай лигандпен ішкі орбитальды, ал қандай лигандпен сыртқы орбитальды комплекс түзетінін алдын-ала болжауға мү

 Криситалдық өріс теориясы.
Қазіргі заманғы кристалдық өріс теориясы Коссель (1916-жылы) ұсынған элекростатикалық (иондық) модельдің жалғасы болып табылады. Валентгік байланыс теориясында комплексті қосылыстардағы байланысты коваленттік деп қарастырса, кристалдық өріс теориясында, керісінше, иондық деп қарастырылады.
Криситалдық өріс теориясы.
Қазіргі заманғы кристалдық өріс теориясы Коссель (1916-жылы) ұсынған элекростатикалық (иондық) модельдің жалғасы болып табылады. Валентгік байланыс теориясында комплексті қосылыстардағы байланысты коваленттік деп қарастырса, кристалдық өріс теориясында, керісінше, иондық деп қарастырылады.
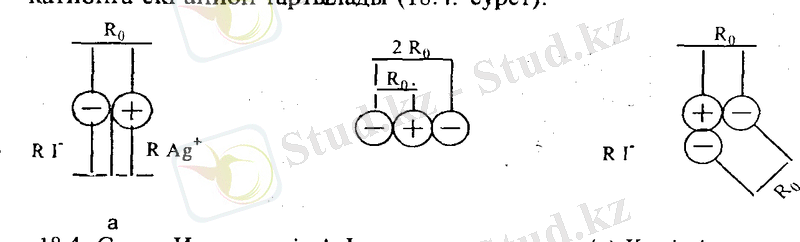
Иондық түрғыдан бір валентті күмістің дийодокомплексінің [А§Іг] 2 " түзілуін талқылаймыз. Күміс катионы А§ + мен иод Ганиондары әрекеттескенде молекула А§1 және комплексті ион [А^ЬГтүзілуі мүмкін. Кулон заңына сүйеніп А§1 молекуласы мен [А§І 2 Гкомплексті ионның түзілуі энергияларын есептеп, өзара салыстырайық. Алдымен молекуланың түзілу энергиясын есептейміз. Ол үшін күміс катионы мен иод анионын сығылмайтын қатгы шар, ал А§1 молекуласын біріне бірі тақасып түрған күші е 2 /К 2 0 ал тартылысу энергиясы е 2 /Ко (мүндағы е-электронның заряды; К о -катион мен анионның арақашықтығы, ол катион жоне анион радиустарының қосындысына тең Ко=Га8+Гі-) . Комплексте катионға екі анион тартылады (18. 4. -сурет) .
к г
(в) Кұмістің
дийодокомплексінің
бүрыштык моделі
18. 4. -Сурет. Иодты күміс А§1 молекуласы (а) мен дийодокомплекстің (б) иондық
моделі
оның әрқайсысының катионға тартылу энергиясы е 2 /Ко, демек, комплексті иондардың тартылысу энергиясы
А, =■
комплекс құрамындағы иондардың жалпы әсерлесу энергиясы тартылысу энергиясынан тебісу энергиясын алғанға тең:
Е 2 = А, - А, = -
Ае + + 21 = А§1 2 - + 1, 5 ■ -
Сонымен молекулаға қарағанда комплексті ион [А§Һ] ~ түзілгенде 1, 5 есе көп энергия белінеді. Бүл дийодокомплекстің -[А§Ь] " молекулаға қарағанда түрақты екенін көрсетеді. Егер осындай әдіспен трийод-ІА§Із] 2 ", тетрайод- [А§1 4 ] ' және т. с. с. комплекстердің түзілу энергияларын есептесек, олардың дииодокомплекске қарағанда түрақсыз екеніне көз жеткізуге болады.
Біз жоғарыда тәжірибелік деректерге сүйеніп дийодокомплексті [А§1 2 ] " сызықтық деп қарастырдық. Электростатикалық (иондық) модель дийодокомплекстің сызықтық екенін дәлелдей ала ма? Электростатикалық модель бойынша комплекстің құрылысын анықтау үшін мүмкін бола алатын әртүрлі конфигурациялардың түзілу энергияларын есептейді. Түзілу энергиясы ең үлкен, демек ең түракды конфигурация комплекстің шын конфигурациясы деп есептелінеді. Түсінікті болу үшін күмістің дийодокомплексінің ең түрақты конфигурациясын анықтап көрейік. Ол үшін екі шектік жағдайды салыстырамыз: 1) дийодокомплекстің конфигурациясы (құрылысы) -сызықтык- 2) дийодокомплекстің құрьшысы-бүрыштық (18. 4. -сурет) .
Сызықтық конфигурациясының түзілу энергиясы 1, 5е 2 /Ко- Бүрыштық конфигурациядағы екі анионның катионга тартылысу энергиясы Аі=2е 2 /Ко, ал аниондардың тебілісу энергиясы А2=е 2 /^2-Ко, демек, бүрышты конфигурациясының түзілу энергияеы:
Е 2 = А, - А 2 =Ц
, = 1, 29 - *0
яғни, комплекстік ионның түзілу энергиясы
Бүл шама сызықтық конфигурацияның түзілу энергиясынан кіші, олай болса қарастырылған екі конфигурацияның түрақтысы-сызықтық конфигурация, демек ол комплекстің шын құрылысын сипаттайды.
Сонымен қарапайым иондық модель комплексті қосылыстардың түзілуін және кеңістіктегі құрылысын түсіндіре алады. Кристалдық өріс теориясында лиганд әсерінен комплекс түзушінің й-деңгейшесінің қалай өзгеретіні жене бүл өзгерістердің комплексті қосылыстың қасиеттеріне қалай әсер ететіні де қарастырылады.
Лигандтар өрісінде гі-деңгейшесінің жіктелуі. Көпшілік жағдайда комплекс түзуші й-элементтің катионы болып келеді. й-деңгейшеде бес орбиталь бар. Олардың пішіндері бірдей, тек кеңістікте әртүрлі орналасқан. йг 2 -орбиталь 2-осінің бойында, с1х 2 у 2 - орбиталь х- және у- осьтерінің бойына жинақталған, ал
586
587
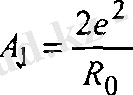
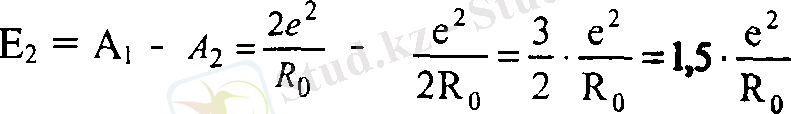
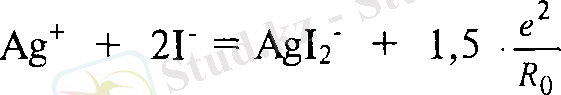
 гіху-, гін- және й^-орбитальдарының жапырақшалары осьтер арасындағы биссектрисалар бойына орналасқан. сі-орбитальдарының электрондық бүлттарының формасы 18. 5. -суретте көрсетілген.
гіху-, гін- және й^-орбитальдарының жапырақшалары осьтер арасындағы биссектрисалар бойына орналасқан. сі-орбитальдарының электрондық бүлттарының формасы 18. 5. -суретте көрсетілген.
18. 5. -Сурет. Бес ё-орбитальдардың пішіні
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz