Химияның негізгі заңдары мен стехиометрия: массаның сақталуы, құрам тұрақтылығы, Авогадро заңы және эквиваленттер


ЗАТТАР МАССАСЫНЫҢ САҚТАЛУ ЗАҢЫ
Заттар массасының сақталу заңын ең бірінші болып М. В. Ломоносов тұжырымдады /1748ж/. Кейін /1758 ж/ ол заңды тәжірибе жүзінде дәлелдеді.
Заңның қазіргі кездегі тұжырымдамасы:
химиялық реакцияға қатысатын заттардың массасы реакция нәтижесінде түзілетін заттардың массасына тең болады.
Ломоносовқа тәуелсіз бұл заңды 1789 ж. француз химигі Антуан Лоран Лавуазье тұжырымдады. Ол металдардың тотығу реакцияларының көпшілігін зерттеп заңға эксперименттік дәлелдер алды.
Атом-молекулалық ілім тұрғысынан заттар массасының сақталу заңы былай түсіндіріледі: химиялық реакцияда атомдар жоғалып және жоқтан пайда болмайды: атомдардың жалпы саны реакцияға дейін және реакциядан кейін тұрақты болады. М. Ломоносов заттар массасының сақталу заңын энергия сақталу заңымен байланыстырып, оларды табиғаттың жалпы заңы деп қарастырады. "Табиғатта болатын барлық өзгерістердің мәні - бір денеден қанша кемісе екінші денеге сонша қосылады. Мысалы, егер бір жерде бірнеше материя кемісе, онда басқа жерде қосылады. Табиғаттың бұл жалпы заңы қозғалыс ережесіне де тән: қандай күшпен дене басқа денені қозғалтса, сонша күшті өзінен қозғалыс алатын денеге береді".
Энергияның сақталу заңы былай тұжырымдалады: энергия жоқтан пайда болмайды, жоғалмайды, ол басқа түрлері бірімен-бірі эквиваленттік қатынасқа айналады.
Сонымен, заттардың массасының сақталу заңы мен энергия сақталу заңы - табиғаттың жалпы заңының екі жағы - материя мен оның қозғалысының мәңгілік заңы.
Материя барлық жағдайда сақталып қалады, ал масса материяның бірден бір, түрі энергияға өзгеруі мүмкін.
Масса мен энергия арасындағы байланыс Эйнштейн теңдеуімен өрнектеледі.
Е = mc 2
мұндағы Е - энергия, m - масса, с - вакуумдағы жарық жылдамдығы. Химиялық реакцияда энергия әрқашанда бөлінеді және сіңіріледі. Берілген энергияның бөлінуі мен сіңірілуінің зат массасының есебінің өсуінен кемуінде қолданылады.
Заттар массасының сақталу заңы химиялық реакциялардың теңдеу-лерін құрастыруға материалдық негіз болады, оған сүйене отырып химиялық теңдеулер арқылы есептеулер жүргізуге болады.
ҚҰРАМ ТҰРАҚТЫЛЫҚ ЗАҢЫ
Құрам тұрақтылық заңын алғашқы рет француз ғалымы Ж. Пруст /1808/ ашып, былай деп тұжырымдады:
Алыну жолына қарамастан молекулалық құрылысты әрбір химиялық таза заттың сапалық және сандық құрамы тұрақты болады.
Мысалы СаО мырыш оксидін әр түрлі әдістермен алуға болады.
2 Са + О 2 = 2СаО
СаСО 3 = СаО + СО 2
Са/ОН/ 2 = СаО + Н 2 О
Алыну әдістеріне қарамастан, химиялық таза түрінде мырыш оксиді СаО 80, 34% мырыштан, 19, 66% оттегіден тұрады.
Атом - молекулалық ілім тұрақтылық заңын түсіндіреді. Атом массасы тұрақты болғандықтан заттың массалық құрамы да тұрақты болады. Молекулалық құралымы болмайтын қосылыстардың құрамы тұрақты емес, ол алыну жағдайына тәуелді болады.
ЕСЕЛІК ҚАТЫНАС ЗАҢЫ
1803 жылы ағылшын ғалымы Дальтон еселік қатынас заңын ашып атомистикалық гипотеза, ілімі сандағы үшін атомдардың кіргізді.
Еселік қатынас заңынан туатын мағына:
Егер екі элемент бір-бірімен бірнеше молекулалық қосылыс түзетін болса онда бір элементтің белгілі бір тұрақты массасына келетін екінші элементтің массаларының өзара қатынасы кіші бүтін сандардың қатынасындай болады.
Мысалы, азот оттегімен 5 түрлі оксид түзеді.
Сандық анализінің берілгені.
Оксидтің
формуласы
оттегінің салыс-
тырмалы мөлшер.
Еселік қатынас заңынан молекулалық қосылысқа кіретін элементтің ең кіші бөлшегі атом екенін көз жеткізуге болады.
Сондықтан, бір элементтің сандық қатынастары, басқа элементтің бірдей сандық қосылыстарына қатынасатын бөлшек сандар болып келеді. Француз химигі Гей-Люссак реакцияға қатынасқан және оның нәтижесінде түзілген газдардың көлемдерін зерттеп газдардың көлемдік қатынас заңын ашты. Ол 1 л көлем сутегі мен 1 көлем хлор әрекеттесіп 2 көлем хлорсутек түзеді деп анықтады. Көптеген тәжірибелерден газдардың көлемінің өзгеруінен химиялық реакцияда көлем қатынас заңы келіп шықты газ күйіндегі заттардың көлемі реакция нәтижесінде түзілген заттардың көлемдерге қатынасы кіші бүтін сандардың қатынасындай болады. Осы заңнан газдың анализдік әдісінің негізі шықты. Дальтонның атомистикалық ғылымының жетекшілігімен көлем қатынас заңын түсіндіруге мүмкін болмады.
АВОГАДРО ЗАҢЫ
Италян ғалымы Амидео Авогадро атомистикалық теорияға керекті толықтама істеді. Ол молекулаларға кішкене бөлшектерден тұратын заттар деген түсінік келтірді.
1811 жылы Авогадро кейін заңға айналған гипотезасын ұсынды:
Бірдей жағдайда /бірдей температура мен қысымда/ әр түрлі газдардың бірдей көлемдеріндегі модекулалар саны бірдей болады.
Авогадро, жай газдардың молекулалары екі бірдей атомнан тұ-рады деп болжады. Сутегі хлормен қосылғанда олардың молекулалары атомдарға ыдырайды, ал соңғылары хлорсутек молекуласын түзеді. Сутегінің бір молекуласы мен хлордың бір молекуласынан хлорсутектің екі молекуласы түзілетіндіктен, соңғы қосылыстың көлемі алғашқы газдардың көлемінің қосындысына тең болу керек, яғни:
Н 2 + Сl 2 = 2НСl.
Сонымен егер, жай газдардың молекулалары екі атомнан тұрады десек, онда көлем қатынастары оңай түсіндіріледі.
Авогадро заңынан маңызды сандар шығады: әртүрлі газдардың 1 молі бірдей жағдайда бірдей көлем алады. Бұл көлемді 1 л газдың массасы белгілі болса оңай есептеуге болады. Қалыпты жағдайда, яғни температура / 0°С/ және қысым 101325 Па. 1 л оттегінің массасы - 1, 43 г, молярлық массасы 32 г/моль. Онда көлем 32 : 1, 43 = 22, 4 л тең.
Мұндай сандар, егер сутегі мен азоттың көлемін есептегенде де шығады.
Қалыпты жағдайда кез-келген газдың 1 молі 22, 4 литрге тең кө-лем алады. Бұл көлем газдың қалыпты жағдайдағы молярлық көлем деп аталады.
Авогадро заңы заттың салыстырмалы молекулалық массасын анықтау үшін қолданылады.
Авогадро заңынан: газдардың бірдей көлемдерінің массаларының қатынасы олардың молярлық массаларының қатынасына тең:
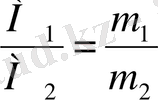 мұндағы m
1
- бірінші газдың белгілі көлемінің массасы, m
2
- екінші газдың сондай көлемінің массасы, М
1
мен М
2
- бірінші және екінші газдардың молярлық массалары.
мұндағы m
1
- бірінші газдың белгілі көлемінің массасы, m
2
- екінші газдың сондай көлемінің массасы, М
1
мен М
2
- бірінші және екінші газдардың молярлық массалары.
Бір газдың белгілі көлемінің массасынын, басқа газдың сондай көлемінің массасына /сондай жағдайда алынған/ қатынасы бірінші газдың екінші газ бойынша тығыздығы деп аталады.
Салыстырмалы газ тығыздығын Д әрпімен белгілейміз.
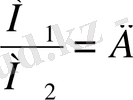 , бұдан М
1
= М
2
Д.
, бұдан М
1
= М
2
Д.
Газдың мольдік массасы оның тығыздығы мен екінші газдың қатынасына тең болады.
Газдың тығыздығын ең жеңіл газ сутегі бойынша анықтайды. Сутегінің молярлық массасы 2, 0158 г/моль немесе шамамен 2 г/мольге тең. Сондықтан, М = 2 Д Н2 болады. Мысалы, көміртегі екі тотығының тығыздығын сутегі бойынша 22-ге тең білеміз.
СО 2 мольдік массасы есептегенде, теңдеу бойынша М 1 = 2*22 = 44 тең.
Көбінесе газдардың тығыздығы ауа бойынша анықталады. Ауа газ-дардың қоспасы болғанымен оның орташа молярлық массасы пайдалана-ды. Ол 29 г/мольге тең. Бұл жағдайда молярлық масса М = 29 Д өрнекпен анықталады.
Заттың мольдік массасын анықтау үшін қалыптағы жағдайдағы заттың газ түріндегі мольдік көлемін қолданамыз. Газдың көлемін анықтау үшін массаны білу керек.
Мысалы: 0, 7924 г хлордың қалыпты жағдайдағы көлем 250 мл-ге тең.
Көлемі 22, 4 тұратын хлордың салыстырмалы молекулярлық масса-сын есептегенде
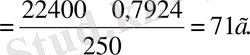
Олай болса, хлордың молярлық массасы 71 г/мольге тең, ал салыстырмалы молекулярлық массасы 71 м. а. б. тең.
Газ күйіндегі заттардың көлемін өлшеу үшін. Бойль-Мариотт пен Гей Люссактың біріккен газ заңдарының теңдеуін қолданамыз
мұндағы, - Р қысым мен Т температурадағы газдың көлемі
- қалыпты қысым Р о /101, 325 кПа немесе 760 мм. рт. ст/
және температурадағы To /273°K/ газ көлемі.
Газдардың мольдік массаларын есептеу үшін Менделеев - Клапейронның идеал газдар теңдеуін табуға болады:
мұндағы
Р - газдың қысымы, Па,
- газдың көлемі, м 3
- заттың массасы, г
М - мольдік масса, г/моль
Т - абсолюттік температура, °К
- универсал газ тұрақтысы 8, 314 Дж/ Моль °К тең.
ЭКВИВАЛЕНТ. ЭКВИВАЛЕНТТЕР ЗАҢЫ
Химиялық элементтер бір-бірімен әрекеттесіп қосылыс түзгенде, ондағы элементтердің мөлшерлері әр уақытта тұрақты болатынын құрам тұрақтылық заңы көрсетті химияда "эквивалентті" деген сөз екі элементтің немесе екі заттың бір-бірімен қолдықсыз әрекеттесетін тең мөлшерлерін көрсетеді.
Қазіргі кезде эквиваленттің анықтамасы былай айтылады:
Элементтің эквиваленті дегеніміз сутегі атомдарының 1 молімен әрекеттесетін немесе сондай мольді қосылыстан ығыстырып шығаратын мөлшерін айтады.
НСl, H 2 S, NH 3 , SiН 4 қосылыстарында хлордың эквиваленті 1 мольге, күкіртсутекте 1:2 мольге, азотта 1:3 мольге, кремнийде 1:4 мольге тең.
Элементтің 1 эквивалентінің массасын оның эквиваленттік массасы дейді. Жоғарыда келтірілген қосылыстардағы хлордың, күкірттің, азоттың, кремнийдіңм эквиваленттік массалары мынадай: 34, 45:1 =34, 45 г/моль, 32:1 = 16 г/моль, 14:3 = 4, 67 г/моль, 28 : 4 = 6, 5 г/моль.
Заттың эквиваленттік массасын - Э атомдық массаны А және стехиометриялық валенттілікті В - деп белгілейміз.
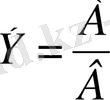
Химиялық эквиваленттің атомдық және молекулалық массасының айырмашылығының тұрақты өлшемі болмайды, ол валенттілігіне бай-ланысты болады. Эквиваленттердің тұрақты мағынасы тек қана эле-менттердің тұрақты валентілігіне байланысты болуы мүмкін эквивалент, эквиваленттік масса күрделі заттарға да қолданылады.
Күрделі заттың эквиваленті дегеніміз - оның сутегі атомдарының 1 молімен немесе кез келген заттың 1 эквивалентімен әрекеттесетін мөлшерін айтады.
Химияда эквивалент, эквиваленттік масса түсініктерін кеңінен қолданудың нәтижесінде эквиваленттер заңын ашу мүмкін болды және оның анықтамасы былай айтылады:
Элементтердің немесе күрделі заттардың бір-бірімен әрекеттесетін мөлшерлері олардың химиялық эквиваленттеріне пропорционал болады.
Бұл заңның математикалық өрнегі мынадай:
мұндағы
және - реакцияга кірісетін заттардың саны
Э 1 , Э 2 - осы заттың эквиваленттері.
Эквиваленттер заңының негізі, күрделі заттың эквивалентін есептегенде төмендегіше.
Қышқылдың эквиваленті оның молекулалық массасын, қышқылдық негізіне бөлгенге тең әйтпесе қышқылдағы сутегінің атомдар саны металдар атомдарымен араласады.
Мысалы, күкірт қышқылының эквиваленті, оның молекулалық мас-сасына екіге тең
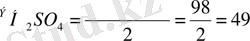
Негіздік амфотерлік гидроксидтердің эквиваленті оның молеку-лярлық массасын металдың валенттілігіне бөлгенге тең.
Сонымен, алюминий гидроксидінің эквиваленті оның молекулалық массасын үшке бөлгенге тең
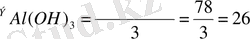
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz