Электродтар, стандартты электродтық потенциалдар және гальвани элементтер


Жоспар
І. Кіріспе
ІІ. Негізгі бөлім
1. Электрод. Электродтардың жіктелуі
1. 1. Активті электродтар
1. 2. Инертті электродтар
2. Электродтық потенциал
2. 1. Стандартты электродтық потенциал
3. Анод. Катод
ІІІ. Қорытынды
ІV. Пайдаланылған әдебиеттер
Кіріспе
Электрохимия - бұл химияның екі фазада бөліну шекарасында өтетін процестерді зерттейтін бөлімі. Мысалы: металл - ерітінді, зарядталған бөлшектердің қатысында (иондар мен электрондар) .
Электрлік процестердің химияда, яғни практикада үлкен маңызы бар. Бұл практикада химиялық қорған қаптағанда, металды тазарту мен алуда, олардың химиялық электр токтың көзінің негізінде жатыр.
Электрод. Электродтардың жіктелуі.
Химияның электрохимиясында электрод деп электролиттің ерітіндісі мен балқымадан тұратын қосылысқа ток өткізетін затты енгізілген жүйе. Электрөткізгіш ретінде қатты металдарды қолдануға болады (кесек, тақтайша, сым, ұнтақ күйлерінде болуы мүмкін) . Сұйық металл (сынап, металл балқымалары) . Әртүрлі қосылыстар (вольфрам карбиді, оксидтер) . Металл емесе материалдар (шыныкөмірсутектер, графит немесе жартылай өткізгіштер) .
Ең қарапайым электрод - металл, сол металл тұзының ерітіндісіне енгізілген.
Мысалы, Никель платинасы, NaCl 2 ерітіндісіне енгізілген. Сулы ерітіндіде тұз мынадай электрод (иондарға) диссоциацияланады:
NiCl 2 ↔︎ Ni 2+ + 2Cl -
Металдың сумен және еріген заттардың әрекеттесуінен, ерітіндідегі металдың иондары мен мелатдың арасында динамикалық тепе-теңдік орнайды.
Ni + 2e → Ni
Кейбір материалдар (платина мен графит) инертті деп аталады, себебі олар өз иондарын ерітіндіге өткізе алмайды. Олар, тотығу - тотықсыздану немесе редокс - электрондар болып қолданылады. Бұған мысал болып платина пластинасы. FeCl2 (2) және FeCl3 (3) бар ерітіндіге енгізілген.
Бұл ерітіндіде Fe пен Fe иондары болады. Fe ионы инертті металға жақындап оған электрондарын береді.
Fe - e → Fe
Fe ионы металға жақындағында одан электрон алады.
Fe + e → Fe
Электродта тепе-теңдік орнайды.
Fe + e → Fe
Инертті электрод материалы (платина) тепе-теңдік жүйеде электрон өткізгіш болып табылады.
Редокс - электрондарың ең көрнекті түрі - сутекті электрод: платина (тор, пластина күйінде) қышқыл ерітіндісіне батырылған, сол арқылы газ тәрізді сутекті өткізеді. Молекулалы сутегі, сүйықтық арқылы өткенде, бөліктеп еріп, платинаның бетіне жақындайды металл бетінде оның адсорбциясы өтеді, сонымен қатар молекулалар атомдарға ыдырайды. Адсорбцияланған сутегі атомдары Надс иондары ионданады, ал сутегі, ерітіндідегі сутегі ионы электрод қасындағы, электрон алып адсорбциялық күйге өтеді.
Надс - е →→ Н; Н + е Надс
Сонымен, сутекте электродта тепе-теңдік мынадай теңдеумен өрнектеледі.
2Н + 2е → 2Надс (Рt) Н2
н/е қысқартылып
2Н + 2е → Н2
Бүкіл электродтар тотығу-тотықсыздану жүйе болып табылады. Құрамында тотықтыру формасы (тотықтырғыш) және тотықсыздану формасы (тотықсыздандырғыш)
Ni + 2e → Ni
Fe + e → Fe
2H + 2e → H2
Бұл электродттық жүйені қысқаша жазып алуға болады.
Ni / Ni ; Fe, Fe ; 2H / H
Сұйықтықтың шекарасындағы - қатты зат вертикалды сызықпен белгілінеді, бір фазадағы заттар үтір арқылы жазылады.
Электродтардың химиялық табиғаты.
Электродтар активті не инертті болуы мүмкін. Мысалы, электродтық реакция, электролиздің сулы ерітіндісінде мыс сульфатында. Мұнда активті мыс не инертті графит қолданылуы мүмкін.
Мысты электродтарды қолданғанда электролитті ұяшықта келесі процесстер өтеді.
(а) Cu Cu + 2e (т-сыз)
(к) Cu + 2e Cu (т-ғу)
Графитті электродтарды қолданғанда:
(а) 4OH 2H2O + O2 + 4e (т-сыз)
(к) Cu + 2e Cu (т-ғу)
Электролит жағдайы:
Жарты реакциалар, бұл электролиттердің қандай күйде болуына байланысты. Балқыма не ерітіндіде. Сонымен қатар ерітіндінің концентрациясына байланысты.
Мысалы калий иодидінің балқымасы
(а) 2I I2 + 2e ( т-сыз)
(к) K + t K (т-ғу)
Бірақ калий иодидінің балқымасында
(а) 2I I2 +2e (т-сыз)
(к) 2H + 2e H2 (т-ғу)
Электрондық потенциал.
Стандартты электрондық потенциал.
Таза суға мырыш пластинасын батырсақ, оның беткі қабатындағы кристалдық тор көздерінің түшініндегі оң иондарының біразы полюсті су молекулаларының әсерінен үзіліп ерітіндіге өтеді. Иондар ерітіндіде су
молекулаларымен ұстасып гидраттанады. Металдың иондарынан айырылған беткі қабатындағы электрондары бос қалып оны теріс зарядтайды. Міне, осы теріс зарядталған қабат ерітіндідегі оң иондар қабатымен электростатикалық тартылыста болғандықтан, ел иондар қабатымен қайтадан металл бетіне келіп қонып та жатады және бүкіл гидраттанған оң иондар қабаты алысқа кетпей бетке жақын орналасады. Барған сайын металл беті еруі азайып, еріген иондардың қайта келу молаяды, ақыры жүйедегі металдың еру жылдамдығы мен оның металға қайта қолу жылдамдығы теңесіп тепеңдік қалыпқа келеді.
Ме + Су гидратталған металл ионы + электрондар.
Металл мен ерітіндінің түйіскен жерінде түзілген қабатты электрлік қос қабат деп аталады. (1сурет) Қабаттар арасындағы потенциалдар айырымын металдық электрондық потенциалы дейді (латынша potentia - мүмкіндік, қуат) .

Егер таза суға металдың ерімтал тұздарын бірін қоссақ, қабаттар арасында тепе-теңдік күй өзгереді. Ерітіндіден бөлініп, металл бетіне барып жабылады да, ерітінді теріс, металл ең зарядталады. Мұнда да электрондық потенциал айырымы туады. Өз түзының ерітіндісіне малынған электродтар активтігіне сай теріс (өте активті металдар), немесе оң (активтігі тым төмен металдар) зарядталып отырады.
Іс жүзінде суға электролит ерітіндісіне салғанда ерітіндіге ауысатын иондар мөлшері тым аз, оны химиялық әдіспен оп-оңай анықтау мүмкін де емес, бірақ қос электр қабатының арасында туатын потенциалдар айырымын қашанда орнаулы құралдармен өлшеуге жетерліктей болады.
Электродтық потенциал дегеніміз, металл (электрод) мен сұйық фазаның (су, электролит ерітіндісі) түйіскен жерде туатын электростатикалық потенциал болып табылады.
Электрохимиялық практикада стандартты электродтар қолданылады. Бұл қалыпты электродтарды қолданылады. Бұл қалыпты электродтардың жұмыстары стандартты жағдайда өтеді. t - 298k (25c) P=101325 Па және 1моль/л ертініді концентрацияда. Сонымен қалыпты сутекті электродта сутегі мен концентрациясы ерітіндіде 1моль/л тең болуы керек. Ал газ тәрізде сутектің қысымы - 101325 Па.
Абсолютті электродтық потенциалын электродтын аңықтауға болмайды. Тек электродтардың потенциалдарын салыстыруға болады.
Салыстырмалы электрондық потенциал деп - стандартты электрод потенциалын және ол Е деп белгілінеді. Егер электродтарды олардың
электродты потенциалы бойынша өсу бойымен орналастырсақ электродты стандартты потенциал қатары шығады.
Бұл қатарды қолдаған кезде ол тек сулы ерітінділер үшін екенін ескеру қажет, сулы емес ерітінділер мен балқымада қолданылмайды. Бұл қатар арқылы көп сұрақтарды шешуге болады. Мысалы, металдардың химиясы бойынша, соның ішінде металдардың орынбасу реакциясына қатысуын. Қай металдың электр терістігі басымырақ сол электр терістігі аз металды ығыстырады.
Металл мен сұйықтықтың арасындағы тұрақталған тепе-теңдік күйді қолдан өзгертуге болады, ол үшін металл бетіне жиналан артық электрондарды үздіксіз алып кетіп отырса болғаны. Дәл осы негізде жұмыс істейтін химиялық энергияны электр энергиясына айналдырып отырып гальвани элементтері болады.
Гальвани элементтерінің қарапайым мысалы: мыс-мырыш гальвани элементінің схемасы (2сурет) . Мундағы өз туздары ZnSO4 пен CuSO4 ерітіндісіне батырылған мырыш пен мысты гальвани элементінің электродтары деп аталады.
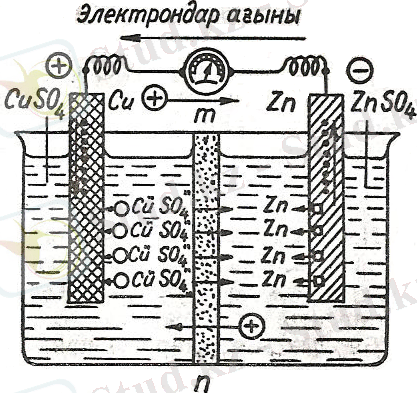
Актив металл мырыш пластинасының бетіне электрондар қалдықтары теріс, ал активтігі төмек мыс пластинасына иондар жиналатындықтан оң зарядталады.
Егер 2 пластина арасына сым өткізсек мырыштағы артық электрондар тобы электрондар жетпей турған мысқа қарай ағады, нәтежесінде сыртқа тізбекте
электр тогы туады.
Мысқа ағылып келген электрондар оның бетіндегі мыс тұзының ерітіндісінен келген Сu- иондарын нейтралдап отырады, ал жана түзілген нейтрал атамдар мыс электродтың бетіне жабысып жинала береді, CuSO4 молекуласынан бөлініп жеке қолған SO4 сульфат иондары кеуек тоспадан өтіп мырыш пластинкадан келген мырыштың оң ионы (Zn) мен әрекеттесіп еріміндіде ZnSO4 түзеді. Дәл осылайша Zn- иондары да мыс сульфатының ерітіндісіне өтіп ондағы SO4 - иондарымен қосылып ZnSO4 түзеді.
Мырыш пластмасының еруі өзінен 2 электрон беріп тотығуы, мыс иондарының бейтараптануы өзіне 2 электрон қосып алып тотықсыздануы болып табылады:
Zn - 2e = 2n’’ Cu’’ + 2e=Cu
Zn + Cu’’ = 2n’’ + Cu
Тотығу процесс жүретін электрод АНОД, ал тотықсыздану процесі жүретіні КАТОД деп аталады. Мұндағы Анод - мырыш, Катод - мыс.
Схемасы:
+(Cu) / (CuSO4) // (ZnSO4) / Zn(-)
Мұндағы ертіндіге он иондарын беретін мырыш электрод полюс, ерітіндіден оң иондарды жинайтын мыс оң полюсті кажетеді, екі ерітіндіні бөлігіне тоспа - айырып тұрады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz