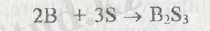III A топындағы элементтерді (бор, алюминий, галлий, индий, таллий) оқыту әдістемесі


ҚАЗАҚСТАН РЕСПУБЛИКАСЫ БІЛІМ ЖӘНЕ ҒЫЛЫМ
МИНИСТРЛІГІ
ОҢТҮСТІК ҚАЗАҚСТАН ПЕДАГОГИКАЛЫҚ УНИВЕРСИТЕТІ
«Отырар» институты
«Көпсалалы педагогикалық пәндер» кафедрасы
ДИПЛОМДЫҚ ЖҰМЫС
Тақырыбы: ІІІ «A» топша элементтері тақырыбын оқыту әдістемесі
Орындаған: 35-61 топ студенті Г. Рыскелдиева
Ғылыми жетекшісі: х. ғ. к., профессор И. А. Мархабаев
Шымкент - 2010
ОҢТҮСТІК ҚАЗАҚСТАН ПЕДАГОГИКАЛЫҚ УНИВЕРСИТЕТІ
«Отырар» институты
Факультет: «Жаратылыстану - педагогикалық»
Мамандық: «Химия»
Кафедра: «Көпсалалы педагогикалық пәндер»
Дипломдық жобаны (жұмысты) орындауға арналған
ТАПСЫРМА
Студент : топ
Жобаның (жұмыстың) тақырыбы:
ЖОО № « »2010 ж. Бұйрығымен бекітілген
Дипломдык жобадағы әзірлеуге жататын сұрақтардың тізімі немесе дипломдық жұмыстын кысқаша мазмұны:
а)
б)
в)
Графикалық материалдың тізімі (міндетті дәл нұсқап)
Ұсынылған негізгі әдебиеттер:
Жобаға (жұмысқа) қатысты тарауларды нұскап жоба (жұмыс) бойынша консультациялар
№
Р/н
Консультант
Мерзімдері
Қолы
Орындауды бастау
Ұсынулар
Дипломдық жобаны (жұмысты) әзірлеудің кестесі
№ Р/н
Ескерту
Тапсырманың берілген күні « » 200 ж.
Кафедра меңгерушісі
Жобаның(жұмыстың) жетекшісі
Тапсырманы орындауға қабылдаған студент
Жетекшісінің пікірі
Жетекші « » 2010 ж.
Дипломдық жұмыс туралы кафедра қорытындысы
Дипломдық жұмыс кафедрада қаралды және
студент осы жұмысты
Мемлекеттік аттестациялау комиссиясында қорғауға жіберілуі мүмкін
Кафедра меңгерушісі « » 2010 ж.
ҚАЗАҚСТАН РЕСПУБЛИКАСЫ БІЛІМ ЖӘНЕ ҒЫЛЫМ МИНИСТРЛІГІ
ОҢТҮСТІК ҚАЗАҚСТАН ПЕДАГОГИКАЛЫҚ УНИВЕРСИТЕТІ
«Отырар» институты
Студенттің дипломдық жобасына (жұмысына)
ПІКІР
Сізге институттың тобының студенті
жіберілді.
Пікірде келесі мәліметтерді көрсетуіңізді сұранамыз:
- Тапсырманың орындалуының жан-жақтылығы, технико-экономикалық түсініктемесі, экономикалық есептеулер, конструктивтік шешімдері, сызулардың сапасы, еңбекті үйымдастыру.
- Теориялық білімдердің деңгейі, оларды жұмыста пайдалану дәрежесі, өндірістің тәжірибелік жағдайларын есепке алу және шешімдердің нақтылығы.
- Жұмысты зерттеудің тереңдігі мен ерекшелігінің негізгі белгілері.
- Жұмысты рәсімдеудің сапасы мен жалпы сауаттылығы.
- Сызу жұмыстарының сапасы.
- Отандық және шет елдік әдебиеттерді қолдану деңгейі.
- Жұмысты орындаудың жалпы бағасы.
Жауап беруді, түсіндіруді немесе диплом жазушының қорғауын талап ететін жұмыста кездескен қателіктерді ерекше көрсетуіңізді сұранамыз.
Пікірді "" 2010 ж күннен кешіктірмей беруіңізді және ""2010ж күні болатын Мемлекеттік Аттестациялық Комиссияның отырысына қатысуыңызды сұраймыз.
Кафедрамеңгерушісі""2010ж.
Жобаның (жұмыстың) тақырыбы
Тақырыбы: «ІІІ А топша элементтері тақырыбын оқыту әдістемесі»
МАЗМҰНЫ
Кіріспе . . . …7
І. ТАРАУ. III «А» топша элементтерінің жалпы сипаттамасы
1. 1 . Бордың физикалық және химиялык қасиеттері . . . 9
1. 2. Оксидтері . . . 18
1. 3. Бор қышқылы және тұздары . . . 19
1. 4. Сульфидтері . . . 22
1. 5. Н и т р и д і . . . 23
1. 6. Гидридтері және бордың қолданылуы . . . 25
ІІ. ТАРАУ. АЛЮМИНИЙ
- Алюминий галогенидтері . . . 27
- Алюминий оксиді және гидроксиді . . . 32
- Алюминий сульфилі, нитриді, фосфиді, карбиді және бориді . . . 34
- Алюминий құймалары және алюминий қосылыстарының қолданылуы . . . 38
ІІІ. ТАРАУ. ГАЛЛИЙ, ИНДИЙ ЖӘНЕ ТАЛЛИЙ
3. 1. Г а л л и й туралы жалпы тусінік . . . 42
- И н д и й жалпы сипаттама . . . 46
- Т а л л и й қасиеттері . . . 51
Қорытынды . . . 60
Пайдаланылған әдебиеттер . . . 62
КІРІСПЕ.
Бор, алюминий, галлий, индий және таллий периодтық кестеде III А топша элементтерінің негізгі топшасын құрайды. Аталған элементтердің негізгі физикалық шамалары 1-кестеде келтірілген.
1-кесте
III А топша элементтерінің негізгі физикалық шамалары .
 B
B
 Al
Al
 Ga
Ga
 In
In
 ТІ
ТІ
 °
С
°
С
 °
С
°
С
Салыстырмалы қаттылы
(алмаз шкаласы)


Валенттік байланыс әдісі бойынша III А топша элементтерінің атомдарының электрон бұлттарына өздерінің құрылымына сәйкес sр 2 - және sр 3 будандасу тән (1-сурет) .

1 - сурет. sр 2 - және sр 3 будандасқан электрон бұлттарының түрлері.
ВСІ3 - sр 2 - будан
І. ТАРАУ. III «А» топша элементтерінің жалпы сипаттамасы
1. 1. Бордың физикалық және химиялык қасиеттері.

Ашылуы .
Бор 1808 ж. ашылған француз ғалымдары Жозеф Гей-Люссак және Луи Тенар жаңа элемент ашқандықтарын жариялады. Өздерінің жаңа элементті алу жолын төмендегідей желіде (схемада) келтірді.

Мұнан соң, бірнеше айдың жүзінен кейін Х. Дэви балқыған бор ангидридінен бор алғандығын мәлімдеді.
Француз ғалымы Анри Муассан жоғарыда аталған ғалымдардың таза бор ала алмағандығын дәлелдей отырып, өзінің магнийтермиялық әдісін ұсынды, яғни:

Алайда бұл әдіспен алынған борда-бор элементі 90%-тен аспайтындығын металлург В. Кролль айта отырып, ол бор тазалығын 93-94% көтерді. 1858 ж. оқымыстылар Ф. Велер және Сент-Кляр Девиль бор элементінің алмаз тақілеттес - кристалдық және графитке ұқсас - аморфты екі түрлі модификациялық түр өзгерісі болатындығьш мәлімдеді.

Таза бор элементін 1908 ж. американ зерттеушісі Э. Вейн-трауб бор хлоридін сутекпен электр доғасы температурасымда тотықсыздандырып (99%) алды.
Табиғи қосылыстары.
Бордың маңызды табиғи қосылыстарына төмендегі
минералдар жатады:

Алынуы.
1. Бор минералдарын өңдеу арқылы бор оксидін алады да, оны тотықсыздандырады.

- Бор өзінің хлоридінен, бромидінен тотықсыздандыру арқылы алынады:

Келтірілген екі әдісте де құрамында қоспасы бар аморфты бор алынады.
3. Таза борды оның хлоридін сутекпен тотықсыздандыру арқылы немесе кристалдық борды қыздырылған тантал не вольфрам сымына қондыру арқылы алады.

Жалпы таза борды алудың тиімді жолына диборанды термиялық жолмен ыдырату жатады:

Физикалық қасиеті
Бор металдық қасиетті жартылай көрсететін металл емес элемеит. Бөлме температурасында электрлік өзткізгіштігі өте төмен борды қыздырғанда аталған қасиет күрт артады. Ол ионын түзбейді.
Бор - алмаздаи кейінгі қатты элемент. Тұрақты кристалдық құрылымының түрі-
 -ромбоэдр (5. 2-сурет) . Сонымен қатар, бордың аморфты түр өзгерісі де бар.
-ромбоэдр (5. 2-сурет) . Сонымен қатар, бордың аморфты түр өзгерісі де бар.
Бордың физикалық қасиеті жөнінен оқулықтардың өзінде пікір алуап түрлі.

2-сурет . Ромбэдр бордың проекциясы. Төбесінен және астынан қарағанда икосаэдр.

Мысалы. Қысқаша химиялық эициклопедияда кристалдық бор қарасүр, ұнтақ деп жазылса, екінші бір оқулықта (Б. В. Некрасов. Основы общей химии) борды қарақоңыр ұнтақ дей келіп, өте таза бор түссіз деп түйіндейді.
Шындық қайда?! Ал, шындық, екі жағында қамтиды, өйткені бор қасиетіне қоспалардың оннан не жүзден бір процентінің болуы қатты әсер етеді.
3- сурет.
В
 атомдарының
атомдарының
икосаэдр құрылымы.
Мысалы, бір оқулықта бордың балқу температурасы 2015°С ал екінші біреуінде -2300°С. Дәл осындай алшақтық қайнау температурасында да бар.
Сондықтан да бордың осынша модификациялық түр өзгерісі бар деп айтудың өзі сақтықты талап етеді. Десек те бор атомдары жай зат күйінде В
-жиырма қырлы икосаэдп түзетіндігі көпшілікке аян. Икосаэдр бейнесі 3-сурет тегідей болады.

Бор жартылай өткізгіштік қасиетке ие, диамагнитті элемент.
Химиялық қасиеті.
Бор кәдімгі жағдайда салғырт (инертті) э; емент қатарына жатады. Шамалы қыздыруда фтормен әрекетт5седі.
Жоғары температурада хлор, оттек, күкірт азотпен әрекеттеседі:

Сутекпен бор әрекеттеспейді! (Кейбір оқулықтарда жоғары қысым және жоғары температурада бордан түзілуін келтіреді) .
Қатты қыздыру барысында бор тотықсыздандырғыштық қасиет көрсетіп кремнийді, фосфорды, сутекті оксидтерінен бөліп шығарады.
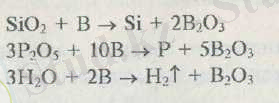
Борға қайнап жатқан тұз қышқылы, балқытқыш қышқыл әсер етпейді. Бор - концентрлі азот, күкірт қышқылдарымен, патша арағымен баяу әрекеттеседі
.

Барлық жағдайда кристалдық құрылымдағы бор, аморфты борға қарағанда химиялық салғырттық (инерттілік) танытады. Мысалы, сілтілер кристалдық құрылымдағы борға әсер етпейді, ал аморфты бормен төмендегідей түрде әрекеттеседі:

Металдармен балқыту барысында бор тотықтырғыштық қасиет көрсетіп боридтер түзеді. Боридтерде бордың тотығу дәрежесі 3-ке тең.
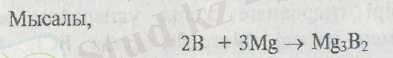
Ауыспалы d -металдардың боридтері М
4
В дан МВ
 түрдегі құрамда болып келеді. Мысалы: ииобий боридтері - Nb
2
В, Nb
3
В
2
, NbВ, NВзВ
түрдегі құрамда болып келеді. Мысалы: ииобий боридтері - Nb
2
В, Nb
3
В
2
, NbВ, NВзВ
 , Температураны төмендету үшін өзге тұздар балқымасы қосылады. болаттан жасалған катод-балқымаға ұшы ғана тиіп тұрады. Бөлінген кальций болат бетіне қонады және катод жайлап көтеріліп отырады:
, Температураны төмендету үшін өзге тұздар балқымасы қосылады. болаттан жасалған катод-балқымаға ұшы ғана тиіп тұрады. Бөлінген кальций болат бетіне қонады және катод жайлап көтеріліп отырады:
Катод (болат)

Анод (көмір)

Катод ретінде өзге металдар пайдаланылса, онда олардың кальциймен құймасы түзіледі. Мысалы, кальцийдің мырышпен, қорғасынмен және мыспен құймаларын осылай алуға болады.
2. Кальцийді алюминотермия және кальций карбидіи ыдырату арқылы алу жолдары жетілдірілуде:



Химиялық қасиеті.
- Кальций гадогендермен оңай қосылады.

2. Калыций оттекпен оңай қосылады да негіздік оксид түзеді:

Бериллий мен магнийге қарағанда сілтілік жер металдары артық мөлшердегі отекпен - пероксид түзеді:


СаО 2 -275°С-де қопарылыс бере ыдырайды. Кальций асқын пероксид Са(Оз) : -де түзеді.
Жалпы жағдайда кальций оксидін және кальций пероксидін төмендегідей реакциялар бойынша алады:

Бұл өздеріңізге белгілі сөндірілмеген ізбес алу реакциясы.


Кальций оксиді, пероксиді кәдімгі жағдайда сумен жеңіл әрекеттеседі:

Кальций оксиді, гидроксиді негіздік оксидтермен, негіздік гидроксидтерге тән химияялық қасиет көрсетеді.
Кальций оксидін сөндіру барысында судың орнына натрий гидроксиді ерітіндісін қосатын болса, Са(ОН)
 мен NаОН қоспасы натронды ізбес түзіледі: Са(ОН)
мен NаОН қоспасы натронды ізбес түзіледі: Са(ОН)
 NаОН.
NаОН.
Кальцин күкіртпен қосылып сульфид береді:
Са + S = СаS
Аланда кальций сульфидін сульфаттарды өңдеу барысында төмендегі реакция бойьнша алады:
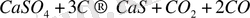
Кальций сульфидін артЫҚ мөлшердегі күкіртпен қосып қыздыру арқылы оның полисульфиді алынады:
n=2, 3, 4, 5, 6.
Сілтілік жер металл полисульфидтері терідегі жүнді түсіру барысында тиімді препарат болып табылады. Ал, сілтілік жер металдарының сульфидтеріне кейбір ауыр металдардың қатты ерітінді түзуі оларға фосфоросценциялық қасиет береді.
Кальций сульфиді нашар ериді, ал қышқылдарда еріп түз түзеді:
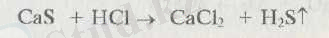

Нитридтер сумен оңай әрекеттесіп, мол жылу боледі:

Кальций фосформен әрекеттесіп фосфид түзеді:

Кальцнй фосфиді де сумен оңай ыдырайды:

3. Кальций азотпен кәдімгі температурада әрекет әрекеттесіп нитрид түзеді:
4. Калций карбиді оның оксидін кокспен қосу арқылы электр пештерінде алынады:

Кальций карбиді ацетилен алуда кең қолданылады
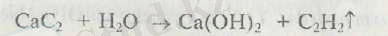
5. Кальцин гидриді сутекпен тікелей әсер ету арқылы алынады:

СаН 2 - тұз тектес иондық гидрид тобына жатады жәпе сумен оңай ыдырайды:

6. Кальций көптеген металдармен интерметаллидтер
түзеді.
7. Кальций күрделі заттармен оңай әрекеттесіп тотықсыздандырғьшттық қасиет көрсетеді:

Кальцийдің қолданылуы
Кальций металлургияда сирек жер металдарды, ауыспалы бейметалдарды алуда кең қолданыс табады.
Кальций карбиді ацетилен алуда және вакуумтермиялық
жолмен сілтілік металдар алуда қолданылады. Мысалы:

СаҒ 2 - суда ерімейтін, металлургияда флюс ретінде металдарды бос жыныстан ажырату үшін кең қолданылады.
Кальций қосылыстары - ең цемент, алебастр, гипс бәрі де құрылыска қажетгі заттар.
Залалсыздандырғыш, тотықтырғыш ретінде кальций гипохлориті- Са(С1О)
және аралас тұз хлорлы ізбес Са(СIO) С1 түрмыста, медицинада қолданылады.
Хлорлы кальций, цемент, ағаш үгінділерін суда араластырып алынған «Арболит» атты құрылыс материалы өте құнды қасиеттерге ие. Арамен оңай аралапатын және оңай өңделетін отқа жанбайтын, шірімейтін бұл материал үй салуда кең пайдаланылады.
Натронды ізбес көмір қышқыл газын сіңіруде пайдаланылады.
Үйді әктеуде пайдаланылатын сөндірілген ізбестің қабырға немесе әктелген бетті ағартуы төмепдегідей реакцияның орын алуынан:
Са(ОН) 2 + СО
СаСО
+ Н
О
Құрылыста портлапд цемент деген атпен пайдаланылатын цемент құрамы төмендегіден:
ЗСаО 8іО ; , 2СаО 8іСЬ, ЗСаО А1 а О 3 және 4СаО -АЬОз-Ғе. Оз
- глинозем цементі СаО-А1 2 О 3 -тің ерекше қасиеті ол тек ауада ғана емес, су бойында да қатып, беріктілік тұтастық сақтай алады.
Цемент - бетон тақырыбы оз алдына үлкен сала.
Анықталуы
Су бойында Са э+ комплексонометриялық титрлеу арқылы анықталады. Магнийді су бойында анықтауды қара.
Бордың галогенидтері.
Бордың галогенидтері - бормен галогендерді қыздыру арқылы алынады және барлығы түссіз болып келеді (2-кесте) .
Галогенидтер молекулалық тор құрамындағы заттар.
Бор фторидін және хлоридін көп жағдайда төмендегі реакциялар бойынша алады:

Бордың галогенидтері жұп электронды заттарды қосып алуда айқын акцепторлық қасиет көрсетеді.

суда жақсы еритын бір негізді қышқыл.
Бор галогенидтері гидролизге жеңіл ұшырайды жіне қайтымсыз, толығымен жүреді. Ылғалды ауада ВСІ 3 , ВВr
түтінденеді (дымят), ал ВІ 3 сумен әрекеттесеуі қопарылыс бере жүреді.
Бор фторидінің гидролизі күрделі өзгерістерге толы өтеді:

Қалған бор галогенидтерінің гидролизі нақты жүреді:

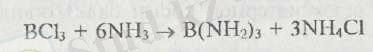
Бор галогениді сұйық аммиакпен әрекеттеседі. Мысалы,
ВҒ
3
 ВСІ
ВСІ
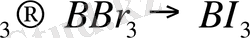 қатарында солдан оңға қарай, яғни ВҒ
3
-> ВІз бағытында тұрақтылық кемиді.
қатарында солдан оңға қарай, яғни ВҒ
3
-> ВІз бағытында тұрақтылық кемиді.
ВНа1 3 - қосылыстардағы бордың sр 2 -будан түрінде болуы, оның қосылыстарының жазық үшбүрыш құрылымында болуына негіз болады.
ВҒз -катлизатор ретінде олефиндерді катионды полимеризациялауда қолданылады.
1. 2. Оксидтері.
В 3 О 3 - бор оксиді- бірнеше түрлі модификациялық құрылымда ұшырасады.
Бор оксидін бор қышқылын ыдырату арқылы алады:
В 2 О 3 балқымасын салқындату барысында түссіз, шыны тәріздес кристалдық құрылымдағы полимер (В 2 О 3 ) n түзіледі. Аталған заттың құрылымы төмендегідей болып келеді:

Бор оксидін бор қышқылын ыдырату арқылы алады:
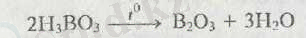
В 2 О 3 «ылғалға өш» (гигроскопический), сумен қосылуы бірнеше сатыда орын алып, қышқыл түзеді:

Сумен ары қарай қосылу нәтижесінде
сияқты қышқылдар түзіліп, ең соңы ортобор қышқылы - Н
ВО
-кЕ айналады.
Бор оксиді қышқылдық оксидтерге тән қасиет көрсетеді. Негіздік оксидтермен балқьту барысыңда метабораттар түзеді:
СоО + В
2
О
3
-> Со(В0
2
)
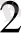 кобальт метабораты.
кобальт метабораты.
Сілтілік металл гидроксидтермен қосып балқытқанда тұз түзеді:
В
О 3 + КОН
2КВО 2 + Н 2 О
Сілті срітінділермен қосылып гидроксокомплексті қосы-лыс түзеді:

1. 3. Бор қышқылы және тұздары
Н
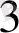 ВО
ВО
 немесе В(ОН)
3
бор қышқылы, ақ түсті, ұстағанда «майлы» әсер қалдыратын ұнтақ зат. Суда ерігіштігі 100 г суға 4, 9 грамды құрайды (20°С) . Ерітіндісі әлсіз қышқыл. Сілті ерітінділермен әрекеттесіп гадроксокомітлекстер түзеді:
немесе В(ОН)
3
бор қышқылы, ақ түсті, ұстағанда «майлы» әсер қалдыратын ұнтақ зат. Суда ерігіштігі 100 г суға 4, 9 грамды құрайды (20°С) . Ерітіндісі әлсіз қышқыл. Сілті ерітінділермен әрекеттесіп гадроксокомітлекстер түзеді:

Бор қышқылы ұнтағын КОН пен балқытқанда тізбекті (ВО
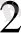 )
)
 n-
аниомы бор полимертектес диоксобораттар түзіледі:
n-
аниомы бор полимертектес диоксобораттар түзіледі:
Эфир ақ-жасыл жалынмен жанады:
2В(ОСН
+ 9О

В 2 О 3 + 6СО
+ 9Н
0
Бор қышқылын бор хлоридін гидролиздеп немесе бураға күкірт қышқылын қосу арқылы алады:

Келтірілген соңғы реакцияны сатылап төмендегідей түрде жазуға болады:

Ал, түзілгеи сутегінің гептаоксобораты сумен жылдам әрекеттесіп, ортобор қышқылын түзеді:

Түзілген ортобор қышқылын артық мөлшердегі сілтімен бейтараптандырғанда қайтадан ерітндіден кристаллогидрат түрінде бөлінетін полиборат түзіледі:

құрылымы В 2 О 3 құрылымына ұқсас төмендегідей болады:
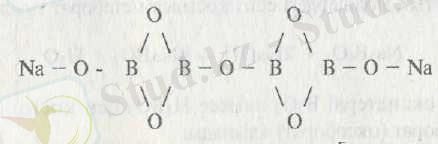
Бор қышқылының сусыздануы барысында метабор қышқылы НВО 2 түзіледі:
НзВОз -> НВО
+ Н 2 О
НВО
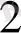 - куб, моноклинді және ромбылық модификациялық құрылым түрінде ұшырасады. Жалпы жағдайда:
- куб, моноклинді және ромбылық модификациялық құрылым түрінде ұшырасады. Жалпы жағдайда:

Метабор қышқылының бір түрі тұйық сақиналы болып келеді (НВО
) з, яғни сутектік байланыс арқылы жазық қабаттар түзеді. Тұйық сақиналы метабор қышқылының құрылымы төмендегідей түрде болады:

Бор қышқылының тұздары
Ортобор қышқылының тұздары бораттар деп аталынады, Метабор қышқылының (НВО
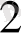 ) тұздары метабораттар немесе оксобораттар делінеді.
) тұздары метабораттар немесе оксобораттар делінеді.
Мысалы, натрий тетрабораты Ка
3
В4О
7
-тетраборат өкілі оның кристаллогидраты Nа
 В
4
О
В
4
О
 ЮНіО бура деп аталынатыны белгілі.
ЮНіО бура деп аталынатыны белгілі.
Бураға артық мөлшердегі сілті қосылса метаборат түзіледі:
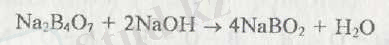
Негіздік оксидтерді В2О3 немесс Н3ВО3 пен қосып балқыту арқылы метаборат (оксоборат) алынады:
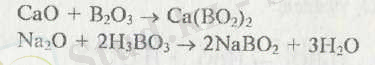
Метабораттар тұйық сақиналы, полимертізбекті құрылымда болып келеді (5. 4-сурет) .

4 - сурет. Калий және кальций диоксобораттарьшың құрылымы
Пероксобораттар.
Пероксобораттар өкіліне
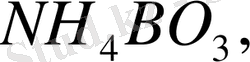 КВОз, NаВОз,
КВОз, NаВОз,
 жатады. Пероксобораттар құрылымы зерттелуде. Мысалы, натрий метаборатына сутек асқын тотығымен әсер ету арқылы натрийдің бис (
жатады. Пероксобораттар құрылымы зерттелуде. Мысалы, натрий метаборатына сутек асқын тотығымен әсер ету арқылы натрийдің бис (
 - ) гекса гидраты алынады:
- ) гекса гидраты алынады:
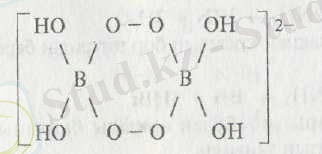
1. 4. Сульфидтері
Бор сульфиді
шыны тәріздес, суда оңай гидролизге ұшырайтын зат.
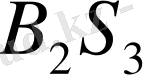 борға күкірт буымен 600°С шамасында өсер еткенде түзіледі:
борға күкірт буымен 600°С шамасында өсер еткенде түзіледі:
Бор сульфиді жеңіл гидролизге ұшырайды:
+ 6Н
О
Н 3 ВОз + ЗН 2 S
Сонымен катар В 2 S -моносульфиді де борға тәп.
+ 2Н 2
В 2 S+2Н 2 S
Металдардың сульфидтерімен бор сульфидін қосып балқытқанда сульфидобораттар түзіледі:
СаS+ В 3 S 3 -> Са(ВS 3 ) 2
Сульфидобораттарды тиобор қышқылының туындылар деп қарастыруға болады:
Са(ВS) 2 + H 2 8О 4 = СаSО 4 + 2НВS 2
тиобор қышқылы
Тиобор қышқылы тұрақсыз, суда оңай ыдырап, бор қышқылын түзеді:
НВS 2 + ЗН 2 О -> Н 3 ВОз + 2Н 2 S
1. 5. Н и т р и д і
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz