Металдар: құрылымы, физико-химиялық қасиеттері, кен көздері мен өндіру әдістері, электродтық потенциалдар, коррозия және құймалар


Жоспар
Кіріспе
- Металдар.
Негізгі бөлім
- Металдық байланыс және металдардың физикалық қасиеттері.
- Металдардың химиялық қасиеттері.
- Металдардың табиғатта таралуы және оларды алу тәсілдері.
- Металдардың электродтық потенциалдары және олардың кернеу қатары.
- Металдардың коррозиясы.
- Құймалар.
Қорытынды
Кіріспе
- Металдар.
Химиялық элементтердің көпшілігі металдар болып табылады. Қазіргі кездегі белгілі 109 элементтің 80-нен астамы металдарға жатады.
Д. И. Менделеевтің периодтық жүйесіндегі барлық s-элементтер (бірінші және екінші негізгі топшалар), d-элементтер (барлық қосымша топшалар), f-элементтер (лантаноидтар мен актиноидтар) металдарға жатады. р-элементтер III - VIII негізгі топшаларда орналасқан. Бұл топшалардың жоғарғы жағына бейметалдар, төменгі жағына металдар орналасқан. Мысалы, бордан астатқа дейін түзу сызық жүргізсе, III - VIII негізгі топшалардың р-бейметалдары сызықтың жоғарғы жағына, металдары төменгі жағына, ал сызыққа таяу металдық та, бейметалдық та қасиет көрсететін амфотерлі р-элементтер орналасады.
Негізгі бөлім
- Металдық байланыс және металдардың физикалық қасиеттері.
Металдардың сыртқы қабатында бірден төртке дейін ғана электрондар болады. Сондықтан олар валенттілік электрондарын беріп, оң зарядты иондарға оңай айналады. Бұл электрондар белгілі бір атомдарға тән болмай, барлық атомдарға ортақ болады.
Металдардың кристалдық торлары нейтрал атомдар мен катиондардан тұрады. Металдарда ретсіз қозғалып жүрген электрондар катиондарға тартылып, химиялық байланыс түзеді және олар катиондармен қосылып уақытша нейтрал атомдар түзуі мүмкін. Ковалентті және иондық байланыстардан айырмашылығы металдардағы ортақтастырылған аздаған электрондар, біріншіден, көптеген катиондарды бір-бірімен байланыстырып тұрады, екіншіден, металл бойымен еркін қозғалып жүреді. Осындай байланыстың ерекше түрін металдық байланыс деп атайды.
Металдардың физикалық қасиеттері металдық байланыс арқылы түсіндіріледі. Барлық металдар (сынаптан басқа) қалыпты жағдайда қатты заттар, түскен сәулені шағылыстыратындықтан олардың металдық жарқылы болады. Әсіресе күміс пен индийдің жарқылы өте күшті болғандықтан, оларды айналар, прожекторлық айналар мен рефлекторлар жасауға пайдаланады. Металдық жарқыл тек кесек күйінде байқалады, ал ұнтақ күйдегі металдар қара түсті болады және металдық жарқылы болмайды. Алюминий мен магнийдің ұнтақ күйінде де металдық жарқылы байқалады.
Металдар электр тогын және жылуды жақсы өткізеді. Олардың электр өткізгіштігі металдардағы бос электрондардың болуына байланысты. Бос электрондар потенциалдар айырмасының шамалы әсерінің өзінен теріс полюстен оң полюске қоғала бастайды. Сонымен металдардың электр өткізгіштігі олардағы бос электрондардың болуына ғана байланысты емес, сонымен қатар металдардың ішкі құрылысына және электрондардың жылжуына көмектесетін жағдайларға да байланысты болады.
Металдар жылуды да жақсы өткізеді. Олардың жылуды жақсы өткізуі де бос электрондардың болуына байланысты. Металдарда қозғалып жүретін бос электрондар тербелмелі қозғалыста болатын иондармен үнемі энергия алмасып отырады. Осыған байланысты металл массасындағы температура тез теңеседі.
Металдардың жылу өткізгіштігі электр өткізгіштігіне сәкес келеді, яғни электрді жақсы өткізетін металдар жылуды да жақсы өткізеді.
Металдардың маңызды қасиеттеріне жарықтың немесе жылудың әсерінен электрондар бөліп шығаруы жатады. Бұл қасиет, әсіресе, сілтілік металдарда өте күшті. Сондықтан металдардың жылудың әсерінен электрондар бөлу қасиеттерін радиотехникада, теледидарда электрондық лампалар жасауға, ал сәуленің әсерінен электрондар бөлуін фотоэлементтер жасауға қолданады.
Металдардың созылғыштық қасиеттерінің маңызы өте зор. Сыртқы күштердің әсерінен өздерінің пішіндерін өзгертіп және сол өзгерген пішінін күш әсер етуін тоқтатқаннан кейін сақтап қалу қасиетін металдардың созылғыштығы дейді. Күшпен әсер ету арқылы металдардан жұқа қаңылтырлар, жіңішке сымдар және т. б. жасауға болады. Металдардың ішінде ең созылғышы алтын. Мысалы 1 г. алтыннан ұзындығы 3 км. сым жасауға болады. Платинаның, күмістің, мыстың, қорғасынның, темірдің созылғыштықтары жоғары болады, ал созылғыштығы өте төмен металл - марганец.
Тығыздықтарын байланысты металдарды жеңіл және ауыр деп шартты түрде екі топқа бөледі. Тығыздығы 5 г/см 3 -тен кем болатындарын жеңіл , ал қалғандарын ауыр металдар дейді. Жеңіл металдарға жер-сілтілік металдар, алюминий, титан және т. б. жатады. Ең жеңіл металл литий (тығыздығы 0, 53 г/см 3 ), ең ауыр металл - осмий (тығыздығы 22, 6 г/см 3 ) . Металдардың тығыздығы олардың салыстырмалы атомдық массаларына, атомдық радиустарына, кристалдық торларындағы атомдардың орналасу тығыздығына байланысты.
Металдардың балқу температурасы олардың кристалдық торларындағы бөлшектерінің арасындағы байланыстардың мықтылығымен анықталады. Металдардың балқу температурасы кең көлемде өзгереді. Ең оңай балқитын металл - сынап (t балқу = -39 о С), ал ең қиын балқитын металл - вольфрам (t балқу =3390 о С) .
Қаттылығы жағынан да металдардың бір-бірінен айырмашылығы өте зор. Ең жұмсақ металдар натрий мен калий (оларды пышақпен де кесуге болады), ал ең қатты металдар хром, вольфрам (соңғы металл шыныны да кеседі) .
Металдарды түстеріне қарай шартты түрде қара және түсті деп екі топқа бөледі. Қара металдарға темір мен оның құймалары және темірмен құйма түрінде қолданылатын хром және марганец жатады. Қалғандарын түсті металдар деп атайды. Осыған байланысты темір және оның құймаларын өндіретін өнеркәсіпті қара металлургия, ал қалған металдарды өндіретін өнеркәсіптерді түсті металлургия деп атайды.
Түсті металдар сілтілік, жер-сілтілік, сирек кездесетін, самород металдар болып бөлінеді.
Сирек металдарға өздері жеке кендер түзбейтіндері (мысалы, берилий, молибден, вольфрам, ванадий, рений) жатады. Самород металдарға бос кездесетін алтын, платина, күміс және т. б. жатады.
- Металдардың химиялық қасиеттері.
Металдардың химиялық активтілігі олардың валенттілік электрондарын беру қабілетіне байланысты болады: электрондарын оңай беретін металдар күшті тотықсыздандырғыштар, ал электрондарын қиын беретін металдар әлсіз тотықсыздандырғыштар болып табылады.
Металдардың тотықсыздандырғыштық қасиеттері олардың стандартты потенциалдарының сандық мәнімен анықталады. Кернеу қатарында стандартты потенциалдардың алгебралық мәні азаюына байланысты олардың тотықсыздандырғыштық қабілеті артады.
Кернеу қатарында бұрын тұрған металл өзінен кейін тұрған металды тұзынан ығыстырады:
Mn + Pb(NO 3 ) 2 → Mn(NO 3 ) 2 + Pb
Cu + Hg(NO 3 ) 2 → Cu(NO 3 ) 2 + Hg
Кернеу қатарында сутектен бұрын тұрған металл оны қышқылдан ығыстырады:
Mn + 2HCl → MnCl 2 + H 2 ↑
Металдардың көпшілігі (алтын, платина, иридийден басқалары) тотықтырғыш қышқылдармен - азот қышқылымен және концентрлі күкірт қышқылымен әрекеттескенде сутегі бөлінбейді. Бұл жағдайда металдар тотығады, ал қышқыл қалдықтары бұзылып тотықсызданады. Металдардың активтілігіне және қышқыл концентрациясына байланысты қышқыл түзуші элемент әртүрлі күйге дейін тотықсызданады. Мысалы:
2H 2 SO 4 + Cu → CuSO 4 + SO 2 + 2H 2 O
2HNO 3 + Ag → AgNO 3 + NO 2 + H 2 O
Тотықтырғыш қышқылдарда ерімейтін металдар, мысалы алтын, «патша арағы» деп аталатын, үш көлем тұз қышқылы мен бір көлем азот қышқылында еріп тотығады:
Au + HNO 3 + 3HCl → AuCl 3 + NO + 2H 2 O
Металдар сумен қышқылдар сияқты әрекеттесуі керек. Бірақ судағы сутек иондарының концентрациясы өте аз болғандықтан онымен тек актив металдар (сілтілік және жер-сілтілік) әрекеттеседі:
2K + 2HOH → 2KOH + H 2 ↑
2Fe + 3H 2 O → Fe 2 O 3 + 3H 2 ↑
Амфотерлі металдар қышқылдарда да, сілтілерде де ериді:
Sn + 2HCl → SnCl 2 + H 2 ↑
Sn + 2NaOH → Na 2 SnO 2 + H 2 ↑
Металдардың көпшілігі бейметалдармен әрекеттесіп оксидтер, галогенидтер, сульфидтер, фосфидтер, карбидтер, нитридтер түзеді.
- Металдардың табиғатта таралуы және оларды алу тәсілдері.
Металдар табиғатта кең таралған. Жер қыртысында 7, 5% алюминий, 4, 2% темір, 3, 25% кальций, 2, 4% натрий, 2, 4% калий, магний, титан болады. Металдар бос және қосылыс күйінде кездеседі. Кернеу қатарында сутектен кейін орналасқан металдар ғана бос күйінде кездеседі.
Өнеркәсіп көлемінде металл өндіруге жарайтын металдардың табиғи қосылыстарын кен деп атайды. Металл кендері табиғатта оксидтер, сульфидтер, хлоридтер, карбонаттар, сульфаттар, фосфаттар түрінде таралған.
Оксид түріндегі кендерге қызыл темір тас Fe 2 O 3 , қоңыр темір тас Fe 2 O 3 ·H 2 O, магнит темір тас Fe 3 O 4 , куприт Cu 2 O, боксит Al 2 O 3 ·2H 2 O, пиролюзит MnO 2 , рутил TiO 2 , класситерит SnO 2 және т. б. жатады.
Сульфид түріндегі кендерге пирит FeS 2 , мыс жылтыры CuS, галенит PbS, аргенит Ag 2 S, киноварь HgS, CuFeS 2 - мыс колчеданы және т. б. жатқызуға болады.
Кейде кеннің құрамында екі немесе одан да көп қажетті металдар кездеседі. Мұндай кендерді полиметалл кендері деп атайды. Мысалы, хромды темір тас FeO·Cr 2 O 3 полиметалл кеніне жатады.
Кеннен металды алу үшін оны бос жыныстардан бөліп байытады.
Металлургия өнеркәсібінде кеннен металл өндірудің мынадай тәсілдерін қолданады: пирометаллургия, гидрометаллургия және электрометаллургия.
Пирометаллургия әдісі бойынша кенді жоғары температурада тотықсыздандару арқылы металл алынады. Егер кен тұз түрінде болса, оны өртеу арқылы тотықтырады, содан кейін көмір, көміртек (ІІ) оксиді немесе сутек арқылы тотықсыздандырады. Мысалы:
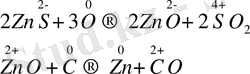
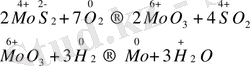
Домна пештерінде темір кендерінен шойын қорытқанда тотықсыздандырғыш ретінде көміртек (ІІ) оксиді қолданылады:
Fe 3 O 4 + 4CO → 3Fe + 4CO 2
Көміртек пен карбид түзетін металдарды оксидтерінен басқа актив металдар арқылы тотықсыздандырады. Бұл әдісті металлотермия деп атайды. Егер тотықсыздандырғыш ретінде алюминий қолданылса, онда бұл әдісті алюминотермия дейді, мысалы:

Гидрометаллургия әдісі бойынша әртүрлі заттармен (KCN, H 2 SO 4 ) әрекеттестіріп кендегі металды ерітіндіге көшіреді де, содан кейін металды басқа актив металмен ығыстыру арқылы немесе электролиз жолымен бөліп алады. Мысалы, мыс (ІІ) оксиді бар кенді күкірт қышқылымен шаю арқылы ондағы мысты ерітіндіге көшіреді:
CuO + H 2 SO 4 → CuSO 4 + H 2 O
Содан кейін сульфаттағы мысты темірмен ығыстыру арқылы бөліп алады:
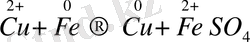
Гидрометаллургия әдісімен күмісті, мырышты, кадмийді, молибденді және уранды алады.
Электрометаллургия әдісі бойынша балқыған хлоридтерінен, оксидтерінен, гидроксидтерінен тұрақты электр тогының жәрдемімен өте актив металдарды (сілтілік, жер-сілтілік), мысалы, алюминийді катодта бөліп алады.
- Металдардың электродтық потенциалдары және олардың кернеу қатары.
Кез келген металл пластинкасын суға немесе өз тұзының ерітіндісіне батырғанда судың полюсті молекулаларының әсерінен металдың беткі жағы ептеп ериді. Осының нәтижесінде электрондар металл пластинкасының бетінде қалып, ал катиондар ерітіндіге көшеді. Бірақ металдың еру процесі көпке бармайды, аздан кейін тепе-теңдік күйге көшеді, яғни белгілі бір уақыт ішінде қанша катион ерітіндіге көшсе, сонша катион қайтадан металл пластинкасына ауысады. Бұл процесті мынадай жалпы теңдеумен көрсетуге болады:
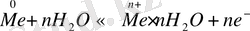
Ерітіндіге көшкен катиондар теріс зарядталған пластинкаға тартылып оған таяу орналасады. Сөйтіп металл пластинкасы теріс зарядталып, ал ерітінді оң зарядталып қос электрлі қабат түзіледі. Осының нәтижесінде металл мен ерітінді арасында түзілген потенциалдар айырмасы электродтық потенциал деп аталады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz