Масса алмасу процестері мен аппараттарының теориясы және негізгі әдістері


Массаның (заттың) бір фазадан екінші фазаға өтуімен сипатталатын масса алмасу деп аталатын процестер химия, тамақ және т. б. өндірістерде жиі кездеседі. Фазалар сұйық, қатты, газ және бу күйлерінде болуы мүмкін. Өндірістерде негізінен төмендегі масса алмасу процестері жиі қолданылады:
Абсорция.
Газдар немесе булар мен газдар қоспаларынан бір немесе бірнеше құрастырушылардың сіңіргіш сұйық пен сіңірілуі абсорция процесі деп аталады. Абсорцияда зат газды фазадан сұйық фазаға өтеді. Газды сұйықтан ажыратып алу, яғни абсорцияға кері процесс десорбция деп аталады.
Айдау және ректификация.
Гомогенді сұйық қоспаларды құрастырушыларының әртүрлі ұшқыштығына және сұйықпен бу фазаларының қарама-қарсы әрекеттеріне байланысты жартылай (жай айдау) немесе толық (ректифиация) ажырату. Мұнда масса сұйық фазадан булы фазаға және керісінше (булы фазадан сұйық фазаға) өтеді.
Экстракция.
Сұйық және қатты заттардың қоспасынан бір немесе бірнеше құрастырушыларды таңдап ерітуші сұйықтар (экстрагенттер) жәрдемімен айырып алу процесі экстракция деп аталады. Сұйық - сұйық және қатты дене - сұйық жүйелерінде экстракциялар болады: біріншісінде масса (зат) бір сұйық фазадан екінші сұйық фазаға, ал екіншісінде - қатты фазадан сұйық фазаға өтеді.
Адсорбция.
Кеуекті қатты заттардың өздерінің бетіне газды, буды немесе ерітіндіден еріген заттарды сіңіріп алу процесі адсорбция деп аталады. Мұнда масса газды, булы немесе сұйық фазалардан қатты фазаға өтеді. Қатты заттардан сіңірілген затты айырып алу, яғни адсорбцияға кері процесс десорбция деп аталады.
Кептіру.
Қатты заттардан ылғалды негізінен булану арқылы шығару процесі кептіру деп аталады. Мұнда масса (ылғал) қатты фазадан газды немесе булы фазаға өтеді.
Кристалдану.
Ерітіндіден немесе балқымадан қатты заттардың кристалл түрінде бөлінуі кристалдану процесі деп аталады. Мұнда масса сұйық фазадан қатты фазаға өтеді.
Мембраналы ажырату.
Кейбір заттарды өткізіп, ал кейбіреуін ұстап қалатын қабілеттілігі бар жартылай өткізгіш мембраналардың жәрдемімен ерітіндідегі ерітілген заттарды ажырату. Мұнда масса (зат) жартылай өткізгіш мембрана арқылы бір сұйық (газды) фазадан екінші сұйық (газды) фазаға өтеді.
Жылу өту процесі сияқты массаөту процесі де өте күрделі. Жылу өту процесінде жылу алмасатын орталар (жылутасымалдағыштар) көбінесе қатты қабырғамен ажыратылған болса, ал массаөту процесі фазалардың бір-бірімен тікелей жанасқан шекарасында болады. Массаөту процесінде масса (зат) бірінші фаза ішінде және фазалардың жанасу беті арқылы өтіп, екінші фаза ішінде де таралады.
Заттың бір фазадан жанасу шекарасына немесе кері бағытта, яғни бір фаза ішіндегі тасымалдануын масса беру деп атайды.
Массаөту процестерін 2 топқа бөлуге болады. Бірінші топ (абсорция, экстракция және т. б. ) ең кемінде үш зат: біреуі-бірінші фаза, екіншісі-екінші фаза, ал үшіншісі -фазалар арасындағы тасымалданатын зат қатысады. Әр фазаны құрайтын заттар тасымалданатын затты тасушы болып, өздері бір фазадан екінші фазаға өтпейді. Мысалы, аммиак пен ауа қоспасынан аммиак сумен сіңірілгенде, ауа мен су тасымалданатын зат - аммиактың тасушысы болады, және оларды инертті газ немесе инертті сұйық деп те атайды.
Екінші топ (мысалы, ректификация) масса өту процесіне екі фазада тікелей қатысады, және олар тасымалданатын заттың инертті тасушысы болмайды.
Тасымалданатын зат әр фаза ішінде диффузия арқылы өтетін болғандықтан масса өту процесін диффузиялық процестер деп те атайды.
Жылу алмасу процестері сияқты (диффузиялық) масса алмасу процесіндегі тасымалданатын зат мөлшері фазалардың жанасу бетіне және процестің қозғаушы күшіне пропорционал болады. Масса алмасу процесінің қозғаушы күші - тасымалданатын заттың берілген концентрациясымен тепе-теңдік концентрациясы (процесс тоқтаған кезге сәйкес келеді) арасындағы айырмаға тең. Сондықтан масса алмасу процесін шегі - жүйенің тепе-теңдік жағдайы болады
.
Фазалар құрамын өрнектеу тәсілдері.
Фазалар құрамы төмендегіше өрнектеледі:
А) көлемдік концентрация-фазаның көлем бірлігіндегі берілген заттың (компоненттің) кг. немесе кмоль саны (кг/м, кмоль/м) ;
Б) мольдік немесе салмақтық үлес-берілген заттың кг немесе кмольнің фазаның барлық массасына (кг, кмоль) қатынасы;
В) салыстырмалы концентрация-тасымалданатын заттың кг. немесе кмоль-нің масса алмасу процесінде өзгермейтін тасушы инертті заттың массасына қатынасы.
Масса алмасу процестерінің тепе-теңдігі олардың өту шегін анықтауға мүмкіндік береді. Тепе-теңдіктің негізі
фазалар ережесімен
анықталады:
Ф + С = К + 2 (7. 1)
мұнда Ф - фазалар саны;
С - еркіндік дәрежесінің саны;
К - жүйені құрастырушылардың саны.
Фазалар ережесі арқылы масса алмасу процестерінің тепе-теңдік жағдайын есептеуде өзгертуге болатын шамалар (параметрлер) санын анықтауға болады. Фазалар ережесін жоғарыда көрсетілген масса алмасу процестерінің екі тобына да қолданады.
Бірінші топ үшін (абсорбция, экстракция және т. б. ) фазалар саны Ф=2, құрастырушылар саны К=3(тасымалдаушы зат және екі тасушы фаза), еркіндік дәрежесінің саны:
С = К + 2 - Ф = 3 + 2 - 2 = 3
тең болады. Бұл жағдайда кез-келген үш шаманы, яғни жалпы қысымын (Р) температурасын (t) және тасымалданатын заттың бір фазадағы концентрациясын (Ха немесе Уа) өзгертуге болады. Демек, берілген температура және қысым мәндерінде бір фазаның кейбір концентрациясына екінші фазаның тиісті нақты концентрациясы сәйкес келеді.
Екінші топ үшін (ректификация) : Ф=2, К=2, онда еркіндік дәрежесінің саны:
С = К + 2 - Ф = 2 + 2 - 2 = 2 тең болады.
Егер масса алмасу процестері тұрақты қысымда өткізілетіні есепке алынса, онда фазаның концентрациясының (Х
а
) өзгеруіне байланысты температура өткізілсе, онда фазаның әртүрлі концентрациясына әртүрлі қысым мәндері сәйкес келеді.
Өзгеретін шамалар (параметрлер) арасындағы байланыстар фазалық диаграммалармен өрнектеледі. Масса алмасу процестерін есептеуде төмендегі диаграммалар пайдаланылады:
А) қысымның концентрацияға байланысы;
Б) температураның концентрацияға байланысы;
В) Фазалардың тепе-теңдік концентрациялары арасындағы байланыс.
Таралушы зат үнемі оның концентрациясынан аз болған фазадан концентрациясы тепе-теңдік концентрациясынан аз болған фазаға қарай өтеді және тепе-теңдіктен қаншалықты көп ауытқыса, соншалықта масса алмасу процесі қарқынды өтеді.
Уақыт бірлігінде заттың таралу бағытына нормаль болған бет бірлігінен өткен таралушы заттың массасы
масса өтудің жылдамдығы
деп аталады
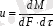 (7. 2)
(7. 2)
Масса өту жылдамдығын заттың меншікті ағыны немесе масса алмасу қарқындылығы деп атайды. Фазаның ішіндегі температура градиентінің әсерінен болатын масса алмасу
термодифффузия
деп аталынады.
Молекулярлық диффузия
Фиктің бірінші заңымен өрнектеледі:
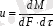
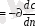 (7. 3)
(7. 3)
Турбуленттік диффузия
төмендегіше анықталады
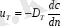 (7. 4)
(7. 4)
Масса беру және конвективті диффузияның негізгі заңын Шукарев анықтаған және ол төмендегіше айтылады: Фазалардың жанасу бетінен сіңіргіш фазаға берілген заттың мөлшері жанасу бетімен ағынның ядросындағы концентрациялар айырмасына, жанасу бетіне және уақытқа тура пропорционал.
Масса беру коэффициентінің физикалық мағынасы:
фазалардың жанасу бетінен фаза ядросына (немесе кері бағытта) уақыт бірлігінде қозғаушы күші бірге тең болғанда,
 м беттен берілетін зат мөлшерін анықтайды.
м беттен берілетін зат мөлшерін анықтайды.
Масса өту коэффициентінің физикалық мағынасы:
масса өтудің қозғаушы күші біргк тең болғанда, фазалардың жанасу бетінің бірлігінен уақыт бірлігінде бір фазадан екінші фазаға өткен заттың мөлшерін көрсетеді. Масса алмасу процестерінң қозғаушы күшінің шамасы фазалардың өзара бағытына және олардың жанасу түріне байланысты болады.
Кептіру.
Материалдан ылғалды буландыру арқылы шығару процесі кептіру деп аталады. Кептіруде материалға жылу беріледі және нәтижесінде ылғал буланады. Кептірілетін материалдарға жылуды беру тәсіліне байланысты кептірудің төмендегі түрлері болады:
Конвективті кептіру
- кептірілген материал мен кептіргіш агенттің (ысытылған ауа, оттық газдар және т. б. ) тікелей жанасуы арқылы;
Контактілі кептіру- жылу тасымалдағыштан кептірілетін материалға жылу қабырға арқылы беріледі;
Радиациялық кептіру
- инфроқызыл сәулелердің жылуы арқылы;
Диэлектрикті кептіру
- жоғары жиілікті электр тоғының жылуы арқылы;
Сублимациялық кептіру
- терең вакуумда тоңазыту күйінде кептіру.
Конвективті кептіруде кептіргіш агент материалға жылу береді және өзімен бірге буланған ылғалды алып кетеді, яғни ол жылу және ылғал тасымалдағыш ролін атқарады. Ылғал газ құрғақ газ және су буы қоспасынан тұрады. Ылғал газ орнына ылған ауаны қабылдап, оның физикалық қасиеттерін қабылдаймыз. Ылғал төмендегі негізгі қасиеттермен сипатталады:
1. Абсолютті ылғалдылық
1 м
3
ылғал ауадағы су буының мөлшерімен анықталады. Техникалық есептеулерде ылғал ауа идеал газ заңына бағынады деп есептеуге болады.
2.
Салыстырмалы ылғалдылық
немесе ауаның қанығу дәрежесі берілген шарттағы 1 м
3
ылғал ауадағы су буыныңмассасының осы көлемде мүмкіндігінше көп бола алатын су буының массасына (қаныққан бу тығыздығына) тең:
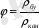 (8. 1)
(8. 1)
3. Ылғал мөлшері 1 кг құрғақ ауаға сәйкес келетін су буының мөлшерін көрсетеді
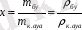 (8. 2)
(8. 2)
Кептірілетін материалдың мөлшері бойынша материалдық баланс кептірудің конвективті, контактілі және басқа түрлеріне бірдей болады.
Кептіруге берілетін материалдың жалпы мөлшері бойынша материалдық баланс:
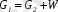 (8. 3)
(8. 3)
Абсолютті құрғақ материалдың мөлшері бойынша материалдық баланс:
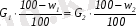 (8. 4)
(8. 4)
Кептіргіштерді есептегенде кептіру жылдамдығын анықтау керек. Материал бетінің бірлігінене буланған ылғал мөлшері кептірудің жылдамдығы деп аталады, яғни
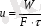 (8. 5)
(8. 5)
Кептіру жылдамдығы масса алмасу процесінің жылдамдығы сияқты масса өтудің негізгі теңдеуінен анықталады:
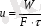
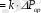 (8. 6)
(8. 6)
Кептіру процесін жылу процесі деп қарастырып, қозғаушы күшті ауаның температурасы мен ылғал термометр температурасы арасындағы айырманы өрнектеуге болады:
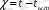
 - шаманы кептірудің потенциалы деп атайды. Орташа қозғаушы күшті былай анықтауға болады:
- шаманы кептірудің потенциалы деп атайды. Орташа қозғаушы күшті былай анықтауға болады:
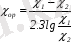 (8. 7)
(8. 7)
Кептіру процесін масса алмасу процесі деп қарастырып қозғаушы күшті ауаның қаныққан ылғал мөлшері және оның ылғал мөлшері арасындағы айырмамен:
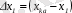 - (кептіргішке кірердегі) және
- (кептіргішке кірердегі) және
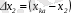 - (кептіргіштен шыққандағы) өрнектеуге болады.
- (кептіргіштен шыққандағы) өрнектеуге болады.
Онда орташа қозғаушы күш:
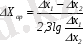 (8. 8)
(8. 8)
Кептірілетін материалдардың қасиеттеріне және оларды кептіру шарттарын сәйкес өндірісте кептіргіштердің көптеген түрлері кездеседі.
Жұмыс істеу принциптеріне байланысты кептіргіштер
- мерзімді
- үздіксіз әрекетті болады;
Жылу тасымалдағыш немесе кептіргіш агентке байланысты:
- ауалы;
- газды;
- булы. Кептіргіштегі қысым шамасына байланысты:
- атмосфералық
- вакуумды;
Кептіргіш агент және материал ағындарының өзара байланысына байланысты:
- бір бағытты ағынды;
- қарама-қарсы ағынды;
- айқасқан ағынды;
Материалдық күйіне байланысты:
- қозғалмайтын;
- қозғалатын;
- жалған сұйылу қабаты.
Жылу беру тәсілдері бойынша кептіргіштер үш түрге бөлінеді:
- контактілі;
- конвективті;
- ауалы және газды;
- арнаулы кептіргіштер.
Масса алмасу аппараттары
1. Жалпы мәліметтер және
4. Сырттай энергия берілудегі аппараттар ;
5. Кристаллдағыштар.
1. Жүру барысы бір фазадан екінші фазаға заттың берілу жылдамдығыменен анықталатын технологиялық процесті атқаруға арналған аппараттарды топтастырылуы;
2. Фазалы әрекеттердің бекітілген бетіндегі аппараттар;
3. Ағындардың қозғалуы процесіндегі калыптасатын әрекеттесу бетті аппараттар;
массаалмастыру аппараттары деп атайды. Бұл аппараттардың реакциялық аппараттардан ерекшелігі, мұнда реакция өнімі реакцияланған түс реакцияға түспеген бөліктерге бөлінеді.
Массаалмасу аппараттарда келесі массаалмасу процестері атқарылады: абсорбция, адсорбция, экстракция, ректификация және кристаллдану.
Бұл процесстерді басым жағдайда бағаналы типтегі аппараттарда атқарады. Бұл аппараттар өздігінде биіктігінің диаметріне қатынасы елеулі сипаттағы (L/D>10) цилиндрлік ыдыс болып табылады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz