Ерітінділердің термодинамикасы мен тепе-теңдігі: активтілік, қышқыл-негіз теориялары және гидролиз


... жалғасыАктивтену энергиясы. Массалар әрекеттесу заңының қолданылу шектері.
Конкуренттік реакцияның өту тереңдігін сипаттайтын шаманы
- коэффициент не мольдік үлес деп атайды:
А = [A] /C A .
- коэффициентінің өлшемі 0-ден 1-ге дейін өзгереді. Әрекеттесуші бөлшектердің активтіктері арқылы сипатталатын тепе-теңдік константасы
K 0 =
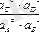
термодинамикалық константа деп аталады.
А ктивтілік дегеніміз - берілген реалды ерітіндінің термодинамикалық қасиетіне сәйкес қасиетке ие идеал ерітіндінің компонентінің концентрациясы. Оның өлшем бірлігі [моль/л] .
Бұл теңдеуді аА+bB=cC+dD реакциясына қойып, түрлендіру жүргізгеннен кейін мынаны аламыз:
K 0 =
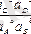
Бұл қатынас МӘЗ-ның берілуі болып табылады.
Активтілік коэффициенті деп бөлшектің активтілігінің оның концентрациясына қатынасын айтады: f A = a A / [A] .
Электролит ерітіндідегі иондардың активтілік коэффициенті жүйенің электростатикалық әрекеттесуінің өлшемі қызметін атқарады. Олар I шамасына, яғни иондық күшіне тәуелді. Ол былай есептеледі: I=
, мұндағы Zi - Ai ионының заряды,
- ерітіндіде кездесетін барлық иондардың қосындысы.
Жеке иондардың активтілік коэффициентін Дебай-Хюккельдің жуықталған формулалары арқылы табуға болады.
lg f i = - AZi 2
( I
0, 1М), lg f i =
( I = 0. 01 - 0. 1)
1923 жылы Бренстед пен Лоури қышқылдар мен негіздердің протолиттік теориясын ұсынды. Осы теорияға сәйкес қышқыл дегеніміз протонды беріп жіберетін, ал негіз дегеніміз протонды, қосып алатын заттар.
Льюис теориысы бойынша қышқыл-негіздік әрекеттесулерге комплекстүзілу реакцияларын жатқызуға болады, өйткені олар да донорлы-акцепторлы байланысқа негізделген.
1939 жылы Усанович барлық қышқыл мен негіздің жалпы теориясын ұсынды. Қышқылдар - катиондарды беріп жіберуге және аниондар мен электрондарды қосвп алуға қабілетті заттар. Негіздер -аниондар мен электрондарын беріп жіберетін және катиондарды қосып алатын заттар. Кемшілігі: қышқылдар мен негіздерге кез-келген химиялық затты жатқызады, және кез-келген химиялық реакцияқышқыл мен негіз арасындағы реакция болып табылуы. Онда тотығу-тотықсыздану реакциясын да қышқыл-негіздік әрекеттесуге жатқызу керек болып табылар еді:
2Fe 3+ + Sn 2+ « 2Fe 2+ + Sn 4+ .
қышқыл негіз қышқыл негіз
Ал протолиттік теорияның мұндай кемшілігі жоқ. Протолиттік теория тек қана сулы ерітінділер үшін ғана емес, сонымен қоса газтектес заттар үшін де қолданылады.
Күшті қышқыл диссоциациясы: HA + SH « SH 2 + + A - ,
(1)
Әлсіз қышқыл диссоциациясын жазайық: НА + Н 2 О « Н 3 О + + А - не НА « Н + + А - ;
(2)
(3)
Күшті негіз диссоциациясын жазайық: В +Н 2 О « ВН + + ОН -
,
.
Әлсіз негіз:
.
Буферлі ерітінділер. Буферлі ерітінді әлсіз қышқыл НА мен оның аттас иондас тұздары немесе әлсіз негіз В бен оның аттас иондас тұзының жұптарынан тұрады. Ол рН мәнін тұрақты ұстап тұру үшін қолданады. Әлсіз қышқыл НА мен ілеспелі негіз қоспасын МА алайық:
НА + Н 2 О « Н 3 О + + А -
Н 2 О + Н 2 О « Н 3 О + + ОН -
МА « М + + А -
НА - әлсіз қыщқыл болғандықтан, онда
; МА толық ,
. Сонда:
,
,
бұдан
.
Әлсіз негіз бен ілеспелі қышқылдың қоспасын (В+В×НА) :
В + Н 2 О « ВН + + ОН - ,
бұдан
,
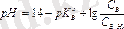
Гидролиз. Еріген заттың сумен алмасу реакциясына түсіп, яғни диссосацияланған иондардың Н + немесе ОН - иондарымен әрекеттесуін гидролиз деп атайды.
1. Егер тұз диссосацияланғанда аз полюстенетін катиондар және аниондар түзетін болса, ортаның рН-ы өзгермейді, гидролиз іс жүзінде жүрмейді:
2. Егер тұз күшті қышқыл мен әлсіз негізден түзілген болса, онда оның гидролизі сутек иондарының түзілуіне алып келеді, яғни ерітіндінің қышқылдығы артады, рН-тың мәні кемиді:
3. Егер тұз күшті негіз бен әлсіз қышқылдан түзілген болса, онда оның гидролизі гидроксид иондарының түзілуіне алып келеді, бұл ерітіндінің рН мәнін арттырады:
4. Әлсіз негіз бен әлсіз қышқылдан түзілген тұздардың гидролизі толық жүреді.
Мөлшерлік жағынан гидролиз тұздардың гидролиздену дәнежесімен (һ) сипатталады: һ=(c г /c 0 ) *100%
Гидролиздену дәрежесі мен констансасы арасында төмендегі өрнекте көрсетілген қатынас бар: Һ=ÖК г . Реалды ерітінділерде ерігіштік көбейтіндісінің ерітіндінің иондық қүшіне тәуелділігін мына теңдеумен көрсетеміз:
∆nZ 2 A[-0, 2J+J 0, 5 /(1+J 0, 5 ) ], мұндағы ∆nZ 2 =mZ 2 +aZ 2
Нашар еритін қосылыстың ерігіштік көбейтіндісі оның ерігіштігімен қарапайым арақатынаспен байланысқан. Егер қанақ ерітіндіде MmAa қосылыстың ерігіштігі s моль/л болса, онда осы ерітіндідегі иондар концентрациясы [М] =mS және [А] =aS тең. Жоғарыдағы теңдеуге осы мәндерін қойып алатынымыз:
ЕК=[mS] m [aS] a =m m a a S m+a немесе S =
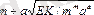
Ерітінді идеал деп аталады, егер ондағы кез-келген А және В бөлшектерінің сонымен қоса еріткіш молекулаларының әрекеттесу энергиясы Е тең және бөлшектің табиғатына тәуелсіз болса: Е АА = Е ВВ = Е АВ .
Реалдық жүйеге әсер ететін факторлар екі негізгі топқа бөлінеді: электростатикалық және химиялық әрекеттесу. Бұл екеуінің арасындағы шек шартты түрде қабылданады. Мысалы, еріген заттың еріткіш молекулаларымен әрекеттесуінің нәтижесінде пайда болатын сольватациялық эффектінің табиғаты әдетте жартылай электростатикалық, жартылай химиялық болып келеді.
1. Электростатикалық әрекеттесу. Бұған ( әрекеттесу энергиясының төмендеуі бойынша) : иондар арасындағы кулондық әрекеттесулер, полярлы молекулалардың қатысуымен ион-дипольдік және диполь-дипольді әрекеттесулер, ерітіндіде кездесетін кез-келген бөлшектің ван-дер-вальстік әрекеттесулері жатады.
Электростатикалық әрекеттесу энергиясы әрекеттесуші бөлшектердің табиғатына тәуелді екені белгілі: Е АА
Е ВВ

Е АВ . Ескерте кетейік, идеал ерітінділер үшін Е АА = Е ВВ = Е АВ 1 . Міне, осылай электростатикалық әрекеттесулер ерітіндінің идеалды ерітінді қасиеттерінен ауытқуларына әкеледі
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz