Титриметриялық анализ: принциптері, жіктелуі және есептеу негіздері


ҚАЗАҚСТАН РЕСПУБЛИКАСЫНЫҢ БІЛІМ ЖӘНЕ
ҒЫЛЫМ МИНИСТРЛІГІ
М. Әуезов атындағы Оңтүстік Қазақстан мемлекеттік университеті
СРС
Кафедра: «Агротехнология»Тақырыбы: «Титриметриялық анализ »
Орындаған: Әнетбекова Ақбаян
Тобы: АП-16-2К
Қабылдаған: Седенова Ақнұр
Шымкент 2017
Титриметриялық анализ
Титриметриялық анализдің мәні
Титриметриялық әдіс анықтайтын затпен реакцияласуға жұмсалатын реактивтің мөлшерін дәл өлшеуге негізделген.
Жиі реактивтің мөлшерін табу үшін концентрациясы белгілі ерітіндінің әрекеттесуге кеткен көлемін анықтайды, сондықтан бұл әдіс көлемдік анализ деп те аталады.
Аналитикалық химияда титр (Т) ерітіндінің концентрациясын белгілеудің бір жолы. Титр - 1 мл ерітіндідегі еріген заттың грамм не миллиграмм мөлшері. Титрі анық белгілі ерітіндіні титрленген, не стандартты ерітінді дейді. Титрлеу деп стандартты ерітіндіні анализдейтін ерітіндіге ептеп эквивалентті нүктеге жеткенше қосу процесін айтады. Эквивалентті нүкте қосылған титранттың анықтайтын затқа химиялық эквивалентті мәні. Химиялық элементтер, не олардың қосылыстары бір-бірімен олардың химиялық эквиваленттеріне сәйкес белгілі массалық мөлшерде әрекеттеседі. Басқа сөзбен айтқанда бір заттың мольэквиваленті (мэкв) екінші заттың сонша мольэквивалентімен реакцияласады. Титрлейтін ерітіндіні жиі жұмыс ерітіндісі, не титрант деп атайды.
Титриметриялық әдісте кез-келген химиялық реакциялар пайдалана берілмейді. Титриметрияда пайдаланылатын реакциялар белгілі шарттарға жауап берулері керек:
1) Реакция аяғына шейін жүруі керек. Анализдің нәтижесі дұрыс болу үшін титранттың эквивалентті мөлшері қосылғанда реакцияның толық жүру мәні 99, 9%-тен кем болмау керек.
2) Реакция үлкен жылдамдықпен жүруі керек.
3) Ерітіндіде титрант тек анықтайтын затпен белгілі стехиометриялық қатынаста реакцияласуы қажет.
4) Реакцияның аяқталғанын, яғни эквивалентті нүктені анықтайтын мүмкіншілік болу керек. Егер бұл нүкте тәжрибеде индикатордың түсінің өзгеруіне, не ерітіндінің электрохимиялық не физикалық қасиетінің өзгеруіне сүйеніп табылса, оны титрлеудің соңғы нүктесі (т. с. н. ) деп атайды. Титранттың теориялық жолмен есептелген мөлшері құйылған нүктені титрлеудің эквивалентті нүктесі (т. э. н. ) дейді. Идеалды жағдайда титрлеудің соңғы нүктесі мен эквивалентті нүкте бір-біріне сәйкес келеді, бірақ әртүрлі себептерге байланысты (мысалы, индикатордың бояуының титранттың сәл артық мөлшерін құйғанда ғана өзгеруі т. б. ) бұл нүктелердің арасында азырақ айырмашылық болуы мүмкін.
Титриметриялық анализ әдістерінің классификациясы (жіктелуі)
Титриметриялық анализ әдістерін анализде пайдаланылатын химиялық реакциялардың түріне қарай бөледі. Бұл реакциялар: протондар алмасатын, электрондар алмасатын, аз диссоциацияланатын (комплекстік) бөлшектер түзетін және нашар еритін қосылыстар түзетін реакциялар. Осыған байланысты титриметриялық анықтауды мынадай әдістерге бөлуге болады:
1. қышқыл-негіздік титрлеу (протолитометрия) ;
2. тотығу-тотықсыздану титрлеуі (редоксиметрия) ;
3. комплексометриялық титрлеу (комплексометрия) ;
4. тұнба алып титрлеу (седиметрия) .
Титриметриялық әдістерді титрлеу жолына қарап та бөледі;
1. тікелей титрлеу әдісі - анықтайтын зат концентрациясы белгілі ерітіндімен титрленеді;
2. ауыстыру (жанама) әдісі - бұл әдіс анықтайтын зат пайдаланатын реагентпен әрекеттеспейтін, не реакция стехиометриялық жолмен жүрмейтін жағдайда пайдаланылады. Мысалы, кальций иондарын перманганатометрия әдісімен анықтау. Кальций иондарын қымыздық қышқылы аниондарымен тұнбаға түсіреді:
Ca 2+ +C 2 O 4 2- →CaC 2 O 4 ↓
Жуылған тұнбаны күкірт қышқылында ерітеді:
CaC 2 O 4 ↓+2H 3 O + →H 2 C 2 O 4 +Ca 2+ +2H 2 O
Пайда болған қымыздық қышқылын калий перманганаты ерітіндісімен титрлейді:
5H 2 C 2 O 4 +2MnO 4 - +6H 3 O + 10CO 2 +2Mn 2+ +14H 2 O
3. кері титрлеу әдісі - анализдейтін ерітіндіге артық мөлшерде алынған титранттың белгілі көлемін құяды, яғни анықтайтын компонентпен реакция толық жүргеннен кейін ерітіндіде титранттың бос мөлшері қалады. Реакцияласпай қалған титранттың мөлшерін концентрациясы белгілі басқа ерітіндімен титрлейді. Алғашқы қосылған титранттың көлемі мен оның реакцияласпай артық қалған көлемінің арасындағы айырмашылық титранттың анықтайтын затпен әрекеттесуге кеткен көлемін көрсетеді.
Титриметриялық анализ нәтижелерін есептеу
1. Ерітінділердің концентрациясын белгілеу.
Молярлы концентрация, С М әрпімен белгіленеді, 1 дм 3 (л) ерітіндідегі еріген заттың моль санын n A , не 1 см 3 (мл) ерітіндідегі еріген заттың миллимоль санын көрсетеді. Заттың бір молі оның граммен не миллиграммен алынған молярлы массасы М(X) : n(моль) =m(г) /М(X) г/моль; n(ммоль) = m(мг) / М(X) г/ммоль. Ерітіндідегі еріген заттың массасын (m) табу үшін оның моль санын бір мольдің массасына (молярлық масса) көбейту керек. Мысалы, концентрациясы 0, 2 M күкірт қышқылының ерітіндісінде C H2SO4 =0, 2 M=0, 2 моль/л; M(H 2 SO 4 ) =98, 08 г/моль;
m(H 2 SO 4 ) =0, 2 моль/л . 98, 08 г/моль=19, 6 г/л, яғни 19, 6 г H 2 SO 4 бір литр ерітіндіде еріп жүр. Жалпы түрде m(X) =С . M(X) .
Эквиваленттің молярлы концентрациясы С( f э , Х) әрпімен белгіленеді, 1 дм 3 (л) ерітіндідегі еріген заттың мольэквивалент санын n Э , не 1 см 3 (мл) ерітіндідегі еріген заттың миллимольэквивалент санын көрсетеді. Мысалы,
H 2 SO 4 +2NaOH=Na 2 SO 4 +2H 2 O,
не 1/2H 2 SO 4 +NaOH=1/2Na 2 SO 4 +H 2 O
мольэквивалент H 2 SO 4 =1/2 моль H 2 SO 4
1/2 - эквиваленттік фактор деп аталады - f экв . Қышқылды-негіздік реакцияларда f экв әрекеттесуге қатысқан сутек иондарының санымен, ал тотығу-тотықсыздану реакцияларында тотығу, не тотықсыздану реакциясына қатысқан электрондар санымен анықталады.
f экв мәні жүретін реакцияның теңдігіне байланысты 1сутегі ионына не 1 электронға сәйкес (эквивалентті) заттың (ион, молекула т. б. ) үлесін көрсетеді:
H 3 PO 4 +NaOH=NaH 2 PO 4 +H 2 O f экв (H 3 PO 4 ) =1
H 3 PO 4 +2NaOH=Na 2 HPO 4 +2H 2 O f экв (H 3 PO 4 ) =½
H 3 PO 4 +3NaOH=Na 3 PO 4 +3H 2 O f экв (H 3 PO 4 ) =1/3
не KMnO 4 +5FeCl 2 +8HCl=MnCl 2 +5FeCl 3 +4H 2 O+KCl
MnO 4 - +8H + +5e→Mn 2+ +4H 2 O f экв (KMnO 4 ) =1/5
Fe 2+ -1e→Fe 3+ f экв (Fe) =1
С( f э , Х) концентрациясы арқылы берілген ерітіндідегі еріген заттың массасын табу үшін оның мольэквивалент санын бір мольэквиваленттің массасына n(М э ) көбейту керек. Бір мольэквиваленттің массасы молярлық масса мен эквиваленттік фактордың көбейтіндісіне тең:
Мысалы, мольэквивалент H 2 SO 4 -M(1/2 H 2 SO 4 ) =f экв (H 2 SO 4 ) . M(H 2 SO 4 ) =1/2 . 98, 08=49, 04 г/моль.
Мольэквивалент KMnO 4 -M(1/5 KMnO 4 ) =f экв (KMnO 4 ) . M(KMnO 4 ) =1/5 . 158, 0=31, 6 г/моль.
С(1/2H 2 SO 4 ) =0, 1М=0, 1 . f экв моль/л, m(H 2 SO 4 ) = 0, 1f экв (H 2 SO 4 ) M(H 2 SO 4 ) = 0, 1 моль/л
. 98, 08 г/моль = 4, 904 г/л
C(
KMnO 4 ) =0, 5М,
m(KMnO 4 ) =0, 5 . M(
KMnO 4 ) =0, 5 . f экв (KMnO 4 ) ;
m(KMnO 4 ) =0, 5 моль/л . 31, 16 г/моль=15, 8 г/л.
Жалпы түрде m(X) =С н . f экв . M(X) .
Ерітіндінің титрі, Т әрпімен белгіленеді, ол - 1 мл ерітіндідегі еріген заттың грамм, не миллиграмм мөлшері.
Егер ерітіндінің молярлы, не нормальды концентрациялары белгілі болса бұл ерітіндінің титрін былай табуға болады:
; не
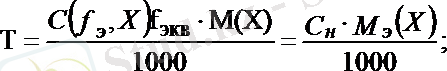
Керісінше ерітіндінің титрі белгілі болса, оның молярлы не нормальды концентрациясы жеңіл табылады:
;
;
Мысалы, 250 мл ерітіндіде 24, 52 г H 2 SO 4 еріп жүр. Осы ерітіндінің Т, С М және С н (f экв = 1/2) неге тең деген сұраққа былай жауап беруге болады:
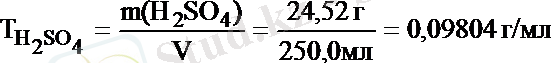
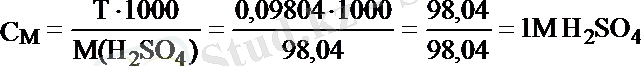
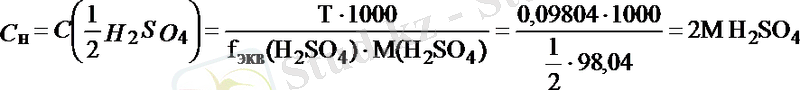
Жұмысшы ерітіндінің анықтайтын зат арқылы титрі - T Ж/А , бұл анықтайтын заттың 1 мл жұмысшы ерітіндімен әрекеттесетін грамм мөлшері.
Мысалы, T H2SO4/CaO =0, 004679 г/мл, 1 мл күкірт қышқылы 0, 004678 г CaO-мен әрекеттеседі. Ерітіндінің эквивалентінің молярлы концентрациясы белгілі болса, оның анықтайтын зат арқылы титрін табу қиын емес:
;
.
Ерітіндінің концентрациясын анықтайтын зат арқылы титрмен белгілеудің тиімділігі - анализдің нәтижесін есептеу жеңілденеді: m А =V Ж . Т Ж/А . Мысалы, темір анықталатын ерітіндіні титрлеуге 20, 00 мл Т KMnO4/Fe =0, 005850 г/мл KMnO 4 ерітіндісі жұмсалады. Егер 1 мл KMnO 4 ерітіндісі 0, 005850 г темірмен әрекеттесетін болса, онда 20, 00 мл KMnO 4 20, 00 мл . 0, 005850 г/мл грамм темірмен әрекеттеседі:
m Fe = T KMnO4/ Fe . V KMnO4 = 0, 005850 г/мл . 20, 00 мл = 0, 1170 г.
Ерітіндінің проценттік концентрациясы (С %) 100 г ерітіндідегі еріген заттың грамм мөлшерімен белгіленеді. Мысалы, 3 % NaCl ерітіндісі десе, ол 100 г ерітіндіде 3 г NaCl және 97 г су барын көрсетеді.
Процентті концентрациядан молярлы не эквиваленттің молярлы концентрациясына ауысу үшін ерітіндінің тығыздығын еске алу керек. Ерітіндінің массасы (Р), оның тығыздығы (r) және көлемінің (V) арасындағы байланыс P = V . r, не V =
.
Мысалы, тығыздығы 1, 14 г/мл 20, 0 % күкірт қышқылының молярлы және эквивалентінің молярлы концентрацияларын табайық: f экв (H 2 SO 4 ) = 1/2. Алдымен 100 г 20, 0 % ерітіндінің алатын көлемін табамыз: V=
= 87, 7 мл. 20, 0 % ерітіндінің 100 г не 87, 7 мл мөлшерінде 20, 0 г H 2 SO 4 бар. Содан кейін бұл ерітіндінің титрін, молярлығын және эквиваленттің молярлы концентрациясын табамыз:
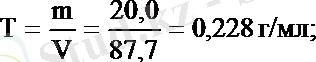
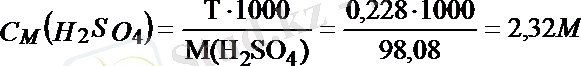
.
Жалпы түрде:
;
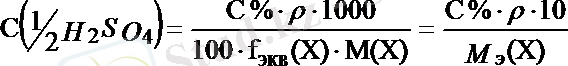
Стандартты (титрленген) ерітінділерді дайындаудың бірнеше жолы бар:
1. Алғашқы стандартты заттың дәл массасын аналитикалық таразыда өлшеп, оны өлшеуіш колбада еріту (стандарттық заттар, не фиксаналдар әдісі) . Еріген заттың массасы (m) мен алынған ерітіндінің көлемі белгілі болса (V), бұл ерітіндінің титрін табу қиын емес: T = m/V.
Дәл массасын өлшеуге мынадай шарттарға жауап беретін заттар пайдаланылады:
а) Зат химиялық таза болуы керек, бөгде қоспалардың мөлшері 0, 05-0, 1 %- тен аспауы керек.
б) Заттың құрамы белгілі химиялық формулаға сәйкес болуы керек.
в) Қатты және ерітінді түріндегі заттың құрамы ауада сақтағанда тұрақты болуы керек.
г) Өлшеу қатесінің мәнін азайту үшін алған заттың молекулалық массасы үлкен болғаны қажет.
Тәжрибеде стандартты ерітінділер дайындауға жиі фиксаналдар пайдаланылады. Фиксанал - дәнекерленген шыны ампулаға салынған, 1 л белгілі концентрациялы (С( f экв , Х) =0, 1М ерітінді дайындауға сәйкес, дәл өлшенген зат. Фиксаналды пайдаланып ерітінді дайындау үшін ампуланың ішіндегі затты толығымен 1 л өлшем колбасында ерітеді.
2. Егер зат жоғарыда келтірілген шарттарға жауап бермесе, онда концентрациясы жуық мәнмен белгілі ерітінді дайындалады да, оның дәл концентрациясы басқа стандартты ерітіндіні пайдаланып анықталады.
Ерітіндінің концентрациясын анықтағанда да және анализ жүргізгенде де титрлеудің келесідей екі жолын пайдалануға болады:
1. Алғашқы стандартты не анализдейтін заттың нақты мөлшерін өлшем колбасында ерітеді, белгіге шейін сумен толтырып ерітіндіні дұрыстап араластырады. Ол үшін тығынмен жабылған колбаны бірнеше рет аударады. Осы ерітіндінің пипеткамен аликвотты мөлшерін алып, оны титрлейді.
2. Алғашқы стандартты (не анализдейтін) заттың массасы бір-біріне жуық жеке нақты мөлшерлерін алады, әрқайсысын суда ерітіп, алынған ерітінділерді титрлейді. Бұл әдіс жеке нақты мөлшерлер әдісі деп аталады.
Титриметриялық анализдегі есептеулердің негізі эквиваленттер заңдылығына сүйенген. Реакцияласатын заттардың эквиалентті мөлшерлері бір-біріне тең (n Э1 = n Э2 ) . Осыдан эквиваленттің молярлы концентрациясына ауыссақ химиялық анализдің негізгі есептеу теңдіктерін аламыз. Эквиваленттің молярлы концентрацияның анықтамасы бойынша ол 1 л ерітіндідегі еріген заттың мольэквивалент (мэкв), не 1 мл ерітіндідегі - миллимольэквивалент (ммэкв) мөлшері. Сондықтан, көлемнің осы концентрацияға көбейтіндісі (С 1 ( f э ) . V 1 ) осы көлемдегі заттың реакцияға қатысатын ммэкв мөлшерін көрсетеді. Екінші заттың да осындай ммэкв мөлшері реакцияға қатысады (С 2 ( f э ) . V 2 ), яғни С 1 ( f э ) . V 1 = С 2 ( f э ) . V 2 немесе
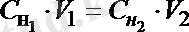
Мысалдар:
1. 25, 00 мл тұз қышқылын титрлеуге 32, 20 мл 0, 0950 М натрий гидроксидінің ерітіндісі жұмсалады. Тұз қышқылы эквивалентінің молярлы концентрациясы неге тең?
С HCl . V HCl = С NaOH . V NaOH
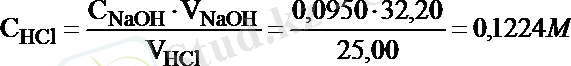
2. 1 л 0, 1 М тұз қышқылының ерітіндісін дайындау үшін оның 12, 10 М ерітіндісінің қандай көлемін алу керек?
С΄ HCl . V΄ HCl = С΄΄ HCl . V΄΄ HCl
мл
3. 250 мл өлшемдік колбадағы барий гидроксидінің ерітіндісінен титрлеуге оның 20, 0 мл алынды, онымен реакцияласуға 22, 40 мл 0, 09884 М HCl ерітіндісі жұмсалды. Барий гидроксидінің мөлшерін (m) табу керек.
Ba(OH) 2 + 2HCl = BaCl 2 + 2H 2 O, f экв (Ba(OH) 2 = 1/2
С(1/2Ba(OH) 2 ) . V Ba(OH) 2 = С HCl .
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz