Электрохимия: электродтық процестер, электролиз және гальваникалық элементтердің негіздері


«ЭЛЕКТРОХИМИЯ» ПӘНІНЕН
ЛЕКЦИЯЛАР КУРСЫ
КУРС ЛЕКЦИЙ ПО ДИСЦИПЛИНЕ
«ЭЛЕКТРОХИМИЯ»
Электрохимия
Қазіргі кезде өнеркәсіптің көптеген салаларында маңызды технологиялық операцияларды электрохимиялық әдістерді қолдану арқылы жүргізеді. Электрохимиялық әдісті басқа шикізат өңдеу әдістерімен: термохимиялық, феррометаллургиялық айырмашылығы мұнда заттардың қасиеттерінің өзгеруі электр тогының әсерінен жүзеге асырылады.
Түсті металлургияда көптеген металды сулы ерітінділердің электролиттерімен немесе балқыған тұздардан электролиздеу арқылы алады.
Электролиттік жолмен мыс, никель, мырыш, кадмии, асыл металдар және басқаларын алады және тазалайды. Балқыған тұздардың электролизі мен алюминии, магнии және т. б. металдарды алуға болады. Бұл металдарды алу технологиясы электрохимиялық процестерге негізделген.
Электрохимия пәні электрод -электролит фазалардың шекарасында жүретін процестердің термодинамикалық және кинетикалық заңдылықтардың және электролиздің жүру заңдары туралы терең теориялық мәлімет береді. Электрохимияны түсіну үшін электродтық процестер мен электрохимиялық реакция деген ұғымдарды айыра білу қажет.
Электрохимиялық реакция - реакцияға қатысатын заттың иондарының (атомдар мен молекулаларының) арасындағы қатынасты анықтайды.
Электродтық процесс ерітінді (балқыма) және электрод -электролит фазаларының шекарасы арқылы электр тогы өткен кездегі электрохимиялық, химиялық, адсорбциялық және диффузиялық процестердің толық жиынтығы. Электролитті құрайтын компоненттердің (толық жиынтығы) электрохимиялық реакциялар нәтижесінде қатынасқа түсетін заттардың электрон алу және электрон беру арқылы жүретін электродтағы тотығу-тотықсыздану процестерін электролиз деп атайды. Электролизді жүргізу үшін электрохимиялық жүйе қажет:
1) Реакцияға түсетін заттар иондарға ыдырайтын екінші текті электрод- ерітінді балқыма немесе қатты электролиттен
2) Электролитке батырылған бірінші текті екі электродтан үшінші электродтарды бір-бірімен және сыртқы ток көзіне жалғайтын электродтық өткізгіштен тұрады.
Егер бұл ұяшықтағы химиялық реакция сыртқы ток көзіне электр тогын бөле жүретін болса, онда ұяшық электр энергиясының химиялық көзі немесе гальваникалық элемент деп аталады. Ал егер химиялық процесс сыртқы электр тогының әсері арқылы өтсе, онда ұяшық электролиттік ванна немесе электролиттер деп аталады. Гальваникалық элементтер сыртқы ток көзіне электрон беретін электрод теріс полюсті, ал электрон қосып алатын электрод оң полюсті болады. Теріс полюсті электродта барлық уақытта тотығу реакциясы жүреді. Ал оң полюсінде тек қана тотықсыздану реакциясы реакциясы жүреді. Электролизде тотықсыздану процесі жүретін электрод катод деп аталады. Тотығу процесі жүретін электрод анод деп аталады.
Фарадей заңдары
Электрод-электролит шекарасы арқылы электр тогы өткен кезде электрондық өткізгіштік иондық өткізгіштікке ауысатындықтан осы шекарада электрохимиялық реакция жүреді. Сондықтан осы фазалар шекарасы арқылы өткен электр тогы мен осы жерде химиялық өзгерістер жүрген заттардың арасында белгілі сандық байланыс болады. Бұл сандық байланыс Фарадей заңдарымен көрсетіледі.
Фарадейдің бірінші заңы : электродтағы реакцияға түскен заттардың мөлшері осы жүйе арқылы өткен ток күшіне және токтың өту уақытына тура пропорционалды.
g= k·q (1. 1)
мұндағы g- электродта реакция түскен заттың мөлшері
q-электролит арқылы өткен электр тогының мөлшері
I- ток күші
к- пропорционалдық коэфицент
Екінші заң. Әртүрлі электролитті бірдей ток мөлшерімен ыдыратқан кезде электродта түзілген электрохимиялық реакциялар өнімдерінің құрамы немесе мөлшері олардың химиялық эквиваленттеріне пропорционалды. Бұл жағдайда барлық заттар үшін заттың массасының олардың химиялық эквивалеттеріне қатынасы бірдей болады:
g 1 /Э 1 = g 2 /Э 2 = g 3 /Э 3 = G i/ Э i (1. 2)
мұндағы Э- заттың химиялық эквиваленті
Фарадей заңдары табиғаттағы ең дұрыс заң. Ғалымдар Фарадей заңдарын жалғастыра келе электр тогы заттар атомдардан тұратын сияқты ұсақ бөлшектер электрондардан тұратынын дәлелдеген. Фарадейдің екінші заңына сәйкес кез-келген заттың 1г эквиваленті бөлінуі немесе ыдырауына қажетті электр тогының мөлшері ол заттың жаратылысына, ток мөлшеріне, электрод пен ваннаның формасына, жасалған материалына тәуелді емес . Бұл санды Фарадей саны деп атайды. F= 96500Кл яғни электродта кез-келген заттың 1г эквиваленті бөліну үшін 96500Кл электр тогы қажет .
1F=96500Kл=26, 8А сағ .
Фарадейдің бірінші және екінші заңдарын біріктіре отырып келесі теңдеуді аламыз:
g = aIt/zF (1. 3)
мұндағы a-электродта реакцияға түскен заттың грамм атомы
z- электродтық процеске қатысатын электрондар саны.
1. 1 және 1. 3 формулаларды салыстырып келесі теңдеуді аламыз:
K = a/ zF (1. 4)
мұндағы k-заттың электрохимиялық эквиваленті, г/Кл; г/А·сағ
Электрохимиялық эквивалент деп бірлік электр тогының мөлшерін өткізген кезде электродта бөлінетін заттың мөлшерін атайды.
Практика жүзінде Фарадей заңдарынан ауытқулар байқалады, бұл ауытқулар қосымша қажетсіз процестердің нәтижесінде жүреді. Сондықтан оларды болуы мүмкін ауытқулар деп атайды. Бұл ауытқулардың келесі себептері бар:
1. Электролиз өнімдерінің механикалық жоғалымдары
2. Электродтың өзіндік еруі
3. Электролиз өнімі құрамының тұрақсыздығы және т. б
Фарадей заңынан ауытқулар электролиз кезінде ток бойынша шығымға әсер етеді. Яғни алынған заттың нақты мөлшері Фарадей заңы бойынша алынуға тиісті мөлшерден кем болады. Ток бойынша шығым токтың қаншалықты пайдалы қолданылғанын сипаттайды.
Вт = g пр / g теор (1. 5)
мұндағы g прак -электр тогының белгілі мөлшері өткен кездегі алынған негізгі өнімнің грамм саны
g теор - осы ток мөлшерін өткізген кезде негізгі өнімнің Фарадей заңы бойынша бөлінуге тиісті грамм саны
Ток бойынша шығымды келесі қатнаспен көрсетуге болады:
Вт = q теор / q пр (1. 6)
мұндағы q теор -Фарадей заңы бойынша осы процесті жүргізуге қажетті электр тогының мөлшері
q прак - осы мөлшердегі затты бөліп алуға жұмсалған электр тогының нақты мөлшері
Ток бойынша шығым әрқашанда 100-ге тең немесе кіші (A<100%)
Ток бойынша шығым анодтық және катодтық болып бөлінеді. Және өзара тең емес. Электродтық процестерге негізінен анодтық және катодтық ток тығыздықтары әсер етеді. (ia, ik) олар А/см 2 , А/дм 2 , А/м 2 өлшенеді. Бұл мән электрохимиялық процестің жылдамдығы, ток бойынша шығым және злектролизге жұмсалған электр энергиясының меншікті шығынына да әсер етеді. Электролиз кезінде процесс барынша жылдам жүріп, ал электр энергиясының меншікті төмен болуы маңызды болып саналады.
Электр энергиясының меншікті шығыны келесі теңдеуде:
Яғни электр энергиясының меншікті шығыны электролиздің екі есе көрсеткіші ваннадағы ток кернеуімен ток бойынша шығымға тәуелді. Ток бойынша шығымның үлкен ауытқулары балқыған тұздардың электролизінде байқалады. Мұнда ток бойынша шығым (А) жоғары температураға, диффузия жылдамдығына, ток тығыздығына, электролиттегі қоспаларға, электродтардың арақашықтығына және басқа факторларға тәуелді болады.
Гальваникалық элементтің термодинамикасы.
Электрохимиялық процестер жүру механизмі бойынша химиялық процестерден айырмашылығы бар. Мұнда тотығу-тотықсыздану процестері жазықтықта бөлінген екі ұяшықта жүреді. Электрохимиялық процестер жүретін электрохимиялық ұяшықтарды екі түрге бөлеміз:
1. Гальваникалық элемент - электр энергиясының электрохимиялық көзі
2. Электролиздер (электролиттік ванна)
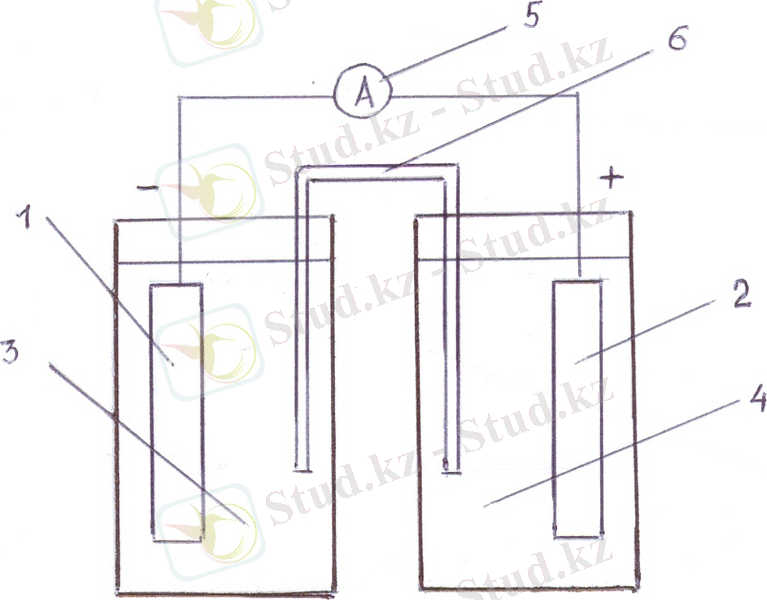
Гальваникалық элемент дегеніміз химиялық реакциялардың энергиясы электр энергиясына айналатын ұяшық. Мысал ретінде Якоби- Даниэль элементін қарастырамыз:
(-) Zn/ZnSO 4 , H 2 O//H 2 O, CuSO 4 /Cu (+)
Мұнда электродтар ретінде Zn және Cu пластиналары қолданылады. Олар өздерінің иондары бар ерітіндіге батырылған. Zn электроды элементтің теріс полюсінде орналасады.
(-) Zn 0 -2e =Zn 2+
Онда тотығу реакциясы жүріп, сыртқы тізбекке екі электрон бөлінеді . Бөлінген бұл электрондар сыртқы тізбек арқылы өтіп, мыс (тізбегі ) электронына өтіп оны тотықсыздандырады.
(+) Cu 2+ +2e = Cu 0
Элементте келесі ток жүретін реакция жүреді
Zn + CuSO 4 = Cu + ZnSO 4
Zn 0 + Cu 2+ = Cu 0 + Zn 2+
Гальваникалық элемент жалпы түрде келесі схемамен көрсетіледі:
(-) Me ɪ / Me ɪ X ɪ , H 2 O // Me ɪɪ X ɪɪ , H 2 O /Me ɪɪ (+)
/- фазалар шекарасын көрсетеді
//- бір- бірінен әйтеуір бір қасиетінен айырмашылық бар электролит ерітінділерінің шекарасын көрсетеді. Сыртқы тізбек жалғанбаған жағдайда электрохимиялық процестер жүреді. Бірақ бұл жағдайда түзілген ток пайдаланылмаған соң жүйеде динамикалық тепе- теңдік орнайды. Ұяшықтағы электродтар электродтық потенциалдармен сипатталады. φ әрпімен белгіленеді.
Сыртқы тізбек жалғалбаған жағдайдағы осы электродтардың потенциалдарының айырмасы гальваникалық элементтің электр қозғаушы күші деп аталады. Е әрпімен белгіленеді.
Е = φ + - φ -
мұндағы φ + - оң зарядталған электродтың потенциалы (В)
φ - - теріс зарядталған электродтың потенциялы
ЭҚК -нің мәні элементтің конструкциясына тәуелді емес, ол элементте жүретін химиялық реакцияның Гиббс энергиясының өзгерісімен анықталатын мән .
G = -zFE
ЭҚК әрқашанда оң мән болғандықтан гальваникалық элементте әрқашанда өздігінен жүретін химиялық реакция жүреді .
ΔG<0 болуы тиіс . Сондай-ақ Гиббс-Гельмгольц теңдеуі бойынша:
ΔG= ΔH-TΔS
Энтропияның өзгеруін Гиббс энергиясының өзгеруі арқылы келесідей көрсетеміз:
ΔS =

 = zF
= zF
P-const.
ΔS = zF
Формуласын орнына қойып, өзгертіп келесідей жазуға болады::
ΔН = - zF(E - T
где
Э. қ. к. температуралық коэффициентті келесідегідей есептеледі:
ЭҚК- нің температуралық коэфициенті
Бұл коэф келесідегідей есептеледі:
E 1 , E 2 - T 1 , T 2 температурадағы гальваникалық элементтің ЭҚК- і
Егер гальваникалық элементте химиялық реакция стандарттық шартта жүрсе, онда осы реакция үшін Гиббс энергиясының өзгерісін келесідей жазамыз:
ΔG 0 = - zFE 0
мұндағы E 0 - гальваникалық элементтің стандарттық ЭҚК
Элементте жүретін химиялық реакцияның тепе- теңдік тұрақтысын келесі теңдеумен анықтаймыз.
lnК р = -
Гальваникалық элементтің ЭҚК-і гальваникалық элементте жүретін химиялық реакцияны потенциал түзетін иондарының концентрациясына тәуелді. Егер гальваникалық элементте келесі химиялық реакция жүретін болса,
Me 1 + Me 2 z+ = Me 2 + Me 1 z+
Онда ЭҚК иондардың белсенділігімен (концентрациясымен) келесі теңдеу арқылы байланысты:
E = E 0 -
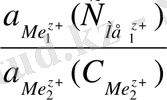
Электродтық потенциал және оның потенциал анықтайтын иондардың концентрациясына тәуелділігі
Кез келген электрохимиялық жүйедегі әрбір электрод электродтық потенциалымен сипатталады . Электродтық потенциалдың абсолюттік мәнін өлшеуге және теориялық жолмен есептеу мүмкін емес. Сондықтан электродтық потенциал ретінде берілген электродты стандарттық (қалыпты) сутегі электродынан тұратын гальваникалық элементтің ЭҚК қабылдайды стандарттық сутегі электроды деп сутегінің қысымы 1атм, концентрациясы 1-ге тең болған жағдайдағы сутегі иондарына қатысты алғанда қайтымды электродты айтады. Стандарттық сутегі электродының потенциялы шартты түрде нольге тең деп қабылданған. Электродтық потенциалға, егер электрод қалыпты сутегі электродына қарағанда оң зарядталған болса, оң таңба беріледі. Ал егер қалыпты сутегі электродына қарағанда теріс зарядталса, теріс таңба беріледі. Мысалы: мырыш электродының потенциялы мырыш электродымен стандарттық сутегі электродынан тұратын гальваникалық элементтің ЭҚК-на тең.
(-) Zn/Zn 2+ //H + /H 2 , Pt (+)
Гальваникалық элементте келесі химиялық реакция жүреді
Zn + 2H + = Zn 2+ + H 2
Бұл реакция үшін Гиббс энергиясының өзгерісін келесідей жазамыз:
ΔG = - RTlnK p + RTln
a H+ = 1
a Zn = 1
P H2 =1 атм деп қабылдаймыз, сонда
ΔG = - RTlnK p + RTln
Сондай- ақ
ΔG = - zFE = -2F(φ + - φ - ) = - 2F(φ
Бірақ сутегі ионының белсенділігі 1-ге тең, сутегі ионының қысымы 1 атм - ға тең. Сондықтан
Сонда келесі теңдеуді аламыз :
ΔG = 2Fφ
φ H+/H2 стандарттық сутегі электронының электродтық потенциялы
φ
φ
Егер ерітінді идеалдық болса онда Zn электродының потенциялы үшін теңдеуді келесідегідей жазамыз:
φ
Стандарттық электродтық потенциал дегеніміз өз иондарының ерітіндісіне батырылған және осы иондардың белсенділігі 1-ге тең болған шартта олармен тепе-теңдік күйде болатын электродтық потенциялы
Егер потенциал түзетін ион анион болса, мы: Cl - онда Cl электродының потенциялы келесі реакция жүретін
H 2 + Cl 2 = 2H + - 2Cl -
гальваникалық элементтің
(-) H 2 , Pt/HCl/Pt, Cl 2 (+)
электр қозғаушы күші болады.
Cl электродының потенциялы келесідегідей көрсетеміз .
φ
мұндағы φ
яғни кез келген электродтың потенциялын келесідегідей жазуға болады.
φ
Катиондарына қатысты қайтымды электродтарға (+) таңбасын, аниондарға қатысты (-) таңбасын қоямыз.
Егер электролит идеалдық болса онда теңдеуді келесідей жазамыз
φ
Бұл теңдеулер Нернст теңдеуі деп аталады. Потенциал мәнінің потенциал анықтайтын ионының концентрациясынан (белсенділігінен) тәуелділігін көрсетеді. Кейбір электродтық потенциалдар 298К - де кейбір мәндерге ие .
Кесте :
Кейбір электродтық реакциялар үшін стандарттық электродтық потенциалдар мәні 298К сулы ортада:
Li + /Li
K + /K
Ba 2+ /Ba
Ca 2+ /Ca
Mg 2+ /Mg
Al 3+ /Al
Zn 2+ /Zn
Cd 2+ /Cd
Co 2+ /Co
Ni 2+ /Ni
Sn 2+ /Sn
Pb 2+ /Pb
Li + + e = Li
K + + e = K
Ba 2+ +2e = Ba
Ca 2+ + 2e = Ca
Mg 2+ + 2e = Mg
Al 3+ + 3e = Al
Zn 2+ + 2e = Zn
Cd 2+ + 2e = Cd
Co 2+ + 2e = Co
Ni 2+ + 2e = Ni
Sn 2+ + 2e = Sn
Pb 2+ + 2e = Pb
-3, 045
-2, 925
-2, 90
-2, 87
-2, 363
-1, 66
-0, 763
-0, 403
-0, 277
-0, 25
-0, 136
-0, 126
H + /Pt, H 2
Sn 4+ , Sn 2+ /Pt
Cu 2+ /Cu
OH - /Pt, O 2
Fe 3+ , Fe 2+ /Pt
Ag + /Ag
Pt 2+ /Pt
H + /Pt, O 2
Cl - /Pt, Cl 2
Au 3+ /Au
Au + /Au
F - /Pt, F 2
H + + e = ½H 2
Sn 4+ + 2e = Sn 2+
Cu 2+ + 2e = Cu
½O 2 +H 2 O + 2e = 2OH -
Fe 3+ + e = Fe 2+
Ag + e = Ag
Pt 2+ + 2e = Pt
O 2 +4H + +4e = 2H 2 O
Cl 2 + 2e = 2Cl -
Au 3+ + 3e = Au
Au + + e = Au
F 2 + 2e = 2F -
0, 00
+0, 154
+0, 337
+0, 401
+0, 771
+0, 799
+1, 20
+1, 229
+1, 359
+1, 50
+1, 70
+2, 87
1. 5 Электродтардың жіктелуі
Электродтардың жіктелуі электродта жүретін процестің сипаты және электродтық реакцияға қатысатын заттың химиялық табиғаты бойынша анықталады. Осы белгілері бойынша электродтарды жіктейді:
1. Ι-ші текті электродтар . Оларға өзінің иондары бар ерітіндіге батырылған және сол иондарға қатнасы бойынша қайтымды металдық электродтардан тұратын электрохимиялық жүйе жатады.
Me/Me + Me + /Me
Me z+ +ze = Me 0
Электродтың потенциялы келесі теңдеуде:
φ
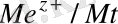 = φ
= φ
немесе
φ
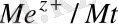 = φ
= φ
Ι-ші текті электродтарға металдық электродтар немесе металл амальгамасынан тұратын электродтар жатады.
Me/Me + (Hg)
Электродта келесі электрохимиялық реакция жүреді:
Me z+ + ze = Me (Hg)
Амальгамдық электродтың электродтық потенциялын келесідегідей көрсетеміз
φ
немесе
φ
Ф
ΙΙ-ші текті электродтар
Бұл дегеніміз металл электрод еруі қиын тұзымен (тотығымен) қапталған және осы еруі қиын тұзбен ортақ анионы бар жақсы еритін тұздың ерітіндісіне батырылған электрод. Оксид иондары үшін ОН - . Бұл электордтардың ерекшелігі электрохимиялық реакцияға еруі қиын тұз қатысады. Мы: кеңінен қолданылатын келесі салыстыру электродтарын қарастырамыз:
1) Хлор, күмісті электрод. Cl - /AgCl, Ag.
AgCl + e = Ag + Cl -
Бұл электродтың потенциалын келесі теңдеуімен анықтаймыз:
φ
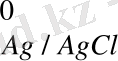 -
-
немесе идеалдық ерітінділер үшін
φ
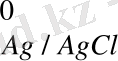 -
-
Идеалдық ерітінділер үшін концентрация арқылы.
2) Калломендік электрод кеңінен қолданылады, электрохимиялық тізбегін келесідегідей көрсетуге болады.
Cl - /Hg 2 Cl 2 , Hg
Мұнда келесі реакция жүреді:
Hg 2 Cl 2 + 2e = 2Hg + 2Cl -
Сурет Коллометтік электродтың құрылысы
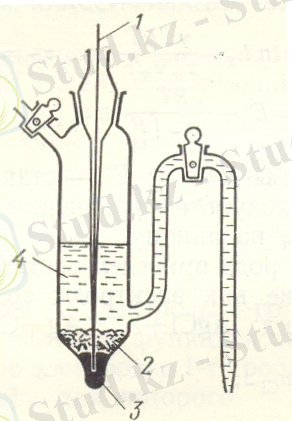
1-металл өткізгіш
2-Hg 2 Cl 2 қабаты
3-сынап
4-KCl ерітіндісі
Электродтың потенциялын келесідегідей көрсетеміз:
φ
немесе
φ
3) Сынапты оксидті электрод
OH - /Hg 2 O, Hg
Келесі реакция жүреді:
Hg 2 O + 2e + H 2 O = 2Hg + 2OH -
Потенциялы:
φ
немесе
φ
Газдық электродтар.
Ол дегеніміз газбен шаймаланатын және осы газдың иондары бар ерітіндіге немесе қышқылдар мен негіздердің ерітінділеріне батырылған (оттегі электроды) электродтар. Кеңінен қолданылатын газдық электродтар
1. Сутегі электроды
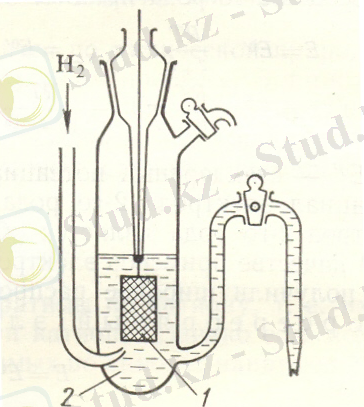
Сурет
1- Платинадан жасалған пластинка
2- қышқыл ерітіндісі
Электрохимиялық тізбегі:
H + /H 2 , Pt
Реакция жүреді: 2H + + 2e = H 2
Потенциялы:
φ
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz