Мырыш(II)-глицин біртекті комплекстерінің синтезі және физико-химиялық сипаттамасы


КІРІСПЕ
Тақырыптың өзектілігі: Комплексті қосылыстар XIX ғасырдан бері белгілі. Осы облыста көптеген зерттеушілер жұмыс атқарды. Олардан А. Вернерді, Ф. Файгльді, Б. В. Некрасовты және тағы басқаларды айтуға болады. Ал қазақстандық ғалымдар Е. Х. Абланова, Х. К. Оспанов, Шалдыбаева, Е. А. Мамбетқазиевтар осы салада елеулі еңбек атқарды. Химия ғылымы бойынша маңызды тың мәселеге негіз болып отырған комплексті қосылыстар жан-жақты зерттеуді қажет етеді. Ал оның дамуы біздің білімімізді жетілдірудің басты кепілі болып табылады. Ағзадағы тасымалдау құбылысын сөз еткенде комплексті қосылыстардың өмірлік қажеттілігі арта түседі. Осы қажеттілікті өтеуден тақырыптың өзектілігі туындайды. Комплексті қосылыстардың өздеріне тән кейбір қасиеттеріне байланысты, оларды көптеген мақсаттарда: жаңа материалдар алуда, медицинада, жылу энергиясын тасымалдайтын жабдықтарды химиялық әдіспен тазалауда, химиялық және электрохимиялық тұндыруда электролиттерді дайындау үшін, органикалық синтезде және катализде рацемикалық қоспаларды бөлу үшін және т. б. қолданылады. d - металдардың (әсіресе мырыш (ІІ) иондарының) әр түрлі полидентатты лигандтармен (амин қышқылы, гетероциклді амин) бір координациялық сфераға сәйкестігін, олардан түзілетін біртекті және әртекті лигандты комплекстердің құрамы мен тұрақтылығын зерттеу теориялық және практикалық қызығушылық тудырады. Жұмыстың мақсаты: мырыш (II) ионының глицинмен түзетін біртекті комплекстерді синтездеу және құрамы мен қасиеттерін физико-химиялық әдістермен зерттеу. Зерттеу нысаны: мырыш (II) ионымен комплекстер түзетін амин қышқылы -глицин(Gly) . Жұмыстың ғылыми жаңалығы: ерітінділерде тепе-теңдік жағдайда мырыштың (ІІ) глицинмен біртекті лигандты комплекстер түзілетіні және олардың құрамы мен тұрақтылығы әдебиеттерден белгілі. Осы комплекстерді алғаш рет қатты күйінде синтездеп алып, олардың қасиеттері рентгенофазалық талдау, рентгеноспектральды микроталдау әдістермен зерттелді. Синтезделінген комплексті қосылыстар жаңа фаза екені дәлелденді. Жұмыстың практикалық маңыз: Мырыш - ағзада координациялық қосылыстар түрінде кездесетін биометалл. Амин қышқылдары биологиялық белсенді зат болғандықтан, оған негізделген мырыштың комплекстері медико-биологиялық қатынаста перспективті болып табылады. Мырыш (II) ионы глицинмен каталитикалық және фотохимиялық қасиеттері бар комплексті қосылыстар түзеді. Мырыштың (ІІ) лабильді қосылыстарын зерттеу биобейорганикалық химияның кейбір мәселелерін шешуде маңызды. Жұмыстың құрылымы: ғылыми жұмыс кіріспеден, негізгі бөлімнен, тәжірибелік бөлімнен, қорытындыдан тұрады. Зерттеу жұмысы ШҚМУ-тінің химия кафедрасының 436-шы зертханасында өткізілді.
НЕГІЗГІ БӨЛІМ
Комплексті қосылыстардың теориялық негіздері
Қазіргі таңда химия саласында комплексті қосылыстар химиясы, олардың талабынан туып отыр. Комплексті қосылыстар халық шаруашылығының түрлі тармағында қолданылады.
Сулы ерітіндіде берік, ыдырамайтын немесе өзінің құрам бөліктеріне өте аз мөлшерде ыдырайтын жоғарғы реттегі қосылыстарды Вернер комплексті қосылыс деп атады. Яғни, Вернер комплексті қосылыстарды жоғарғы реттегі қосылыстардың жеке жағдайы деген түсінік қалыптастырды.
Комплексті қосылыс туралы Д. И. Менделеевтің пікірі өз мағынасын әлі күнге дейін жойған емес. «Бір қосылыс оның термодинамикалық жағдайына байланысты қарапайым қосылыс немесе комплексті қосылыс болуы мүмкін» деген. Мысалы, хлорлы натрий бу күйінде
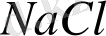 -дың жеке молекулаларынан тұрады; осы жағдайда ол қарапайым бинарлы қосылыс. Егер осы тұзды кристалдық жағдайынан алып, рентгендік талдау жасасақ, біз әрбір натрий ионының симметриялы алты хлор ионы, ал әрбір хлор ионын -алты натрий ионы қоршаған жоғарғы молекулалы қосылыс
-дың жеке молекулаларынан тұрады; осы жағдайда ол қарапайым бинарлы қосылыс. Егер осы тұзды кристалдық жағдайынан алып, рентгендік талдау жасасақ, біз әрбір натрий ионының симметриялы алты хлор ионы, ал әрбір хлор ионын -алты натрий ионы қоршаған жоғарғы молекулалы қосылыс
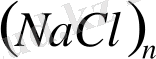 аламыз. Бу күйінде су қарапайым
аламыз. Бу күйінде су қарапайым
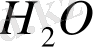 формуласына, ал сұйық күйінде
формуласына, ал сұйық күйінде
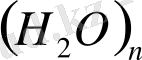 формуласына сай келеді. [1]
формуласына сай келеді. [1]
Комплексті қосылыстар туралы түсініктер ерітіндіде жүретін реакцияларды зерттеу негізінде туды. Алғашында комплексті қосылыстар химиясында препаративті әдіс маңызды болған, демек ерітіндіден белгілі қосылыстарды бөлу әдісі еді. Осы әдістің арқасында координациондық теория дамыды. Кейінірек физико-химиялық анализ әдісі қолданылып, ол ерітіндіден комплексті қосылысты бөлмей, оның тұрақтылық константасы мен құрамын анықтауға қолданылды.
Комплексті тұздардың иондарға ыдырау типі және комплексті ионның құрамын анықтағанда физико-химиялық әдістері ішінде ыңғайлы және ерітіндінің электр өткізгіштігін өлшейді. Бұны Вернер тәжірибеге енгізген. [2]
Ерітіндідегі комплекс ионының құрамын анықтау үшін спектрофотометриялық әдіс қолданылады. Негізінен екі спектрофотометриялық әдістің екі түр өзгерісін пайдаланады; олар «үздіксіз өзгерістер» әдісі (Остролигенский-Жоб әдісі) мен «шектеулі логарифмдеу әдісімен» құрамын анықтау.
«Үздіксіз өзгерістер» әдісі, молярлығы бірдей ерітінді күйіндегі заттардың әртүрлі арақатынасы араласып, бірақ жалпы көлемінің өзгеріссіз қалуына негізделген.
Мысалы, 8 мл А ерітіндісі мен 2 мл В ерітіндісі араластырылса, 6 мл А ерітіндісі мен 4 мл В ерітіндісі, 5 мл А ерітіндісі мен 5 мл В ерітінділері араластырылса т. с. с. Әр комбинация үшін қандай да бір қасиеті өлшенеді (бұл жағдайда сіңіру өзгерісі) . Таңдалынып алынған қасиеттердің максимумы немесе минимумы ерітіндідегі қосылыстардың құрамына жауап береді.
Координациялық теория бойынша комплексті қосылыста орталық орын алып тұрған ион, не атом комплекс түзуші деп аталады. Мысалы, мына қосылыстар
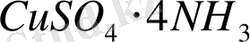 немесе
немесе
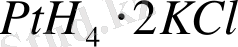 комплексті қосылыстар болады. Бұлардағы
комплексті қосылыстар болады. Бұлардағы
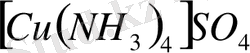 ,
,
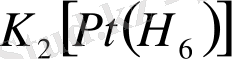 мыс және платина иондары комплекс түзуші.
мыс және платина иондары комплекс түзуші.
Комплекс түзушінің айналасына, соның әсері тиетіндей жақын жиналған, яғни координацияланған иондарды, не молекулаларды лигандтар, аддендтер деп атайды. Міне, осылар (комплекс түзуші мен лигандтар) бірігіп, комплексті қосылыстардың ішкі сферасын құрайды. Комплексті қосылыстарды жазғанда олардың ішкі және сыртқы сфераларын айырып көрсету үшін ішкі сфераны жоғарыда айтқандай квадрат жақшаға алады. Мысалы,
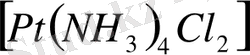 ,
,
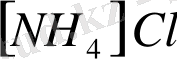 ,
,
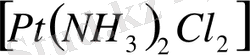 т. б.
т. б.
Комплексті қосылыстардың саны әлдеқайда көп. Өйткені, біріншіден, элементтердің көпшілігі, оның ішінде металдар, әсіресе қосымша топтардағы металдардың барлығы, комплекс түзуші бола алады. Екіншіден, комплекстің ішкі сферасына лиганд ретінде кіретін бөлшектер өте көп, олар:
1) құрамында оттек бар қосылыстар - су (комплексті қосылыс-кристаллогидраттар түзеді), спирттер (алкоголяттар түзеді), қышқылдар (ацидаттар түзеді) альдегидтер, кетондар да комплекстің ішкі сферасына кіре алады.
2) құрамында азот бар қосылыстар - аммиак - (аммиакаттар түзеді), нитридтер, амидтер т. б. қосылыстар да ішкі сфераға кіре алады.
3) құрамында күкірт бар қосылыстар - сульфидтер, тиоспирттер, тиоэфирлер т. б. қосылыстар да ішкі сфераға кіріп комплекс түзеді.
4) тұздар және тұздардың қос тұз типті комплексті қосылыстары.
5) полигалогенид, полисульфид сияқты комплексті қосылыстары.
6) күрделі қышқылдар (изополиқышқылдар, гетерополиқышқылдар) .
Химияда неше комплекс түзуші элемент болса, соның әрқайсысы осы аталған лигандтармен комплекс түзе алады. Осының өзінен комплексті қосылыстардың қаншалықты көп екендігін байқауға болады. Орталық атомның төңірегіне лигандтардың қандай санын ұстап қалуына, яғни оның координациялық санына байланысты [1] .
Координациялық сан және комплексті қосылыстардың құрылымы. Бос орбитальдары бар атомдар немесе металл иондары әдетте комплекс түзушілер бола алады, яғни, лигандтармен байланыс құру кезінде комплекс түзушілер акцептордың функциясын атқарады.
Орталық атомның төңірегіне лигандтардың орналасуы әр түрлі, ол комплекс түзушінің лигандтардың қандай санын ұстап қалауына, яғни оның координациялық санына байланысты. Әртүрлі комплекс түзушілерде
координациялық сан 2-ден 10-ға дейін өзгереді,
4 және 6 сандары жиі, 8 және 2 сандары сирек кездеседі. Координациялық саны - 2; бір валентті күміс
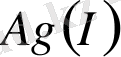 , алтын
, алтын
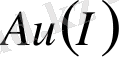 және мыстың
және мыстың
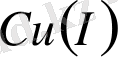 комплексті қосылыстары жиі кездеседі. Мысалы,
комплексті қосылыстары жиі кездеседі. Мысалы,
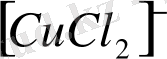 ,
,
 ,
,
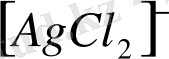 . Мұндай комплекстерде орталық атом мен екі лиганд бір түзудің бойына орналасады, демек, құрылысы түзу сызықты болады.
. Мұндай комплекстерде орталық атом мен екі лиганд бір түзудің бойына орналасады, демек, құрылысы түзу сызықты болады.
Координациялық сан 3
сирек кездеседі. Мысал ретінде сынаптың мынадай комплексті қосылысын:
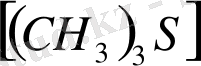 ,
,
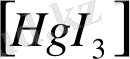 келтіруге болады.
келтіруге болады.
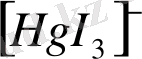 ионының құрылысы теңқабырғалы үшбұрыш сияқты.
ионының құрылысы теңқабырғалы үшбұрыш сияқты.
Комплекс түзушінің координациялық саны 4 болғанда комплексті ионның құрылысы тетраэдр немесе квадратты болып келеді.
Тетраэдрлі комплекстерді бейметалдар және кейбір металдар түзеді. Мысалы,
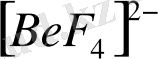 ,
,
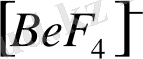 ,
,
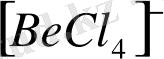 ,
,
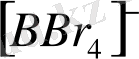 ,
,
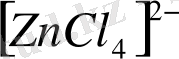 ,
,
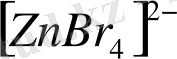 ,
,
 ,
,
 және т. б.
және т. б.
Координациялық саны 5 болып келетін комплекстер онша көп емес. Мұндай комплекстердің құрылысы үшбұрышты бипирамира немесе квадратты пирамида сияқты болады (5 және 6) .
Ең жиі кездесетін координациялық сан 6.
Мұндай комплекстердің құрылымы октаэдр сияқты. Алтыдан үлкен координациялық сандар сирек кездеседі. Ондай комплекстерді 5-ші және 6-шы периодтағы d-металдар, лантаноидтар және актиноидтер түзеді. Комплекс иондарының беріктігі әр түрлі болады, мысалы
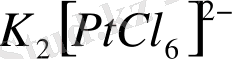 ионы берік ион, ол тұз суға ерігенде бұл ион диссоциацияланбайды, ерітіндіде
ионы берік ион, ол тұз суға ерігенде бұл ион диссоциацияланбайды, ерітіндіде
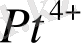 не
не
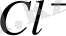 иондары бөлінбейді, ал енді
иондары бөлінбейді, ал енді
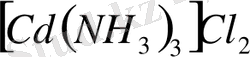 тұзының ерітіндісінде
тұзының ерітіндісінде
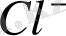 иондарымен қатар
иондарымен қатар
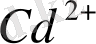 иондары және
иондары және
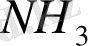 молекулаларының бар екендігі білінеді, демек бұл тұз суда ерігенде былай диссоциацияланады:
молекулаларының бар екендігі білінеді, демек бұл тұз суда ерігенде былай диссоциацияланады:
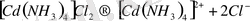 , (1)
, (1)
 , (2)
, (2)
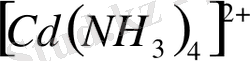 комплекс ионының диссоциациялануы оның ішкі сферасының берік еместігін көрсетеді. Осындай ішкі сферасы берік емес комплексті тұздар қасиет жағынан қос тұздарға жақындайды.
комплекс ионының диссоциациялануы оның ішкі сферасының берік еместігін көрсетеді. Осындай ішкі сферасы берік емес комплексті тұздар қасиет жағынан қос тұздарға жақындайды.
Шынында да қос тұздар мен комплексті тұздардың арасында үлкен айырмашылық жоқ. Қос тұзды координациялық ішкі сферасы берік емес, тұрақсыз комплексті қосылыс деп қарауымыз керек. Бұл екеуінің негізгі айырмашылығы еріген кезде қос тұздар құрамындағы барлық иондарға диссоциацияланады:
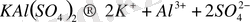 , (3)
, (3)
ал комплексті тұздар комплекс ион түзеді.
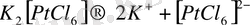 , (4)
, (4)
Сондықтан қос тұздарды комплексті тұздардан айырмашылығын көрсету үшін
 деп жазбайды,
деп жазбайды,
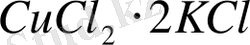 деп жазады. Комплексті қосылыстардың беріктігін сипаттау үшін, комплексті ионның диссоциациялану тепе-теңдігін алып, комплекстің тұрақсыздық константасын есептейді.
деп жазады. Комплексті қосылыстардың беріктігін сипаттау үшін, комплексті ионның диссоциациялану тепе-теңдігін алып, комплекстің тұрақсыздық константасын есептейді.
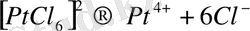 , (5)
, (5)
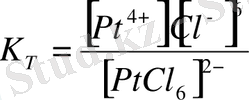 , (6)
, (6)
Неғұрлым
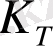 мәні кіші болса, соғұрлым комплексті ионның беріктігі арта түседі. Комплексті ионның диссоциациялануы қайтымды процесс болғандықтан оған термодинамика заңдарын қолдануға болады:
мәні кіші болса, соғұрлым комплексті ионның беріктігі арта түседі. Комплексті ионның диссоциациялануы қайтымды процесс болғандықтан оған термодинамика заңдарын қолдануға болады:
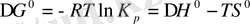 , (7)
, (7)
Бірнеше бөлшектердің бірігіп, үлкен комплексті ионның түзілуі - көбіне экзотермиялы болады, өйткені жаңа байланыстар түзіп, жүйе экзотермиялық тұрақты күйге ауысады. Ал ретсіздік дәрежесіне келсек, керісінше, көп жағдайда оның кемігенін көрер едік
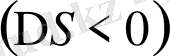 , яғни, ол ионның түзілуіне кері әсерін тигізеді[1] .
, яғни, ол ионның түзілуіне кері әсерін тигізеді[1] .
Комплексті қосылыстардағы химиялық байланыстың табиғаты.
Қазіргі кезде комплексті қосылыстардағы байланыстың табиғатын қарастыратын үш теориялық әдіс бар:
1) валенттік байланыс әдісі;
2) кристалдық өріс теориясы;
3) молекулалық орбитальдар әдісі.
Валенттік байланыс әдісі.
Валенттік байланыс әдісі бойынша орталық атом мен лиганд донорлы-акцепторлы жолмен байланысады. Әдетте, орталық атом байланыс түзуге бос орбитальдарын, лиганд пайдаланылмаған электрон жұбын (басқаша екі электронды орбиталін) жұмсайды. Демек, орталық атом (ион) - акцептор, лиганд - донор. Молекула немесе ион лиганд рөлін атқару үшін оның құрамындағы атомның пайдаланылмаған электрон жұбы болу керек. Атап өткендей, комплекс түзушілер әдетте металдардың иондары бола алады, себебі олардың бос валенттік орбильдары болғандықтан, олар Льюис қышқылдарының (электрондық жұптардың акцепторлары) рөлін атқара алады. Бөлінбеген электрон жұптары бар болғандықтан, лигандтар Льюис негіздерінің қасиеттерін көрсетеді (электрондық жұптардың донорлары) . Орталық атомның бос орбитальдарының саны оның комплексті қосылыстағы координациялық санына тең болады. Енді осы тұрғыдан мырыш катионы
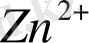 аммиак молекуласымен әрекеттескенде пайда болатын.
аммиак молекуласымен әрекеттескенде пайда болатын.
 , (8)
, (8)
Комплексті ионның
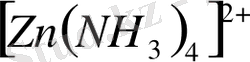 түзілуін қарастырайық. Мырыш катионының мырыш атомынан
түзілуін қарастырайық. Мырыш катионының мырыш атомынан
Zn 3d 10 4s 2 4p 0
3d 4s 4p
екі электроны кем, сондықтан мырыш катионының валенттік қабатының электрон құрылысы мынадай:Zn 3d 10 4s 0 4p 0
Ендеше
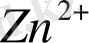 ионының гибрид типі sp
3
, молекулалы тетраэдрлік комплексті ион формуласы
ионының гибрид типі sp
3
, молекулалы тетраэдрлік комплексті ион формуласы
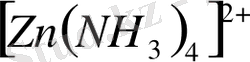 .
.
Сонымен валенттік байланыс әдісі бойынша комплексті қосылыстағы орталық атом (ион) мен лиганд арасындағы байланыс донорлы-акцепторлы жолмен түзелетін коваленттік байланыс. Комплексті ионның кеңістіктегі құрылысы орталық атомның байланыс түзеуге жұмсайтын бос орбитальдарының типіне байланысты. Орталық атом байланыс түзуге sp-гибридті екі орбиталін пайдаланса сызықтық, sp 2 -гибридті үш орбиталін пайдаланса жазық үшбұрышты, sp 3 -гибридті төрт орбиталін пайдаланса тетраэдрлік, sp 2 d-гибридті төрт орбиталін пайдаланса квадратты комплекстер, sp 3 d-гибридті бес үшбұрышты бипирамида тәрізді комплекс, sp 3 d 2 -гибридті алты орбиталін пайдаланса октаэдрлік комплекс түзіледі, т. с.
Валенттік байланыс әдісі комплексті қосылыстардағы орталық атом мен лиганд арасындағы байланыстың түзілу механизмін және комплекстердің кеңістіктегі құрылысын түсіндіре алады. Енді валенттік байланыс әдісі комплексті қосылыстардың магниттік қасиеттерін қалай түсіндіреді екен, соны қарастырайық. Тәжірибелік деректер бойынша екі валентті мырыштың аммиакты комплексі [Zn(NH 3 ) 4 ] 2+ димагнитті. [Zn(NH 3 ) 4 ] 2+ комплексті ионының түсі қандай екендігі жайлы мәліметті ВБ әдісі бойынша бере алмаймыз. Оны түсі туралы, магниттік қасиеті жайлы тек кристалдық өріс теориясымен сипаттағанда ғана дұрыс жауабын беруге болады.
Комплекс қосылыстардың аталуы
Комплекс қосылыстардың рационал аталуын Вернер ұсынған. Ол атау осы күнге дейін қолданылып келеді. Жаңа атаудың жобасы 1963 жылы жарияланған. Ол қазір кеңінен қолдау табуда. Бұл атау бойынша орыс тіліндегі атау мен қазақ тілінде атауда айырмашылық болады. Орыс тілінде алдымен анион содан соң катион атайтын болса, қазақша атағанда алдымен катион, соңынан анион аталуға тиіс. Егер комплекс ион катион болса, алдымен бейтарап молекула лигандалар аталады. Лигандалар санын грек тілінде атайды 2-ди, 3-три, 4-тетра, 5-пента, 6-гекса, 8-окта. Содан кейін ион түріндегі лигандалар аталады. Лигандалардың аттары су-акво, аммиак-аммин, CN - -циано, NO 2 - -нитро, Cl - -хлоро, OH - -гидроксо, S 2- -тио, SCN - -родано және басқа деп аталады [11] . Жақша ішіне оның тотығу дәрежесін қояды. Мысалы:
[Ag(NH 3 ) 2 ] Cl - диаммин күміс (I) хлориді
[Cu(NH 3 ) 2 ] SO 4 - диаммин мыс (II) сулфаты
Егер комплекс ион анион болса, алдымен сыртқы сфера катионы аталады. Содан соң комплекс анион аталады-оның ішінде алғаш лигандалар (бейтарап молекулар, содан соң иондар) одан кейін комплекс түзуші аталып оның тотығу дәрежесі жақша ішінде көрсетіледі.
Мысалы: K[Ag(CN 2 ) ] -калий дициан аргентаты (I), K 3 [Fe(CN) 6 ] -калий гексациано ферраты (III), NH 4 [Cr(CNS) 4 (NH 3 ) 2 ] - аммоний диаммин тетра родано хроматы (III) . Бейтарап комплекс қосылыстарды атағанда лигандаларын және комплекс түзушіні атайды. Тотығу дәрежесін көрсетпейді.
Комплекс қосылыстарының қысқаша да аттары бар.
Мысалы: K 3 [PtCl 6 ] - калий хлорплатинаты, K 3 [Fe(CN) 6 ] -калий феррицианиді. [2]
Комплекс қосылыстарының судағы диссоциациялануы
Электролит емес комплекс қосылыстардың судағы ерітінділері диссоциацияға ұшырамайды. Өйткені олардың сыртқы сферасы жоқ. [Pt(NH 3 ) 2 Cl 2 ], [Co(NH 3 ) 3 (NO 3 ) 3 ] т. б. Олар суда біртұтас гидраттанған күйде болады.
Электролит комплекс қосылыстар суда ерігенде диссоциацияланып, комплекс ион түзеді:
[Cu(NH 3 ) 4 ] SO 4 [Cu(NH 3 ) 4 ] 2+ +SО 4 2-
Ал комплекс иондар ([Cu(NH 3 ) 4 ] 2+ ) суда одан әрі ыдырауы мүмкін:
[Cu(NH 3 ) 4 ] 2+ Cu 2+ +4NH 3
Алайда соңғы саты өте аз мөлшерде жүреді де, іс жүзінде оны есепке алмайды. Диссоциацияның екінші сатысына массалар әсер заңын қолданып диссоциация константасын жазуға болады. Оны тұрақсыздық константасы дейді[4] . Келтірген мысал үшін тұрақсыздық константасы мынаған тең:
[Cu 2+ ] * [NH 3 ] 4
K H[Cu(NH3) 4] 2+ =
[[Cu(NH 3 ) 4 ] ] 2+
Комплексті қосылыстың тұрақсыздық константасы К н оның ішкі сферасының тұрақтылығын көрсетеді. Тұрақсыздық константасы комплекс тұздар үшін анықталып, кесте түрінде беріледі. Тұрақсыздық константасы жоғары комплекс қосылыстар-қос тұздар болады. Олар суда барлық иондарға бірден ыдырап кетеді. Комплексті қосылыстардың тұрақтылығын бағалау үшін тұрақтылық константасын (К уст. -устойчивость) да пайдаланады. Ол тұрақтылық константасына (К н ) кері шама:
1
К уст. = (VI. 1)
К н
Жоғарыдағы мысал үшін тұрақтылық константасы К уст мынадай болады:
[[Cu (NH 3 ) 4 ] 2+ ]
K уст. =
[Cu 2+ ] *[NH 3 ] 4
Cонымен неғұрлым тұрақтылық константасының мәні жоғары болса, соғұрлым комплекс ион тұрақты болады. Комплексті қосылыстардың өмірде және химия өндірісінде мәні орасан зор. Олар өте таза, бағалы металдар -алтын, күміс, никель, мыс, т. б. бөліп алуда пайдаланылады. Сонымен қатар, химиялық анализ жүргізуде де комплекс қосылыстарды кеңінен қолданады. Қазір барлық анорганикалық қосылыстарды комплексті деп қарастыруға болады. Мал, адам организмінде жүретін зат алмасу процесінде комплекс қосылыстардың алатын орны ерекше. Олар тыныс алу, фотосинтез, биологиялық тотығу және ферменттік катализ процестеріне қатысады. Мәселен Mg 2+ және Fe 2+ иондары гемоглобин, хлорофилл сияқты табиғи қосылыстарда комплекс түзуші болады. Гемоглобин мен хлорофиллдің құрылысы ұқсас. Гемоглобинде комплекс түзуші Fe 2+ , ал хлорофиллде Mg 2+ болады. Қанның құрамында гемоглобин болғандықтан; ол қызыл түсті болады, ал хлорофилл өсімдік жапырағына жасыл түс береді. Гемоглобиндегі Fe 2+ қан арқылы организмге қажет оттегін тасушы болса, хлорофилл күн сәулесі әсерінен жасыл жапырақта фотосинтез процесін жүгізеді. Хлорофилсіз жерде өмір болуы мүмкін емес. Фотосинтез процесі нәтижесінде жыл сайын 10 12 кг крахмал мен целлюлоза түзіледі және атмосфераға 1, 1* 10 12 кг оттегі бөлінеді. Биологиялық катализатор болып табылатын ферменттер құрамына Cu 2+ , Co 3+ , Zn 2+ , Mo 6+ және Mg 2+ сияқты комплекс түзушілер кіреді. Олар организмде әр түрлі маңызды процестердің жүруіне қатысады [6] . Монодентантты комплексті қосылыстар болады. Бидентантты және полидентантты комплексті қосылыс бар[7] .
Мысалы:
 ,
,
 ,
,
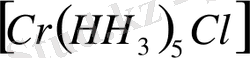 .
.
Диамино, диаква мырыш (ІІ) сульфаты
Ерітіндідегі комплексті қосылыстарды зерттеу әдістері
Үздіксіз өзгерулер әдісі
Бұл әдісті қолданудың алғы шарттары келесідей болады:
1. А және В компонентерінің қатысуы кезінде комплекс түзілудің тек бір ғана тепе-теңдігінің болуы
2. Массалар әрекеттесу заңының концентрациялық формада қолданылу мүмкіндігі.
3. Тек бір ғана комплекстің түзілуі.
1-ші шарт жиі орындалады. Егер компоненттердің біреуі негіз болып саналса, яғни өзіне протон қосып алса, және қышқыл-негіздік тепе-теңдікке қатыса алса, онда
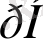 -тың тұрақты мәнін ұстай отырып (сәйкес буферлік жүйені қолдану), әдісті қолдануға болады.
-тың тұрақты мәнін ұстай отырып (сәйкес буферлік жүйені қолдану), әдісті қолдануға болады.
2-ші шартты қанағаттандыру үшін комплекс түзуші компоненттердің аз концентрациясы кезінде, салыстырмалы жоғары концентрациялы тұз ерітіндісінде тұрақты иондық күш болғанда тәжірибені жүргізу қажет. Бұл шарт өлшенетін мәндер ретінде қату температурасы мен электрөткізгіштіктің төмендеуі сияқты физикалық қасиеттердің қолданылуын ескермейді. Осы қасиеттерге негізделген зерттеулер нәтижесі сандық қатынаста сенімді емес. Жарықтың жұтылуы, керісінше бұл үшін толықтай қолданылады.
3-ші шарт өте маңызды. Соңғы жылдары жүргізілген, комплекс түзілудің көптеген зерттеулері көрсеткендей, тек бір ғана комплекс түзілу жағдайы сирек кездеседі. 3-ші шарт максималды координациялық саны бар комплекс АВ формуласына ие болғанда (мұндай жағдайлар белгілі) ғана нақты орындалады. Бірақ бірнеше комплекстердің сатылай түзілуі жиі байқалады. Мұндай жағдайда үздіксіз өзгерулер әдісімен алынған тепе-теңдік тұрақтылары өте көп жағдайда нақты емес.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz