Азот қышқылын өндіру технологиясы: қасиеттері, өндіріс әдістері, құрылымдық және экономикалық-экологиялық негіздері


Мазмұны
I. Кіріспе 3
II. Техникалық бөлім 5
2. 1. Азот қышқылының қасиеттері мен сорттары 5
2. 2. Әлсіз азот қышқылын алу 6
2. 3. Концентрлі азот қышқылын алу 12
2. 4. Өндіріс әдісін таңдау 14
2. 5. Шикізат пен дайын өнімнің негізгі физика-химиялық қасиеттері. Оларға арналған мемлекеттік стандарттар 18
2. 6. Қабылданған әдістеменің теориялық негіздер 22
2. 7. Түйіннің технологиялық сұлбасын сипаттау 25
2. 8. Жабдықты таңдау 29
2. 9. Технологиялық процесті автоматтандыру және өндірісті аналитикалық бақылау 32
2. 10. Өндіріс қалдықтары, оларды пайдалану 34
III. Құрылымдық бөлім 36
3. 1. Алдын ала есептеу 36
3. 2. Сағатына 1 бірлікке материалдық балансты есептеу 37
3. 3 Жылулық есептеу 39
3. 4 Құрылымдық есеп 41
3. 5. Тұтыну коэффициенттерін есептеу 43
IV. Экономикалық бөлігі 44
4. 1. Азот қышқылы өндірісінің даму болашағы 44
V. Экология және еңбекті қорғау 45
5. 1. Еңбекті қорғау және өндірістік экология 45
VI. Қорытынды 47
Пайдаланылған әдебиеттер 48
Кіріспе
20 ғасырдың басына дейін HNO 3 табиғи натрий (чили) нитратынан алынды:
NaNO 3 + H 2 SO 4 = NaHSO 4 + HNO 3 (1)
95-97% H 2 SO 4 және 96% NaNO 3 қолдану 96-98% HNO 3 берді. Кейінірек процесс вакуумда жүргізіле бастады, бұл процестің температурасын және оның ұзақтығын азайтты.
20 ғасырдың басында атмосфералық азотты электр доғалық жалынға бекіту әдісі ұсынылды (1906) . Бұл әдіспен азот қышқылын алу үшін жасанды шикізат пен процесті кешенді жобалау қажет емес, бірақ электр энергиясының көп жұмсалуына байланысты бұл әдіс тиімді емес.
1913 жылы аммиактың өнеркәсіптік синтезі қарапайым заттар, ол тез тарады. Көп ұзамай аммиактан азот қышқылын алу әдісі жасалды.
Атмосферада жұмыс істейтін сызба бойынша 1-ші азот қышқылы зауыты қуаттылығы жылына 8000 тонна қысым 1916 жылы салынған. Юзовка қаласында (КСРО) . Бұл әдіс кокс газынан алынған аммиакты тотықтыру әдісіне негізделген. Бұл әдісті орыс ғалымы Андреев ұсынған. Ол сонымен қатар катализатор - платина торларын ұсынды, торлардағы аммиак тотығу процестерін, азот оксидтерінің сумен сіңірілуін және аммоний селитрасының алынуын зерттеді.
Біздің заманымызда оксидтерді алудың әртүрлі әдістері жасалды. Плазмалық технология бойынша азот, бірақ олар өте электрлік қарқынды. Энергия тұтынуды азайту бойынша жұмыстар жүргізілуде.
Қазіргі кезде азот қышқылын (сұйылтылған) алудың негізгі әдісі Андреев ұсынған әдіс болып табылады.
Азот қышқылы келесі жағдайларда қолданылады:
- ауыл шаруашылығы (аммиак селитрасы, күрделі минералды тыңайтқыштар) ;
- жарылғыш заттарды өндіру;
- бояғыштар мен басқа да химиялық заттарды өндіру;
- зымыран отынын өндіру (азот оксидтері және азот қышқылы) ;
- жасанды жібек өндірісі;
- дәрілік заттарды өндіру;
- күкірт қышқылын өндіру.
Өндіріс көлемі бойынша азот қышқылы 2-орынды алады. Өнеркәсіпте алады:
1) концентрацияланбаған АА (45-60%) ;
2) концентрлі АА (90%) .
Азот оксидтерін сумен сіңіру арқылы алынған концентрлі емес азот қышқылы аммоний селитрасының балқымасын, күрделі тыңайтқыштарды алуға, концентрлі азот қышқылын алу үшін металдарды тұздаудың тотығу процестеріне қолданылады.
II. Техникалық бөлім
2. 1. Азот қышқылының қасиеті мен сорттары
Азот қышқылы - маңызды минералды қышқылдардың бірі.
Сусыз азот қышқылы HNO 3 - тығыздығы 1, 52 г/см3 (15ºC температурада) ауада түтін шығатын ауыр, түссіз сұйықтық. -47ºС-та қатып, 86ºС-та қайнайды. Қышқылдың қайнауы оның азот диоксидінің бөлінуімен ішінара ыдырауымен бірге жүреді. Бөлінген азот диоксиді қышқылда ериді, оны сары немесе қызыл түске бояйды (NO 2 мөлшеріне байланысты) . Сұйылтылған азот қышқылын буландырған кезде оның ерітіндідегі мөлшері 68, 4%-ға дейін көтеріледі.
Азот қышқылы күшті тотықтырғыш болып табылады. Концентрлі азот қышқылы металдардың көпшілігін сәйкес оксидтер мен нитраттарға айналдырады. Кейбір металдардың, мысалы, Al, Fe, Cr бетінде азот қышқылымен әрекеттескенде оның әсеріне төзімді оксидтер қабаты түзіледі. Көптеген органикалық заттар HNO3 әсерінен жойылады, ал кейбіреулері концентрлі қышқылмен жанасқанда тұтануы мүмкін.
Концентрлі азот қышқылы циклдік органикалық қосылыстармен әрекеттесе отырып, олардағы сутегі атомдарын нитротоптармен алмастырады. Құрамында органикалық гидроксил топтары бар HNO3 күрделі эфирлер түзеді.
Азот қышқылы химия өнеркәсібінде де, халық шаруашылығының басқа салаларында да кеңінен қолданылады. Өндіріс көлемі бойынша күкірт қышқылынан кейінгі екінші орында. Азот қышқылының көп бөлігі тыңайтқыштар, жарылғыш заттар, зымыран отыны өндірісінде қолданылады. Сонымен қатар күкірт қышқылын өндіруде (азотты әдіс), синтетикалық бояғыштарды, пластмассаларды, синтетикалық талшықтарды және т. б.
КСРО-да минералды тыңайтқыштар мен синтетикалық материалдар өндірісінің қарқынды дамуына байланысты азот қышқылын өндіру бойынша қуаттар айтарлықтай ұлғайып жатыр.
Өнеркәсіп сұйылтылған (әлсіз) және екі концентрлі азот қышқылының үш сортын шығарады (1-кесте) .
Әлсіз Сорт:
1-й
2-й
3-й
55
47
45
Конц-ген Сорт
Жоғары
1-й
2-й
98, 5
98
97
Кесте 1 . Азот қышқылының сорты
2. 2. Әлсіз азот қышқылын алу
Осы ғасырдың шамамен 20-шы жылдарына дейін Чили селитрасынан күкірт қышқылымен әрекеттесу арқылы азот қышқылы алынды:
NANO 3 +H 2 SO4=HNO 3 +NaHSO4 (2)
Селитраның күкірт қышқылымен ыдырауы түтін газдарымен қыздырылған шойын реторттарында жүргізілді. Бұл жағдайда бөлінген азот қышқылының булары тоңазытқышта конденсацияланды. 95-97% күкірт қышқылын және 96% селитраны қолданғанда 96-98% азот қышқылын алуға мүмкіндік туды.
Элементтерден аммиакты синтездеудегі жетістіктер аммиакты азот қышқылының негізгі көзіне айналдырды.
Аммиактан азот қышқылын шығаратын алғашқы зауыт 1909 жылы Германияда іске қосылды. Бірақ технологияның жетілмегендігінен бұл зауыт одан кейін салынған басқалар сияқты тиімсіз болып шықты.
1914-1916 жж. біздің елде инженер И. И. Андреев және оның әріптестері бұл процесті жан-жақты зерттеді. Зерттеу нәтижелерінің жемісті болғаны сонша, олардың негізінде 1916 жылы Юзовкада (қазіргі Донецк) Ресейде азот қышқылын шығаратын бірінші зауыт салынды.
Аммиактың азот қышқылына айналуы оның реакцияға сәйкес ауадағы оттегімен тотығуынан басталады.
4NH 3 +5O 2 =4NO++H 2 O+910 кДж (3)
Бұл процесте түзілетін азот оксиді түссіз газ болып табылады, ол азот диоксидіне оңай тотығады:
2NO+O 2 =2NO 2 +124 кДж (4)
Азот диоксиді NO2 - қоңыр, ауыр, тұншықтырғыш газ, суда ерігенде азот қышқылын береді:
3NO 2 +H 2 O=2HNO 3 +NO+137 кДж (5)
Көріп отырғаныңыздай, азот қышқылын алу процесі бірінен соң бірі тізбектелген кезеңдерден өтеді. Реакция (3) бірінші кезеңді, аммиактың тотығуын сипаттайды. Құрамында азот оксиді бар газдар азотты газдар деп аталады. Екінші кезең (4) және (5) реакцияларымен сипатталады - азотты газдарды азот қышқылына өңдеу.
Аммиактың тотығуы
Процесс тек жоғары температурада жеткілікті жылдамдықпен жүреді. Сонымен бірге (3) реакциямен қатар басқалары да бар:
4NH 3 +4O 2 =2N 2 O+6H 2 O+1108 кДж (6)
NH 3 +3O 2 =2N 2 +6H 2 O+1279 кДж (7)
(6) және (7) реакцияларының нәтижесінде аммиактан қажетті азот оксидінің орнына азот оксиді мен азот түзіледі. Сондықтан негізгі (мақсатты) реакция (3) (6) мен (7) қарағанда әлдеқайда жоғары жылдамдықпен жүретіндей процесс жағдайларын жасау қажет. Ол үшін процесс шамамен 800ºС температурада жүргізіледі. Жоғары температура аммиактың азотқа және (3) оттегі азотына реакциясы нәтижесінде түзілетін азот оксидінің ыдырауын тудырады. Дегенмен, бұл шарттарда да катализатордың болуы қажет. Онсыз процесс дұрыс бағытта жүрмейді.
Аммиактың тотығуы үшін қымбат катализатор қолданылады - родий және палладий бар қорытпадағы платина. Осы уақытқа дейін бұл катализаторды арзандары асып түспеді, олар белсенділігі төмен және тұрақты болып шықты. Платина катализаторлары диаметрі 0, 06-0, 09 мм өте жұқа сымнан жасалған торлар түрінде жасалады. Тордың 1 см2-де 1024 тесік бар, олар арқылы аммиак-ауа қоспасы өтеді.
Процестің (3) реакцияға қарай бағыты аммиак-ауа қоспасының катализатормен жанасу уақытына да байланысты (байланыс уақыты деп аталады) . Ең тиімдісі 0, 0001-0, 0002 с байланыс уақыты болды. Газдың катализатормен жанасу уақыты қысқарғанда, т. б. газ мелассасының жоғары жылдамдығында аммиак тотығуға үлгермейді және азот оксидінің шығуы азаяды. Ұзақ жанасу уақытымен жанама реакциялар пайда болады, бұл өз кезегінде NO шығымының төмендеуіне әкеледі.
Аммиакты тотығу процесінде қысымды қолдану реакция жылдамдығының жоғарылауына ықпал етеді, бірақ сонымен бірге платинаның жоғалуының жоғарылауына әкеледі.
(3) реакцияға сәйкес 4 аммиак молекуласы үшін 5 оттегі молекуласы жұмсалуы керек, яғни 1 моль NH3-1, 25 моль О 2 .
Тотығу жылдамдығын арттыру үшін аммиактың 1 мольіне 1, 7-2 моль оттегі алынады, бұл аммиак-ауа қоспасындағы аммиак концентрациясының шамамен 10-12% сәйкес келеді. Бұл жағдайда (3) реакцияға түспеген оттегі (4) реакциясы бойынша азот оксидін диоксидке дейін тотығу үшін азотты газдарды өңдеуде қолданылады.
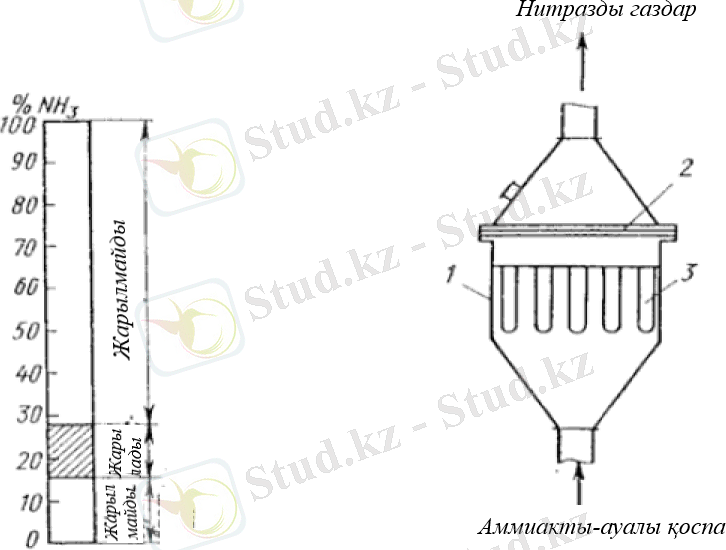
1-сурет. Аммиак-ауа қоспаларының жарылу шектері (температура 18ºС)
2-сурет. Аммиакты тотықтыруға арналған байланыс аппараттары:
1-қорап, 2-катализатор, 3-поролитті түтіктер
Аммиак-ауа қоспаларын құрастыру кезінде бұл қоспалардың белгілі бір аммиак құрамында жарылыс қаупі бар екенін ескеру керек. 1-суреттен көрініп тұрғандай, 18ºС аммиактың жарылғыш концентрациясының ауданы шамамен 16-28% құрайды. Өндірілген жағдайда олар аммиак мөлшері жарылғыш концентрациядан жоғары аммиак-ауа қоспаларымен жұмыс істейді .
Аммиак-ауа қоспасында белгілі бір қоспалардың болуы катализатордың улануына әкеледі. Мұндай қоспаларға фосфид сутегі, күкірт қосылыстары, шаң, тот, майлау майының булары жатады. Катализатормен жанасуды болдырмау үшін цехқа ауа зауыттың сыртында орнатылған қабылдау құбыры арқылы жеткізіледі және мұқият тазартылады. Газды ілулі қоспалардан шығаруға арналған жанасу аппаратының ішіндегі катализатордың алдына кеуекті - кеуекті (керамикалық) түтіктер орнатылады, оның кеуектері арқылы газ сүзіледі.
Аммиакты тотықтыруға арналған контактілі аппарат (2-сурет) цилиндрлік денеден 1 тұрады, оның ішінде катализатор бекітілген - платина-родий торлары 2 және кеуекті түтіктер пакеті 3. Аммиак-ауа қоспасы аппаратқа беріледі. төменнен, түтіктердің 3 тесіктері арқылы сүзіледі және барлық торлардан дәйекті түрде өтеді. Құрамында NO бар азотты газдар аппараттың жоғарғы жағынан шығарылады. Атмосфералық қысыммен жұмыс істейтін қондырғыларда пакет әдетте 3-4 торды, жоғары қысымда - 12-20 торды қамтиды.
Азотты газдарды азот қышқылына өңдеу
(4) және (5) реакциялар бір реакциялық аппаратта жүреді. Реакция (5) нәтижесінде түзілген азот оксиді қайтадан сумен жұтылатын NO 2 -ге дейін тотығады (5 реакция) т. б. Реакция (4) азотты газдарды өңдеу кезінде болатын барлық реакциялардың ішіндегі ең баяуы; сондықтан процестің жалпы жылдамдығы оған байланысты. Осының негізінде NO-ның NO 2 -ге дейін тотығуы интенсивті түрде жүретін жағдайларды анықтау керек, сөйтіп азотты азотты газдарды өңдеудің жоғары жылдамдығын қамтамасыз ету қажет.
NO-ның NO 2 -ге дейін тотығуы көлемнің азаюымен жүреді. Ле Шаталье принципі бойынша реакцияның тепе-теңдігін солдан оңға ауыстыру үшін қысымды арттыру қажет. Қысымның жоғарылауы бұл реакцияның тепе-теңдігінің ығысуына ғана емес, сонымен бірге оның үдеуіне де әкеледі. Сондықтан шамамен 10 кгс/см 2 қысыммен жұмыс істейтін қондырғыларда азот оксиді толығымен дерлік NO 2 -ге дейін тотығады.
Реакция (4) жылудың бөлінуімен жүреді, сондықтан тепе-теңдікті ауыстыру үшін процесті төмен температурада жүргізу керек. Температураның жоғарылауы көптеген реакциялардың жылдамдығын арттыратыны белгілі. Алайда, NO-ның NO 2 -ге дейін тотығуы сирек ерекшелік болып табылады, оның жылдамдығы температураның төмендеуімен артады. Сондықтан (4) реакцияның тепе-теңдігін жылжыту және оны жеделдету үшін процесті төмен температурада жүргізген орынды.
Азот диоксидінің сумен сіңірілуі (сіңуі) - соңғы сатысы азот қышқылымен өндіріледі. Сіңіру жүріп жатқанда, азот қышқылының концентрациясы артады. Бұл процесс NO тотығуы сияқты температураның төмендеуін және қысымның жоғарылауын қажет етеді.
Азотты газдарды өңдеу кезінде процесс атмосфералық қысымда жүргізілсе, 48-50% концентрацияда азот қышқылы алынады. Қысымды 10 кгс/см2-ге дейін арттыру концентрациясы 60-62% және одан жоғары азот қышқылын алуға мүмкіндік береді.
Сұйылтылған азот қышқылын алу схемалары
Қолданылатын қысымға байланысты сұйылтылған азот қышқылын өндіретін қондырғылар: 1) атмосфералық қысымда жұмыс істейтін; 2) жоғары қысыммен жұмыс істеу; 3) NO-ның тотығуы және NO 2 -нің сумен сіңірілуі жоғарылаған құрамдастырылған.
Атмосфералық қысыммен әлсіз азот қышқылын алу схемасы 3-суретте көрсетілген. Тазартылған ауа мен аммиак араластырғышқа 1 қатынаста келіп түседі, онда құрамында 10-12% NH 3 ауа-аммиак қоспасы алынады. Араластырғыштан 1 қоспа платина-родий торлары орналастырылған контактілі аппаратқа 2 жіберіледі.
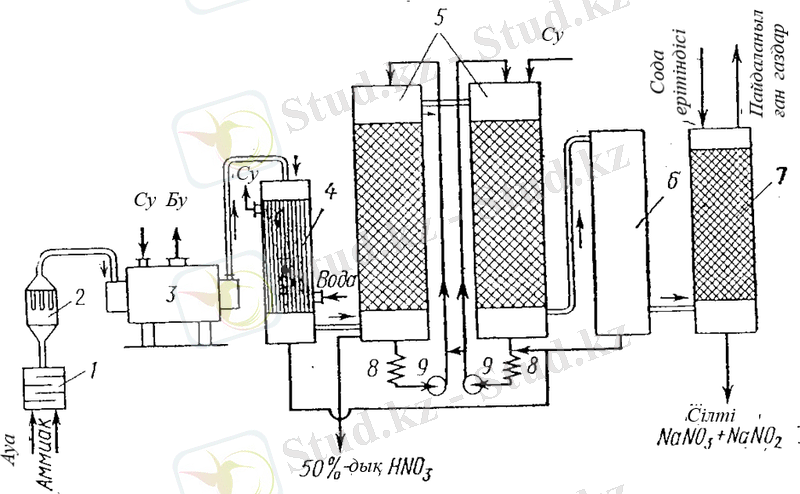
3-сурет. Атмосфералық қысымда әлсіз азот қышқылын алу схемасы:
1-араластырғыш, 2-контактілі аппарат, 3-жылуды қалпына келтіретін қазан, 4-тоңазытқыш, 5-азот қышқылы мұнарасы, 6-тотықтырғыш мұнара, 7-сілтілі сіңіру мұнарасы, 8-тоңазытқыш, 9-сорғы;
Байланыс аппаратының шығысындағы азотты газдардың температурасы шамамен 800ºС деңгейінде сақталады. Аммиактың азот оксидіне дейін тотығу дәрежесі шамамен 97-98% құрайды. Қалдық жылу қазандығында 3 газ температурасы 250ºС дейін төмендейді. Содан кейін газдар су буының жартылай конденсациялануы және азот оксидінің диоксидке дейін тотығуы бар құбырлы салқындатқышта 4 сумен 30ºС дейін салқындатылады. Сондықтан әлсіз азот қышқылы тоңазытқыштарда жартылай түзіледі, ол мұнараларды суаруға жіберіледі 5.
Сіңіру бөлімі суды (қышқыл деп те атайды) сіңіру тіректерін 5, тотықтырғыш мұнараны 6 және сілтілі сіңіру мұнарасын 7 қамтиды. Тоңазытқыштан шығатын газдар мұнаралар арқылы дәйекті түрде қозғалады. Әдетте, суды сіңіру үшін тізбектей жалғанған алты-сегіз мұнара орнатылады, ал сілтілі сіңіру үшін екеуі.
NO 2 жұтуға қажетті су газ ағынындағы соңғы мұнараға беріледі 5. Алынған қышқыл сорғылардың көмегімен барлық мұнаралар арқылы рет-ретімен айдалады 9. Өнім - 50% азот қышқылы газ ағынында бірінші мұнарадан шығарылады. Су сіңіру мұнаралары 5 азот оксидтерінің шамамен 92% азот қышқылына айналдырады. Су сіңіру мұнараларының артында мұнара 6 орнатылады, ол арқылы өткеннен кейін азотты газдар 7-мұнарадағы сода ерітіндісімен (сілтілі абсорбция) абсорбцияға түседі. Келесі реакция жүреді:
2NO 2 +Na 2 CO 3 →NaNO 3 +NaO 2 +CO 2 (8)
Алынған ерітінді құрамында натрий нитраты (натрий нитраты) және натрий нитриті (натрий нитриті) 50% азот қышқылымен өңделеді, нәтижесінде реакция нәтижесінде азот оксидтері бөлініп, нитрат түзіледі.
3NaNO 3 +2HNO 3 →3NaNO 3 +2NO+H 2 O (9)
Бөлінген азот оксиді сумен тотығу және сіңіру процесіне қайтарылады. Құрамында натрий нитраты бар ерітінді буланып, одан NaNO 3 (натрий нитраты) кристалданады, ол тыңайтқыш ретінде қолданылады.
Жоғары қысымда (80-10 кгс/см 2 дейін) сұйылтылған азот қышқылын алу схемасы оның атмосфералық қысымдағы өндірісінен принципті түрде айырмашылығы жоқ. Бірақ жоғары қысымда жұмыс істейтін зауыттардың бірқатар артықшылықтары бар: азот оксидтерін азот қышқылына өңдеу дәрежесі 98-98% дейін, ал алынған азот қышқылының концентрациясы - 60-62% дейін; сілтілі сіңу қажет емес; қондырғының құрылысына күрделі шығындар және аппараттарды жасау үшін арнайы болат шығыны азаяды, өйткені сіңіру колонналарының көлемі атмосфералық қысыммен жұмыс істейтін жүйелерге қарағанда он есе аз. Бұл ретте қысымды пайдалану катализатордың жоғалуы мен энергияны тұтынудың жоғарылауымен байланысты, бұл осы қондырғылардың кемшілігі болып табылады.
Комбинирленген зауыттарда азот қышқылын өндіру алдыңғы екі схеманың да артықшылықтарын пайдалануға мүмкіндік береді. Атмосфералық қысымда аммиактың тотығуын жүргізу жоғары қысымды қондырғыларда сөзсіз болатындармен салыстырғанда платинаның жоғалуын азайтуға мүмкіндік береді. Бұл ретте азотты газдарды қысыммен өңдеу 60-62% қышқыл алуға мүмкіндік береді, сілтілі өңдеу қажеттілігін жояды, күрделі шығындарды азайтуға көмектеседі, аппараттың көлемін азайтуға мүмкіндік береді. Осы типтегі қондырғыларда азот оксидтерін сіңіру 3-9 кгс/см2 қысымда жүзеге асырылады. Аралас қондырғылардың кемшіліктері агрессивті азотты газдарды сіңіру алдында сығуға ұшырау фактісін қамтиды.
Қазіргі уақытта 700-1200 тонна/тәулігіне 100% азот қышқылын өндіретін жоғары қуатты қондырғылар өндірістік тәжірибеге көбірек енгізілуде. Кейбір өсімдіктерде аммиак 3, 5-4 кгс/см 2 қысымда тотығады, ал азот оксидтері 10 кгс/см 2 және одан жоғары қысымда жұтылады. Аммиактың тотығуы кезінде бөлінетін жылу және NO-ның NO 2 -ге тотығу жылуы ауа мен азотты газдарды жоғарыда көрсетілген қысымға дейін сығуға қажетті электр энергиясын өндіруге жұмсалады.
Заманауи жоғары электр станциялары, сондай-ақ біріктірілген электр станциялары күрделі шығындардың төмендігіне кепілдік береді, бірақ сонымен бірге басқа жүйелермен салыстырғанда энергияны тұтынудың айтарлықтай төмендеуіне кепілдік береді. Әртүрлі қондырғылардың өнімділік көрсеткіштерін салыстыру 2-кестеде келтірілген.
Аммиак, т
Платина катализаторы, г
Электр энергиясы, кВт*сағ
0, 287-0, 290
0, 045-0, 049
115
0, 290-0, 295
0, 155-0, 170
360-380
0, 287-0, 290
0, 045-0, 049
230-260
0, 280-0, 282
0, 09-0, 100
8
Кесте 2. Азот қышқылын алу әдістерін салыстыру
2-кесте деректері төмен күрделі шығындармен жұмыс істейтін қысымды жүйелер атмосфералық қысымды қондырғылармен (электр энергиясы, платина) салыстырғанда жоғары операциялық шығындарды талап ететінін растаңыз.
Абсорбциялық колонналардан шығатын газдардағы азот оксидтерінің мөлшері 0, 05-0, 1% құрайды. Азот оксидтері ауа бассейнін уландыратындықтан, газдарды арнайы «санитарлық тазарту» қажет. Ол газдарды 380-480ºС дейін қыздырып, табиғи газбен араластырып, катализатор (палладий глиноземі және белсенді глинозем) азот оксидтерін элементар азотқа дейін төмендететін реакторға жіберілуінен тұрады. Нәтижесінде азот оксидтерінің мөлшері 0, 004-0, 006%-ға дейін азайып, 100 метрлік құбыр арқылы газдар атмосфераға шығарылады.
2. 3. Концентрлі азот қышқылын алу
Кейбір салалар сұйылтылған емес, HNO3 мөлшері 96%-дан жоғары концентрлі азот қышқылын қажет етеді. Бұл концентрациядағы азот қышқылын сұйылтылған азот қышқылын концентрлеу арқылы немесе тікелей синтездеу арқылы алуға болады.
Сұйылтылған азот қышқылының концентрациясы.
Концентрлі азот қышқылын алу үшін сұйылтылған HNO3 суды тартып алатын күкірт қышқылының қатысуымен буланады.
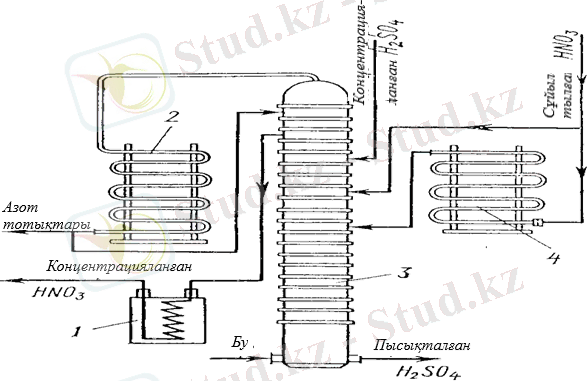
4 сурет. Концентрлі азот қышқылын өндіруге арналған қондырғы:
1-тоңазытқыш, 2-конденсатор, 3-колонна, 4-буландырғыш
4-суретте сұйылтылған азот қышқылының концентрациясының қондырғысының принциптік схемасы көрсетілген. Концентрлі күкірт қышқылы 3-бағанға жоғарғы науалардың біріне түседі. Колоннаға сәл төменірек, шамамен 50% HNO 3 бар сұйылтылған азот қышқылы беріледі. Оның бір бөлігі 4-буландырғыштан өту арқылы буланады. Азот қышқылының ыдырауы нәтижесінде түзілген су буы мен азот оксидтері аз азот қышқылының булары 3-колоннан 2-конденсаторға жіберіледі, онда азот қышқылы конденсацияланады және азот оксидтері ұсталады. Азот оксидтерінің бір бөлігі азот қышқылында ериді, сондықтан ол 2-конденсатордан колоннаның жоғарғы науасына оралады, онда ол колоннан шыққан азот қышқылы буымен тазартылады, содан кейін өнім ретінде 1-тоңазытқышқа шығарылады. Қалдық сұйылтылған күкірт қышқылы (70) %) колоннаның түбінен ағып, булану үшін суытпай кетеді.
Азот қышқылының тікелей синтезі.
Бұл әдіс аммиак тотығуының азотты газдарынан концентрлі азот қышқылын тікелей алуды қамтиды. Бұл әлсіз азот қышқылын алу, оның концентрациясы, күкірт қышқылын булану процестерін жоққа шығарады. Процесс азот газдарының құрамындағы азот оксидінің тотығуынан тұрады, нәтижесінде NO2 пайда болады, ол шамамен -8ºС дейін салқындаған кезде N2O4 түзілуімен сұйық күйге айналады. N2O4 сұйықтығынан азот қышқылының тікелей синтезі сумен және оттегімен әрекеттескенде жүреді:
2N 2 O 4жидк +2Н 2 О+О 2 =4 HNO 3 (10)
Бұл реакция 50 кгс/см 2 қысымда және шамамен 75°С температурада жүргізіледі.
2. 4 Өндіріс әдісін таңдау
Азот қышқылын өнеркәсіпте каталитикалық жолмен аммиактың атмосфералық оттегімен тотығуы, содан кейін азот оксидтерін сіңіру (концентрлі емес) және суды кетіретін агенттер (күкірт қышқылы немесе магний нитраты балқымасы) қатысуымен 56-60% азот қышқылын айдау және тікелей синтездеу (концентрлі) арқылы алады.
Өндірістік процестің шарттарына байланысты схемалардың түрлері бар: 1) 0, 716 МПа қысымда жұмыс істейтін схема.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz