Мырыш сульфатты ерітіндісінен мырыш электролизінің теориясы мен тәжірибесі


ЗЕРТХАНАЛЫҚ ЖҰМЫС 1.
«МЫРЫШ СУЛЬФАТТЫ ЕРІТІНДІСІНЕН МЫРЫШ ЭЛЕКТРОЛИЗІ»
- Жұмыс мақсаты«Мырыш сульфатты ерітіндісінен мырыш электролизі» тақырыбы бойынша теориялық мәліметтерді бекіту. Мырыш сульфатты ерітінділерінде электролиз өткізу бойынша тәжірибелік мағлұмат алу. Электролиттік бекітпелердің схемасын сызу бойынша тәжірибелік дағды алу. Мырыш электролизі бойынша сандық есеп-қисап жасау бойынша тәжірибелік дағды алу.
- Шартты белгілеу мен қысқартулар.
φ 0 - стандартты потенциал, В
m - зат мөлшері, г
Э - химиялық эквивалент, г/экв
Q - электр мөлшері, Кл
I - ток күші, А
t - уақыт, с
F - Фарадей тұрақтысы 96500 Кл
- Құралдар мен реактивтер
Зертханалық жұмыста келесі құралдар мен реактивтер қолданылады:
- ауыспалы токты түзеткіш;
- реостат;
- вольтметр;
- амперметр;
- электролит кішкене былауы;
- қорғаныс анодтары;
- алюминий катодтары;
- мырыштың күкіртті қышқылды ерітіндісі;
- термометр;
- Қауіпсіздік техникасының ережелеріЖұмысты бастау алдында барлық құралдардың түзүлігің және бүтіндігін тексеріп алу қажетСхеманы құрастырғанда барлық түйіндерді және қосылуларды бейтараптандыру қажет. Схеманы өшірілген электр қорегі кезінде құрау және таратып алу.
1. 5 Теориялық бөлім
1. 5. 1 Электролиз кезіндегі сапалы арақатынас.
Электролиз - электролит ішіне енгізілген электродтар арқылы электр тогы өткен кездегі тотығу, қалпына келу электрохимиялық процесстерінің жиынтығы.
Электролиз мырыштың гидрометаллургиялық өндірісінің ең соңғы сатысы болып келеді. Электірлік тұндыру арқылы алынған катодты мырыш құрамы бойынша торайдық метталдан айырмашылығы аз.
Электролиз процессінің маңызы келесіде: электролит күміс қоспаланған анод пен алюминий катоды бар электролизді кішкене былауыларына түседі. Кішкене былау арқылы тұрақты электр тогы жіберіледі. Электролитте анодтан катодқа ток өткен кезде алюминий катодтарында металлданған мырыш тұнады.
Электролиз процессі кезінде электролиттің температурасы Джоуль жылуы арқылы көтеріледі. Ерітіндінің берілген темперетурасын сақтау үшін электролитке мәжбүрлік салқындату қолданылады.
Таза сульфатты ерітіндіден мырышты тұндыру электрохимиялық процессін келесі теңдеу арқылы көрсетуге болады:
ZnSO 4 + H 2 O = Zn + H 2 SO 4 + 0, 5O 2 (1)
Тұрақты токтың әсерінен, нақтырақ кернеу әсерінен катиондар теріс зарядталған электрод - катодқа, ал аниондар оң зарядталған - анодқа қарай жүреді. Электродқа жақындағанда катиондар мен аниондар бәсеңдейді, ерітіндіден атомдық қалпында шығады. Катиондар мен аниондардың разряды электрондардың қосылуы мен айырылуымен қоса жүреді.
Мырыш электролиз процессінде оң зарядталған иондар мырыш иондары болады - Zn 2+ , ал сутегі - Н + , ал теріс зарядталған - SO 4 2- және ОН - .
Катодты процесс. Катодта келесі реакциялар жүреді:
Zn 2+ + 2e = Zn (2)
2Н + 2e = Н 2 (3)
Мырыштың стандарттық кернеуі - 0, 763 В, ал сутегінің ±0, 000 В. Кернеу қатарына сәйкес катодта сутегі иондарының бәсеңдеу процессі жүру керек. Бірақ электролиздің тәжірибелік жағдайында катодта айрықша мырыш тұнады және сутегіні бөліп шығару үшін кететін электроэнергия шығыны 10-12% жалпы шығыннан аспайды. Бұл сутегі иондары разрядының жоғары дәрежедегі асқын кернеуімен сипатталады, соның арқасында оның кернеуі кейбір жағдайларда мырыш кернеуінен терісірек болады.
Сутегінің асқын кернеуі катодтың материалына байланысты, ток тығыздығына, катод бетіне байланысты, температураға, электролиттегі сутегі иондарының және басқа иондардың шоғырлануына байланысты болып келеді.
Қорғанысты анодта келесі электрхимиялық процесстер өтеді:
Басында анодтың -0, 34В кернеуінде қорғасын ериді, ол күкіртті қышқыл ертіндісінде аз еритін тұз түзеді PbSO 4 :
Pb -2
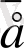 + 2SO
4
2+
= PbSO
4
(4)
+ 2SO
4
2+
= PbSO
4
(4)
Анод бетінде қорғаныс сульфаты кристаллданады және оның үстінде электрлік токты бәсең өткізетін қабыршақ құрайды. Металл ауданының кішіреюіне байланысты анодтағы ток тығыздығы көбееді, анод кернеуі электірлік оң жаққа қарай жылжиды.
Анод кернеуі +0, 65В жеткен кезде қабыршақтағы ұсақ тесіктерде қорғасын келесі теңдеу бойынша тотығады:
Pb - 4е + 2Н 2 O = PbO 2 + 4Н + (5)
Қабыршақтағы ұсақ тесіктер қорғаныс тотығымен жабылған сәтте (ол PbSO 4 -ға карағанда оданда жаман ток өткізеді) басында анодтың поляризациясы қайтадан басталады. Анод кернеуі +0, 95В жеткенде қайтадан PbSO 4 тотығу процессі жүреді:
PbSO
4
- 2
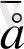 + 2Н
2
O = PbO
2
+ Н
2
SO
4
+ 2Н
+
(6)
+ 2Н
2
O = PbO
2
+ Н
2
SO
4
+ 2Н
+
(6)
Бұл процесстің жүруі кезінде анодтың бүкіл үстін PbO 2 қабыршағымен қапталады және оның үстінде анод кернеуі +1, 229В жеткенде келесі оттегі бөлу процессі өтеді:
2Н
2
О - 4
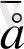 = 4Н
+
+ О
2
(7)
= 4Н
+
+ О
2
(7)
PbO 2 үстінде оттегі бөлу асқын кернеумен жүретіндіктен, анодтың реалды кернеуі +1, 229В-дан көбірек асатын болады.
Қорғасын анодтары кемшіліксіз емес, оларға асқын кернеудегі оттегі бөлінуі, мырышты катодты ластайтын қорғаныстың аздап еруі, электролиз процессінде анод деформациясы жатады.
Қазіргі кезде анод орнына қорғасын мен күмістің қорытпасы қолданылады (0, 75% Ag) .
Мырыш электролитінде марганец (Mn 2+ ) иондары бар, олар анод процессіне әсер етеді:
Mn
2+
- 2
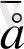 + 2Н
2
O = MnO
2
+ 4Н
+
(8)
+ 2Н
2
O = MnO
2
+ 4Н
+
(8)
Mn
2+
- 5
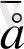 + 4Н
2
O = MnO
4
+ 8Н
+
(9)
+ 4Н
2
O = MnO
4
+ 8Н
+
(9)
(8) процесстің жүруі жағымсыз, өйткені MnO 2 шлам құрады, егер ол анодтың кеңістігіне түсетін болса, онда міндетті түрде Mn 2+ түріне қайтып келеді. Бір жағынан MnO 2 ерімейтін анод үстінде тұнып электролитке анодтан баратын қорғасын мөлшерін азайтады.
1. 5. 2 Электролиз кезіндегі мөлшерлік қатынастар.
Электролиздің мөлшерлік заңдылығы Фарадейдің екі заңына сүйенеді.
Фарадейдің бірінші заңы. Электродта бөлінген зат массасы электролитте өткен электр мөлшеріне тура пропорционал.
Фарадейдің екінші заңы. Электролиз кезінде бірдей электр мөлшерлері электродтарда заттың эквивалентті массасын бөледі.
Фарадейдің екі заңын біріктіретін формула келесі түрде болады:
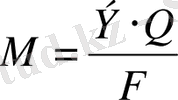 (10)
(10)
Q=I*t болғандықтан:
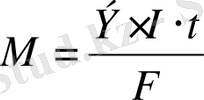 (11)
(11)
Егер Q=1 Кл, онда М= Э / 96 487 = Е, (12)
мынадғы Е - электрохимиялық эквивалент, г/Кл.
Егер электролиз заты газ типті болса онда оның көлемін келесі формула арқылы есептеп алуға болады:
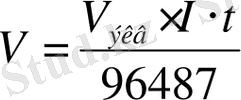 (13)
(13)
Электролиз кезінде тәжірибеде Фарадей заңдары бойынша есептелгеннен заттың мөлшері аз болады, өйткені негізгі процесстермен қоса кері процесстер де жүріп жатады, сондықтан ток бойынша шығу өте маңызды қасиет болып келеді, ол келесі формуламен есептелінеді:
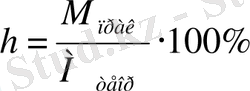 (14)
(14)
1. 5. 3 Электролиз процессінің технико-экономикалық көрсеткіштері.
1. 5. 3. 1 Ток бойынша шығу.
Фарадей заңы бойынша есептелген мырыштың фактілік және теориялық мөлшерлерінің қатынасы, белгілі мөлшердегі ток өткен кездегі уақытта, ток бойынша шығу деп аталады немесе токты қолднау коэффициенті (процентпен есептелінеді) .
Фарадей заңы бойынша кез-келген заттың бір грамм-эквивалент бөліп алу үшін 96500 Кулон электр қуатын жұмсау қажет, ол дегеніміз 26, 8 А/с. Бұл шама заттың электрохимиялық эквиваленті деген атпен белгілі.
Бір ампер-сағат өткенде катодта 1, 219 г мырыш бөліну керек, бірақ ол теориялық жағдайда ал практика жүзінде мырыш аз түзілетіні анық. Ток бойынша шығу әрдайым 100% -дан аз. Оның себебі мынада: катодта негізгі мырыш иондарының разрядталуымен қатар кері электрохимиялық процесстердің жүруі.
Мырыш электротұнбасын жақсарту үшін электролитке әрқашан аз мөлшерде коллоид (желім, желатин және т. с. с) қосады. Олар құрылысы ұсақкристалды тегіс тұнба түзу үшін қолданылады.
Коллоидтар сутегінің асқын кернеуін көбейтеді, бірақ электролизге электролиттің кедергісін көбейту арқылы зиян келтіреді.
Сонымен, электролиз кезінде ток бойынша шығуды көбейту үшін келесі ережелерді сақтау қажет:
- мүмкіндігінше таза электролиттің болуы,
- электролиттегі күкірт қышқылының концентрациясының жоғары болуы,
- ток тығыздығының жоғары болуы,
- элоктролиттің электрөтімділігі жоғару болуы,
- электролит айналып жүруі жақсы болу,
- электролит температурасы төмен болуы.
1. 5. 3. 2 Былаудағы кернеу.
Электролит арқылы ток өкізгенде мырыш сульфатының катодқа метеллдық мырыш ал анодқа оттегінің бөлінуі жүреді.
Мырыш сульфатының бөлінуі басталу үшін сыртқы көзден электордқа минималды кернеу беру қажет. Бұл ең кішкентай кернеу айырымы осы аталған электролиз процессінің жүруіне қажет бөліну кернеуі.
Былаудағы электродтар бір-бірімен параллель қосылға, сондықтанда электродтар арасындағы кернеу былаудағы кернеуді сипаттайды.
Былаудығы мырыш сульфатының бөліну кернеуі теория бойынша 2, 35-2, 45 В құрайды. Зауыт практикасында былаудағы фактілік кернеу 3, 2-3, 6 В арасында болады. Былаудыағы теориялық және фактілік кернеу айырмашылығы былау кедергісімен, электродтардың поляризациялануымен түсіндіріледі.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz