Атом құрылысы, электрондық орбитальдар мен периодтық заң


Н 3-1. 1. 37-2022
I баспа 02. 02. 2022

ҚАЗАҚСТАН РЕСПУБЛИКАСЫНЫҢ БІЛІМ ЖӘНЕ ҒЫЛЫМ МИНИСТРЛІГІ
М. Х. ДУЛАТИ АТЫНДАҒЫ ТАРАЗ ӨҢІРЛІК УНИВЕРСИТЕТІ
Кафедра:
пәні бойынша
СӨЖ
Тақырыбы:
Студент
Курс
Топ
Оқытушы
Тараз 2023ж
Мазмұны:
Кіріспе . . . 3
Негізгі бөлім . . . 4
Атом құрылысының ядролық (планетарлық) теориясы . . . 4
Құрылысы . . . 7
Атом құрылысы және периодтық заң . . . 9
Электрондық және электрондық-графикалық формулалар . . . 12
Қорытынды . . . 15
Пайдаланылған әдебиеттер . . . 15
Кіріспе
Атом ұғымын материяның ең аз бөлінбейтін бөлігі ретінде алғаш рет ежелгі үнді және ежелгі грек философтары тұжырымдады (қараңыз: атомизм) . XVII және XVIII ғасырларда химиктер бұл идеяны эксперименталды түрде растай алады, бұл кейбір заттарды химиялық әдістерді қолдана отырып, құрамдас элементтерге бөлуге болмайтынын көрсетті. Алайда, XIX ғасырдың аяғы мен ХХ ғасырдың басында физиктер атомның субатомдық бөлшектерін және құрама құрылымын ашты, ал атомның аты берілген нақты бөлшек іс жүзінде бөлінбейтіні белгілі болды.
1860 жылы Карлсруэде (Германия) өткен халықаралық химиктер съезінде молекула мен атом ұғымдарының анықтамалары қабылданды. Атом-қарапайым және күрделі заттардың құрамына кіретін химиялық элементтің ең кіші бөлшегі.
Негізгі бөлім
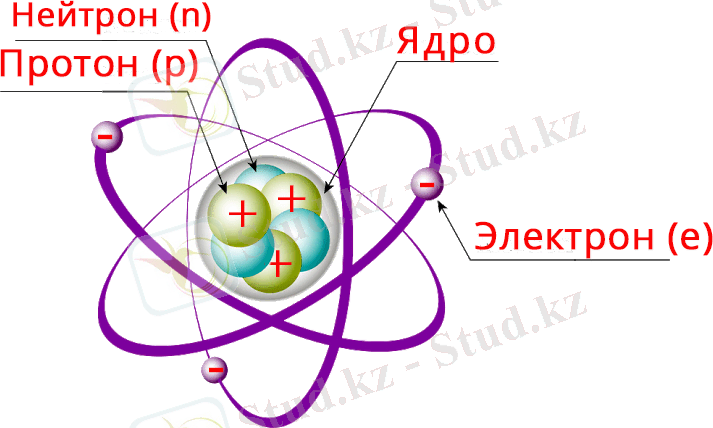
Атом құрылысының ядролық (планетарлық) теориясы
XIX ғасырдың аяғы мен XX ғасырдың басында ашылған физика мен химияның ұлы жаңалықтары: катод сәулелерінің, электролиз құбылысының, радиоактивтіктің ашылуы атом құрылы-сының күрделі екенін және оның құрамына электрондар кіретінін көрсетті. Электрон заряды теріс, массасы протон массасының 1/1840 бөлігіне тең бөлшек. Атом электронейтрал бөлшек бол-ғандықтан электрондардың теріс зарядтарын нейтралдап тұратын атом құрамына кіретін оң зарядтар болуға тиіс. Атом қүрамына оң зарядты бөлшектер кіретінін 1911 жылы ағылшын ғалымы Э. Резерфорд тәжірибе арқылы дәлелдеді Орасан көп атомдар арқылы өткен сәулелердің тек кейбіреулёрі ғана бағытын өзгертеді. Бұдан атомның құрамындағы оң зарядтар шоғырлапған белшектің көлемі өте кіщкентай екенін байқауға болады. Осы тәжірибе негізінде Э. Резерфорд атомның планетарлық теориясын ұсынды. Бұл теория бойынша атомның ортасында оң. зарядталған ядро болады, оны электрондар орбиталар бойынша айналып жүреді. Атом электро нейтрал болғандықтан ядродағы оң зарядтардың саны, оны айналып жүрген электрондар зарядтарының са-нына тең. Электрондар массасы өте аз шама болғандықтан, атомның барлық массасы ядроға шоғырланған. Ядроның көлемі атомға қарағанда өте кішкентайЖгер атом, ядро, электрон шар тәрізді десек, атомның диаметрі 10 10 м, ал ядроның диаметрі 10~ 15 м болады, яғни ядро атомынан 100 000 есе кіші болады. Бұдан былайғы зерттеулер ядродағы оң зарядтардың саны Д. М. Менделеевтің периодтық жүйесіндегі элементтің реттік номеріне тең екенін керсетті. Сонымен элемент атомы ядросындағы оң зарядтардың саны жете оны айналып жүретін электрондардың саны элементтің. реттік нөміріне тең. Мысалы, кальцийдің периодтық жүйедегі реттік нөмірі 20. Бүдан кальций атомының ядросында 20 оқ за-ряд бар екенін және оны 20 электрон электрондық қабаттарда. айналып жүретініы білуге болады. Атомдардың электрондық құрылысы Н. Борусынған атом қүрылысының теориясы алуан түрлі болада деп тұжырым жасаған. Э. Резерфордтың атом қүрылысының планетарлық теориясы атомның оң зарядты бөлшектері мен негізгі массасы көлемі өте кішкентай ядроға жинақталғанын, ал электрондар электрондық қабаттарда ядроны айналып жүретінін көрсетті. Э. Резерфорд теориясының мынадай кемшіліктері болды: біріншіден, электро-динамика заңдарына сәйкес, ядроны айналып жүрген электрон үздіксіз энергия бөлудің нәтижесінде энергия орын тауысып ядроға қүлап түсер еді де, атом жойылар еді, бірақ атом жойыл-майтын түрақты жүйе. Екіншіден, электрон спираль бойынша қозғалғанда атом энергиясы да үздіксіз азайып, атомның спектрі де үздіксіз болу керек еді, бірақ тәжірибе барлық атомдардын, спектрлерінің сызықша тәріздес екеыін дәлелдеп отыр. Бұл ай-тылғандардан классикалық физиканың заңдары атом қүрылы-сының қүбылыстарын түсіндіре алмайтынын көрсетті. ч ; ь ^1913 жылы Дания ғалымы. Нильс Бор сутек атомы құрылы-сының теориясын ұсынды. Бұл теорияны жасауда ол 3. Резер-фордтың планетарлық моделін және М. Плаңктың сәуле шығарудың кванттық теориясын негізге алды. Кванттық теория бойынша заттар энергияны жеке-жеке порцріялар - кванттар түрінде сіңіреді немесе бөліп шығарады: мұнда һ - Планк тұрақтысы, V - тербеліс жиілігі. Бор электронның ядроға құламайтъін себебі электрон ядроны аиналғанда паида болатын орталықтан тебетін күш электронның ядроға тартылу күшімен - теңестіріліп түрады деген пікірге келді: Ч. Бордың II постулаты. Электрон бір тұрақты орбитадан екін-ый тұрақты орбитаға көшкенде атом квант түрінде энергия сіңі-реді немесе бөліп шығарады: Е = һ-у, мұндағы V - тербеліс жиілігі. Электрон жақын орбитадан алыс орбитаға көшкенде атсш квант түрінде энергия сіңіреді, ал электрон алыс орбитадан жа-қын орбитаға көшкенде атом энергия бөліп шығарады. Сутек атомы үшін п= болса, оны атомның қалыпты күйі дейді, ал гс = 2, 3, 4 болса, атомның қозған күйі дейді. Қозған күйде электрон өте аз уақыт болады да квант түрінде знергия бәліп шығарып, қайтадан қалыпты (түрақты) күйге кө-шеді. Бор электрон тек материалдық бөлшек, ол ядроыы белгілі орбпта бойыиша айиалып жүреді деп есептеді. Бүл Бор теория-сының кемшіліктері еді. Кванттық мехаиика т ұ рғ ы с ы н а н а т о м д а р -дағы электрондардың күйі. Кванттық механика - микробөлшектердің - молекулалар-дық, атомдардың қозғалыстары мен әрекеттесулерін зерттейді. Кванттық теория бойынша электрон әрі материалдық бөлшек-тің, әрі толқынньщ қасиеттерін көрсетеді. Оның материалдық бөлшек сияқты белгілі массасы болады, қысым туғызады, сонымен бірге электрондар қозғалғанда тол-қындық қүбылыстар байқалады. Толқындық қасиеттері бар электрон өте шапшаң қозғалып ядро төңірегіндегі кеңістіктің кез келген бөлігінде бола алады. Сондықтан қазіргі көзқарас бойынша электрон ядро төңірегінде белгілі тығыздығы бар теріс зарядтардың электрон бүлтыы түзеді. Электрон бұлтының мөлшерін, пішінін және кеңістіктегі ор-паласу бағытын көрсететін электронның күйін атомдық электрондық орбиталь дейді. Сондықтан бүдан былай орбита, электрон бұлты деген терминдердің орнына о р б и т а л ь деген термин қолданылады. Орбитальдар бір-бірінен өздерінің энергиялары, пішіндері және кеңістіктегі орналасу бағыттары арқылы ажыратылады және бүл жағдайлар электрон қасиеттерінің кваыттық сипатын көрсетеді^ондықтан электронның атомдағы күйін 4 квант сан-дарының мәндері-сипаттайды. І. Бас квант саны п. Бас квант саны п электрондардық жалпы энергия қорын жәые электрондар орналасқан деқгейлер-дің ядродан қашықтығын керсетеді. Бас квант санының мәндері бүтін сандармен, ал оларға сәйкес келетін энергетикалық деңғейлерді латынша бас әріптермеи белгілейді:
Бас квант саидары 1, 2, 3, 4, 5, 6, 7;
Энергетикалық деңгей К, I, М, N. О } Р, 0.
2. О р б и т а л ь к в а н т саны. Атом спектрлерін зерттеу жеке сызықтардың бірнеше жіңішке сызықшаларға белінетініы көрсетті, ал әр сызықша атомдағы злектрон э. енергиясының кванттық күйін көрсете-тіндіктен әрбір энергетикалық деңгейдің энерге-тикалық деңгейшелерден түратыны дәлелденді. Энергетикалық деңгейде-гі деңгейшелердің санын орбитальдық квант санының мәндері анықтайды. Электрондар орналасқан деңгейшелерді қабатш а л а р дейді.
3. М а г н и т к в а н т с а н ы пішіндері бірдей орбитальдардың кеңістікте орналасу бағытын көрсетеді (2-сурет) . Магнит •квант саны орбиталь квант санына тәуелді болады және осы орбмталь квант слнының мәніне сәйкес -/, 0, +/ шегінде бола-тын бүтін сандармен көрсетілген мәндері болады. Магнит квант саны деңгеншелердегі орбитальдардың сандарын да анықтайды (2-кесте) . б р, й-орбитальдарының кеңістікте орналасу бағыт-тары 2-суретте келтірілген. Сонымен / = 0 болғанда оған сәйкес келетін 5-децгейшеде шар тәрізді бір орбиталь кеңістікте бір ба-ғытта ориаласады, /=1 болғанда оған сәйкес келетін р-деңғей-шеде ор түрлі бағытта орналасқан 3 орбитальдар, 1 = 2 сәйкес келетін й-деңгейшеде әр түрлі бағытта орналасқан 5 орбиталь-дар, ал / = 3-ке сәйкес келетін /-деңгейшесінде 7 орбитальдар бар екенін көреміз
4. С п и н к в а н т с а н ы т 5 электронның өз осінен қай бағытта қозғалатынын көрсетеді. Электрон өз осінен сағат тілі-нін бағыты бойыыша немесе оған қарсы бағытта қозғалуы мүмкін. Атомдардың энергетикалық деңгейлері мен деңгейшелеріндегі электрондардың максималь сандары тұратын мәндері болады. Графикалық түрде электрон спинін жоғары немесе төмен бағытталған стрелкалармен белгілейді. Паули принципі. Атомдардың спектрлерін зерттей келіп швейцария ғалымы В. Паули (1925 ж. ) мынадай ереже немесе приндип ұсынды: атомда төрт квант сандарының мэндері бірдей болатын екі электрон болмайды. Бұл принциптен шығатын салдар бойынша бір орбитальда екі электроннан артық болмайды. Жоғарыда келтірілген бас (п), орбитальдық (/), магнит (гПі ) квант сандарының мәндерін және Паули принципін папдалана отырып атомдардың деңгейлері мен деңгейшелеріндегі электрондардың үмкін болатын максималь саыдарын есептеп шығаруға болады.
Құрылысы
Атом бүтіндей алғанда зарядсыз, бейтарап бөлшек. Ол ортасында өзінен радиусы 10 4 -10 5 есе кіші көлемді алып жатқан оң зарядты ядродан және оны айнала қозғалып жүрген теріс зарядты электрондардан тұрады. Атом өзінің сыртқы бір немесе бірнеше электрондарын жоғалтқанда оң, ал сырттан электрон қосып алғанда теріс ионға айналады. Атомның сызықтық өлшемдері ~ 10 -8 см, көлденең қимасының ауданы ~10 -16 см 2 , көлемі ~10 -24 см 3 . Борлық атом теориясында ең қарапайым атом - сутегі атомы. Оның радиусының дәл белгілі бір мәні бар және ол мүмкін болатын ең кіші айналу орбитасының радиусы шамасына тең: a=0. 53 * 10 −8 см (дәлірек, 0. 52917*10 -8 см) . Атомның массасы, негізінен оның ядросының массасына тең және ол массалық санға (А), яғни протондар мен нейтрондардың жалпы санына (нуклондардың жалпы санына) пропорционал болып ұлғаяды. Өйткені атомдағы электронның массасы (0. 91*10 -20 г) бір протонның немесе нейтронның массасынан (1. 67*10 -24 г) 1. 840 есе аз. Сондықтан атомның ауырлық орталығы ядроға дәлдей келеді. Атом массасы ядро массасымен ондағы электрондар массаларының дәл қосындысына тең емес. Олардың арасындағы айырым атомның байланыс энергиясын анықтайды. Атомның ішкі энергиясының тек дискретті (үздікті) мәндері болады. Оның ең төменгі деңгейі атомның негізгі күйі E 1 (ол ең тұрақты, шексіз ұзақ өмір сүретін күйі), ал жоғарғы энергия деңгейлері қозған күйлер Е і (і=2, 3, …) деп аталады, (ол аз өмір сүреді) . Қозған күйден ~10 -8 сек. ішінде атом негізгі күйге ауысып отырады. Осындай ауысу кезінде атомға осы екі деңгейінің айырымына тең (hν=E ν -E 1 , мұндағы h - Планк тұрақтысы, ν - ұшып шыққан сәуле квантының жиілігі) сырттан энергия берілуі не шығарылуы шарт. Атом энергиясының дискретті квантталуы оның құрамындағы бөлшектердің толқындық қасиетінің болуынан. Атомның осындай қасиеттерін кванттық теория ғана толық түсіндіре алады. Бұл теория бойынша атомдағы электронның күйі 4 кванттық санмен анықталады. Олар: электрон энергиясын анықтайтын бас кванттық сан (n), атомның осындай импульс моментін анықтайтын орбиталық кванттық сан (l), ал (l) -дың берілген оське түсірілген проекциясын анықтайтын магниттік кванттық сан (m) және электронның ішкі спинін анықтайтын кванттық сан (m s ) .
Осы 4 кванттық сан мен Паули принципі атомдағы электрондардың барлық күйлерін сипаттайды. Сонымен бірге кванттық теорияда микробөлшектердің сол 4 кванттық сан анықтайтын күйлерін толқындық функциямен (φ) өрнектейді. Ол функцияның квадраты (φ 2 ) бөлшектердің кеңістік нүктелерінде болу ықтималдығын білдіреді. Кеңістіктегі электрон бұлтының тығыздығы осы ықтималдыққа пропорционал. Кванттық сандардың мәндеріне сәйкес атомдардағы қабықшалар мен қабаттар рет-ретімен толтырылып отырады. Осылайша элементтердің Менделеев кестесіндегі орны анықталады. Алдымен ең кіші n=1 қабат толтырып, онда болғаны 2 электрон ғана орналасады. Онан кейін n=2 қабат толтырылғанда ядроның заряды өсуіне сәйкес қабаттар ядроға жақындай түседі. 1-қабат 1s қабықшадан, 2-қабат 2s, 2p қабықшалардан, 3-қабат 3s, 3p, 3d қабықшалардан, т. с. с. тұрады. Әр қабат элементтің периодын анықтайды. Осы период элементтердің химиялық, оптикалық, электрлік, және магниттік қасиеттерінің қайталану периоды болып табылады. Осы периодтылық атомның ең сыртқы электрон қабықшаларының қасиетімен анықталады. Мұндай периодтылық иондар қасиетінде де сақталады.
Атомның орбиталарында 2 не одан да көп электрондар қозғалып жүрсе, онда мұндай күрделі атомдардағы электрондардың өзара әсерлесуін де еске алу керек. Ол әсерлесулер тек электр статикалық ғана емес, орбиталық магниттік моменттер мен бөлшектердің өзінің ішкі магниттік моменттері де өзара әсерлесуі мүмкін. Мысалы, гелий атомындағы 2 электронның негізгі күйдегі әсерлесу энергиясы 78. 98 эВ. Көп электронды атомдар құрылысын зерттегенде бұларды есепке алып отырады. Сонымен бірге әр электронның орбита бойымен қозғалысында туатын электр магниттік өрісі мен электронның ішкі магниттік моменттерінің әсерлесуі де қосымша байланыс энергиясын тудырады. Осының нәтижесінде атом спектрлерінде нәзік түзілісті, ал электрон мен ядроның магниттік моменттерінің өзара әсерлесуінен аса нәзік түзілісті көреміз. Қазіргі замандағы кванттық электр динамикасында атом электрондарының вакуум құрамындағы виртуал ды бөлшектермен әсерлесуін де есептеп атом құрылысының мұнан да күрделі екеніне көз жеткізуге болады.
Атом құрылысы және периодтық заң
Атом қүрылысы туралы ілімнің дамуы периодтық заңның фи-зикалық мәнін толық түсіндіріп берді. Элементтің периодтық жүйедегі реттік ыөмірі сның кестедегі орнын көрсетіп қана қоймай, элементтің ең басты қасиеті болып табылатын ядросындағы оң зарядтарының санын да көрсетеді. Элементтің реттік нәмірі мен атомынығі, ядро зарядтарынын са-ны бірдей болатынын 1912 жылы ағылшын ғалымы Г. Мозли тәжірибе жүзінде дәлелдеді және заң түрінде тұжырымдады. Бұл заңның негізгі мәні мынадай: бастапқы элементтен кейінгі элементке ауысқанда атомдардың ядро зарядтары бірге өсіп отырады. Мысалы, сутек ядро заряды 1, гелийдікі 2, литийдікі 3, бсупллийдікі 4 т. с. Атом ядросыыың оң зарядтарының саны қанша болса, оны аКпалып жүретін электроидардың да саны сонша болады және бір элементтен келесі элементке ауысқанда электрондардың са-иы да бірге артып отырады. Атом құрылысы туралы ілімнің жетістіктеріне байланысты Д. II. Меиделеевтің периодтық заңы қазір былай айтылады: Жай заттардың қасиеттері, сондай-ащ элементтердің қосы-лыстарыкың формалары мен қасиеттері олардың атомдарының ядро зарядтарыиық шамасына периодты түрде тәуелді болады. Бұл заңнық қысқаша түрін былай айтуға болады: элемент-тердің қасиеттері олардың ядро зарядтарынық шамасына периодты түрде тэуелді болады. Периодтық заңның жаңа анықтамасы оған Д. И. Менделеев берген анықтамасына еш уақытта қайшы келмейді, қайта оны жаңа гылыми деректермен толықтыра түседі және заңның дұрыстығын дәлелдейді. Мысалы, периодтық жүйеде элементтерді Д. И. Менделеев атомдық массаларының өсу ретімен орналас-тырғанда кейбір сәйкессіздіктер байқалады. Атомдық массала-ры ауыр, теллур иодтан бүрын, кобальт никельден бүрын орналасқан, ал атомдардық ядро зарядтарының өсу тұрғысынан қа-рағанда бүлар кестеде дұрыс орналастырылған. Өйткені теллур-ға қарағанда иодтың, кобальтқа қарағанда никельдің ядро за-рядтарының саны бірге артық болып келеді. Периодтық заңның жаңа анықтамасы элементтердің қасиет-терінің периодты түрде қайталануын да түсіндіріп береді. Әрбір период басталғанда электрондар жаңа түзілген электрондық қа-батқа орналасады да бүрынғы элементтердің сыртқы электрон-дық конфигурацияларын қайталайды. Мысал ретінде 1, 2, 3 жә-не 4 периодтарда орналасқан сілтілік металдар мен галогендер-дің қасиеттерінің өзгеруін қарастырайық. Сілтілік металдардың электрондық қабаттарында электрондардың орналасуы мынадай болады:И. Менделеевтің периодтық жүйесі периодтық заңның және атом құрылысының дұрыс көрінісі болып есептеледі. Кіші периодтарда ядро зарядтарының өсуіне байлаыысты электрондардың саны артады да (1-периодта 1-ден 2-ге дейін, 2, 3-периодта 1-дён 8-ге дейін) осыған сәйкес элементтердің қасист-тері өзгереді. Периодтың басындағы сыртқы қабатындағы элек-трондарының саны ең аз элемент сілтілік металл болады, ал электрондарының саны өскен сайын солдан оңға қарай метал-дық қасиет бірте-бірте кеміп, металл еместік қасиет арта береді де период инертті газбен аяқталады. Периодта солдан оңға қа-рай элементтердің металдық қасиеттері кеміп металеместік қасиеттерінің артуы осы бағытта олардың атомдарының радиус-тарының кішіреюіне байланысты. болады. Оның себебі бір пе-риодтағы элемеыттердің электрондық қабаттарының саны бірдей болады, ал олардың солдан оңға қарай ядро зарядтарының өсуі-не байланысты валенттік электрондары ядроға күшті тартылады да радиусы кішірейеді. Радиусы кішірейген сайын периодтағы элементтердің электрон беру қабілеті әлсірейді, яғни олардың металл еместік қасиеттері артады. Атом құрылысы теориясы периодтық жүйенің неге жеті пе-риодтан тұратынын да түсіндіреді. Әрбір жаңа период жаңа электрондық қабатпен басталады да, сыртқы қабатындағы элек-трондар саны 8-ге (з 2 р 6 ) тең болатын инертті газдармен аяқта-лады. Осы кездегі барлық белгілі элементтердің ең көп болатыи электрондық қабаттарының саны (қозбаған жағдайда) 7-ге тең. Бүдан периодтық жүйеде жеті период болу керек екенін білеміз. Периодтың ыөмірі сол периодтағы элементтердің электрондық қабаттарының санын көрсетеді. Атом қүрылысы теорріясы периодтық жүйенің неге 8 топтан тұратын және әрбір топтың неге екі топшаға бөлінетінін де тү-сіндіреді. Әрбір топтың немірі сол топқа жататын элементтердің химиялық байланыс түзуге қатыса алатын электрондардың ең көп мөлшерін көрсетеді. Әрбір топ негізгі және қосымша топша-ларға бөлінеді. Мүндай бөліну топшалардағы элементтердід электрондық қабаттарындағы электроыдардың орналасу тәртібі-не байланысты. Барлық негізгі топшаларда элементтердің кезекті электрондары сыртқы қабаттың (I және II топтарда) 5-немесе р-қабатшаларында (III-VIII топтарда) орналасады. Сондықтан да I және II топтардың негізгі топшаларының элементтері §-типті, III-VIII топшалардың негізгі топшаларынын, элементтері р-типті элементтерге жатады. Негізгі топша элементтерінің ва-ленттілік электрондары сыртқы қабатта орналасқан және саны топтың нөміріне тең болады. <**Атом құрылысы теориясы тұрғысынан топтардағы элемент-тердің ядро зарядтарының өсуіне байланысты металл еместік. қасиет кеміп, металдық қасиет артатындығын да түсіндіруге болады.
Электрондық және электрондық-графикалық формулалар.
Атомдағы электрондардың энергетикалық деңгейлер мен деңгей-шелерде орналасуы Клечковскийдің ережелеріне бағынады. Атомның электрондары оның деңгейлері мен деңгейшелерінде бас және орбиталь квант сандарының қосындысының (п + 1) өсу ретімен орналасады, ал егер екі деңгейше үшін (п + і) -дщ мәні бірдей болса,, онда электрон алдымен 1-дің мәні үлкен деңгейшв-де орналасады. Оны мына схемадан көруге болады ч п мен /-дің түйіскен нүктесінде (м + /) -дің сандық мәні берілген. Элемент атомының электрондық формуласын жазу үшін элек-трондар орналасқан деңгейлерді бас квант санына сәйкес бүтін сандармен, деңгейшелерді әріптермен (5, р, й, /), ал әр деңгей-шедегі электрондарды дәреже көсреткіші түрінде жазады. Мысалы, бірінші периодтағы сутек пен гелийдің электрондық формулалары былай жазылады:
іНіз 1 2 Не1з 2
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz