Молекулалық-кинетикалық теория: қағидалары мен эксперименттік негіздеуі


ҚАЗАҚСТАН РЕСПУБЛИКАСЫ ЖОҒАРЫ БІЛІМ ЖӘНЕ ҒЫЛЫМ МИНИСТІРЛІГІ
М. ӘУЕЗОВ АТЫНДАҒЫ ОҢТҮСТІК ҚАЗАҚСТАН УНИВЕРСИТЕТІ
“Сәулет, Құрылысы және Көлік” кафедрасы
СӨЖ
Тақырыбы: Молекулалық кинетикалық теория негіздері
Орындаған: Қожамұрат Нұрасыл
Группа: СМ-22-6к4
Қабылдаған: Жаңабекова Рахия
2022-жыл
Тақырыбы: Молекулалық кинетикалық теория негіздері
Жоспар:
Кіріспе: Молекулалы-кинетикалық теорияның негізгі қағидалары
Негізгі бөлім:
A) Молекулалы-кинетикалық теорияның эксперименттік негіздеуі
В) Молекулалық-кинетикалық теорияның негізгі ережелері
Қорытынды: Молекулярлық физика және МКТ курсының міндеттері; макро- және микрообъектілер
Молекулалы-кинетикалық теорияның негізгі қағидалары
Модельдер әдісі
Молекулалы-кинетикалық теория-модельдер әдісін қолданатын теорияның мысалы. Модельдер әдісінің ерекшелігі - күрделі объектінің қасиеттерін экспериментті зерттеу нәтижесінде оның ішкі құрылымы және құрайтын бөліктерінің қасиеттері туралы гипотеза айту. Айтылған гипотеза зерттелген объектінің белгілі қасиеттерін түсіндіру керек және жаңа, бұрын белгісіз қасиеттерді немесе зандылықтарды болжау керек. Егер бұл болжаулар тәжірибеде расталса, онда гипотеза теорияның негізі болады. Физикалық объектінің немесе құбылыстың кез келген моделі - олардың қарапайымдалған, идеалданған суреттемесі.
Молекулалы-кинетикалық теорияның негізгі қағидалары
Молекулалы-кинетикалық теорияның объектісі - қатты, сұйық және газ тәрізді күйлердегі зат. Химиялық заттың ең кішкентай бөлшектері атомдар және молекулалар бар болатынын пайымдайтын ілім - молекулалы-кинетикалық теория.
Заттың атомдардан, ең кішкентай бөлінбейтін бөлшектерден құралатыны туралы гипотезаны бұдан 2500 жылдай бұрын көне грек ғалымдары Левкипп және Демокрит айтқан. Бұл гипотеза газ, сұйық және қатты денелердің негізгі механикалық қасиеттерін: газдың шексіз таралуын, заттардың серпімділігін, олардың диффузия арқылы өзара бір-біріне енуін түсіндіре алды.
Молекулалы-кинетикалық теорияның негізінде келесі қағидалар жатыр.
Барлық денелер атомдардан құралады. Атомдар деп заттың ең кішкентай бөлінбейтін бөлшектерін атайды. Бір қарапайым химиялық заттың барлық атомдары бірдей.
Атомдар үздіксіз ретсіз қозғалыста болады. Атомдарды өзара бір-біріне тартатын күштер бар. Өте жақын қашықтықта атомдар бір-бірін тебеді. :
Екі немесе көп атомнан тұратын заттың өте кішкентай бөлшектері молекулалар деп аталады.
Атомдардың және молекулалардың қозғалысы, олардың өзара әрекеті механика заядары арқылы суреттеледі.
Соңғы тұжырым ретсіз қозғалған кішкентай өте көп бөлшектерден құралған денелердің қасиеттерін анықтау үшін механиканың негізгі заңдарын қолдануға мүмкіншілік тудырады.
Жылулық қозғалыс
Қатты, сұйық және газ тәрізді денелерде атомдар және молекулалар қозғалысының ерекшеліктері бар. Қатты денелерде атомдар көрші атомдардың тартылыс-тебу күштері теңесетін нүктелердің маңайында ретсіз тербеліп тұрады. Сұйықтарда қатты денелердегідей атомдар және молекулалар өзара тепе-тендік нүктелер маңайында ретсіз тербеледі, бірақ айрықша олар орындарын өзара ауыстырып отырады. Газ тәрізді күйде болған заттың атомдар мен молекулаларының ретсіз қозғалысы шектелмеген. Қай молекула болсын басқа молекуламен немесе қабырғамен соқтығыс қанша еркін қозғала алады. Зат атомдарының және молекулаларының ретсіз қозғалысы жылулық қозғалыс деп аталады.
Молекулалы-кинетикалық теорияның эксперименттік негіздеуі
Бөлек молекулалар немесе атомдар тікелей байқалатын және жылдамдықтары өлшенетін тәжірибелер молекулалы-кинетикалық теорияны растайтын шешуші дәлелдер болып саналады.
Броундық қозғалыс
Сұйық немесе газда орналасқан ұсақ қатты бөлшектердің ретсіз қозғалысын алғашқы рет 1827 жылы микроскоп арқылы ағылшын ботанигі Р. Броун байқаған. Бұл құбылыс броундық қозғалыс деп аталады.
Ұсақ бөлшектердің броундық қозғалысты молекулалы-кинетикалық теория ретсіз қозғалған молекулалардың кездейсоқ соққыларының нәтижесі деп түсіндірді.
1905 жылы А. Эйнштейн молекулалы-кинетикалық теорияның негізінде броундық қозғалыстың теориясын жасады. Оның есептеуінше, броундық бөлшектің ретсіз қозғалысындағы ығысуының орташа квадраты осы ығысу уақыт аралығына және заттың температурасына тура пропорционал.
Француз физигі Жан Перрен 1908-1911 жылдары броундық қозғалысты зерттейтін жан-жақты эксперименттер өткізді.
Молекулалардың жылдамдықтар бойынша үлестірілуі
Молекулалы-кинетикалық теорияның болжаған броундық қозғалыстың заңдылықтары тәжірибеде де толығырақ расталды. Әрбір соқтығыста молекуланың жылдамдығы өзгереді, сондықтан кез келген уақыт мезетінде әрбір молекуланың жылдамдығын анықтау мүмкін емес. Алайда 1859 жылы ұлы ағылшын физигі Джеймс Кларк Максвелл молекулалы-кинетикалық теорияны пайдаланып, маңызды бір есептің шешімін тапты. Ол кез келген уақыт мезетінде қанша молекула белгіленген жылдамдықпен қозғалатынын анықтады. Белгіленген жылдамдықпен қозғалатын молекулалар санының жылдамдықтан тәуелділігін бейнелейтін сызық молекулалардың жылдамдықтар бойынша үлестірілуі қисығы деп аталады. Эксперименттік өлшеулер молекулалы-кинетикалық теорияда болжанған жылдамдықтар үлесу заңын растады. Бұл факт молекулалы-кинетикалық теорияның негізгі дәлелдерінің бірі болып саналады.
Молекулалық-кинетикалық теорияның негізгі ережелері
- Барлық денелер бөлшектерден - атомдардан, молекулалардан, иондардан тұрады.
- Барлық бөлшектер үздіксіз хаотикалық жылулық қозғалыста болады.
- Кез келген дененің бөлшектерінің арасында өзара әрекеттесу күштері - тартылу және тебілу күштері болады.
Сонымен, молекулалық-кинетикалық теорияда зерттеу объектісі көптеген бөлшектерден тұратын жүйе - макрожүйе . Мұндай жүйенің әрекетін түсіндіру үшін механика заңдары қолданылмайды. Сондықтан негізгі зерттеу әдісі болып табылады статистикалық әдіс заттың қасиеттерін зерттеу.
Құбылыстарды түсіндіру және болжау үшін білу маңызды молекулалардың негізгі сипаттамалары :
- Өлшемдері
 Молекуланың өлшемін бағалау қатты немесе сұйық заттардың тығыздығына және бір молекуланың массасына негізделген бір молекуласы бар текшенің өлшемі ретінде жасалуы
Молекуланың өлшемін бағалау қатты немесе сұйық заттардың тығыздығына және бір молекуланың массасына негізделген бір молекуласы бар текшенің өлшемі ретінде жасалуы
 мүмкін:
мүмкін:
- Молекулалардың массасы
Заттың массасының қатынасы м молекулалар санына дейін Н бұл затта:
Салыстырмалы молекулалық салмақ
Берілген заттың молекуласының (немесе атомының) массасының көміртегі атомы массасының 1/12 бөлігіне қатынасы:
Заттың мөлшері
Заттың мөлшері бөлшектер санының қатынасына тең Н денеде (атомдар - атомдық затта, молекулалар - молекулада) заттың бір мольіндегі молекулалар санына дейін
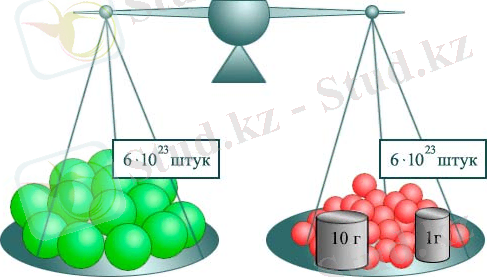
Авогадро тұрақтысы
1 моль заттың құрамындағы молекулалар саны.
Na=6*10^23 моль-1
Молярлық масса
Заттың молярлық массасы деп 1 моль мөлшерінде алынған заттың массасын айтады.
M=m/n
Халықаралық бірліктер жүйесінде заттың молярлық массасы былай өрнектеледі кг/моль .
Өзара әрекеттесу (тәжірибеге негізделген сандық)
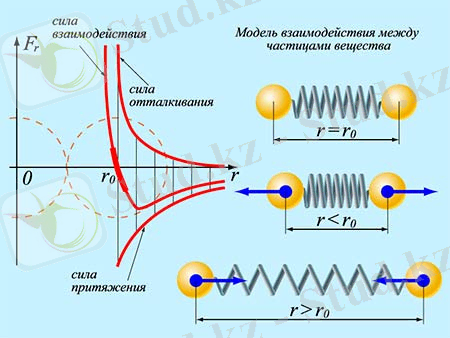
Молекулалардың өзара әрекеттесуі бір мезгілде тартылумен де, тебілумен де сипатталады: қашықтықта r >0 қашықтықта, итеру басым r>r 0 - тартымдылық және ол тез төмендейді. Қашықтықта r 0 екі молекуладан тұратын жүйенің ең аз потенциалдық энергиясы бар (өзара әрекеттесу күші нөлге тең) - бұл тұрақты тепе-теңдік күйі
Молекулалық-кинетикалық теория заттың неліктен газ, сұйық және қатты күйде болатынын түсінуге мүмкіндік береді. МКТ тұрғысынан алғанда, агрегаттық күйлер тұрғысынан ерекшеленеді молекулалар арасындағы орташа қашықтықтың мәні және молекулалардың бір-біріне қатысты қозғалысының сипаты.
Молекулалық-кинетикалық теорияның негізгі ережелері әртүрлі физикалық тәжірибелермен бірнеше рет расталды. Мысалы, зерттеу:
A) диффузия
B) Броундық қозғалыс
Қысқаша қорытынды
Молекулярлық-кинетикалық теория денелердің құрылысы мен қасиеттерін атомдардың, молекулалардың және иондардың қозғалысы мен әрекеттесуі негізінде түсіндіреді. MKT негізделген үш позиция , олар эксперименталды және теориялық түрде толығымен расталған:
1) барлық денелер бөлшектерден - молекулалардан, атомдардан, иондардан тұрады;
2) бөлшектер үздіксіз хаотикалық жылулық қозғалыста болады;
3) кез келген дененің бөлшектерінің арасында өзара әрекеттесу - тартылу және тебілу күштері болады.
Заттың молекулалық құрылымы электронды микроскопта молекулаларды тікелей бақылаумен, сондай-ақ сұйықтардағы қатты заттардың еруімен, заттың сығылғыштығы мен өткізгіштігімен расталады. Жылулық қозғалыс - броундық қозғалыс және диффузия. Қатты денелердің молекулааралық әрекеттесу күші мен серпімділігінің, сұйықтардың беттік керілуінің болуы.
Молекулярлық физика және МКТ курсының міндеттері; макро- және микрообъектілер
Макроскопиялық дене - бөлшектердің көп мөлшерінен тұратын дене. Мысалы: машина, адам, планета, бильярд добы . . .
микроскопиялық дене. бір немесе бірнеше бөлшектерден тұратын дене. Мысалы: атом, молекула, электрон . . .

. Сәйкесінше микро және макрообъектілердің мысалдары
АКТ курсының оқу пәнін анықтай отырып, енді АКТ курсының алдына қойған негізгі мақсаттары туралы айтуымыз керек, атап айтқанда:
1. Макроскопиялық дененің ішінде болатын процестерді зерттеу (бөлшектердің қозғалысы мен өзара әрекеті)
2. Денелердің қасиеттері (тығыздығы, массасы, қысымы (газдар үшін) . . . )
3. Жылу құбылыстарын (қыздыру-салқындату, дененің агрегаттық күйінің өзгеруі) зерттеу.
Бүкіл тақырып бойынша өтетін бұл мәселелерді зерттеу енді біз АКТ-ның негізгі ережелері деп аталатындарды, яғни шындыққа бұрыннан күмән келтірмейтін кейбір мәлімдемелерді тұжырымдайтынымыздан басталады. , және осыдан бастап, бүкіл келесі курс салынады. .
Оларды кезекпен алайық:
2. МКТ-ның бірінші негізгі ережесі; молекулалар, атомдар
Барлық заттар бөлшектердің көп мөлшерінен - молекулалар мен атомдардан тұрады.
Анықтама. Атом - химиялық элементтің ең кіші бөлшегі. Атомдардың өлшемдері (олардың диаметрі) см-ге тең. Молекулаларға қарағанда атомдардың әртүрлі типтері салыстырмалы түрде аз екенін атап өткен жөн. Қазіргі уақытта адамға белгілі олардың барлық сорттары мерзімді кестеде жиналады
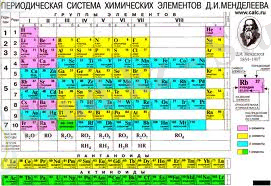
2. Д. И. Менделеев бойынша химиялық элементтердің периодтық жүйесі (негізінен атомдардың сорттары)
Молекула- атомдардан тұратын заттың құрылымдық бірлігі. Атомдардан айырмашылығы, олар соңғысына қарағанда үлкенірек және ауыр, және ең бастысы, олардың алуан түрлілігі өте үлкен.
Молекулалары бір атомнан тұратын зат деп аталады
атомдық
, үлкенірек саннан -
молекулалық
. Мысалы: оттегі, су, тұз () - молекулалық; гелий күмісі (He, Ag) - атомдық.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz