Химиялық кинетиканың заңдылықтары және ферментативті катализдің ағзадағы рөлі


КРМУ БӨЖ ХИМИЯ
РЕФЕРАТ
Тақырыбы Химиядағы кинетиканың заңдылықтары және ағзаның тіршілігіндегі ферменттативті катализдің рөлі
Орындаған 102 Б стоматология факультетінің
студентті Гаипова Гулнара
Тексерген Гульмира Умирзаковна
Жоспары
Глоссарий
Кіріспе . . .
Негізгі бөлім . . .
Реакция жылдамдығының температураға тәуелділігі . . .
Реакция және катализ механизмі . . .
Химиялық реакцияның жылдамдығы әрекеттесуші заттардың концентрациясына тәуелді . . .
Ферменттер дегеніміз не ? . . .
Ферменттердің адам ағзасындағы рөлі . . .
Қорытынды . . .
Пайдаланылған әдебиеттер . . .
Глоссарий
Кинетика (грек. kіnetіks - қозғалысқа келтіруші) - механиканың дененің мех. күйін оны анықтайтын физ. себептерге байланыстыра отырып зерттейтін саласы.
Катализатор - химиялық реакцияның жылдамдығын арттыратын зат (агент) .
Реактив (ре… және лат. agentіs - әсер етуші) - химиялық реакциялардағы бастапқы заттарды анықтайтын техникалық термин.
Реакция (лат. ре… және aktіo - әрекет), химияда - реагенттердің химиялық құрамы, құрылысы, қасиеті жағынан өзгеше заттарға (өнімдерге) айналу құбылысы.
Атмосфера (гр. ατμός - «бу» және гр. σφαῖρα - «шар») - жердің ауа қабығы.
Диаграмма - нақты процестер мен құбылыстардың өзара байланыстарын сипаттайтын сандық көрсеткіштер сызба түрінде кескінделетін нұсқалар.
Жылдамдық константасы - реагенттердің бірлік концентрациясы кезіндегі реакцияның жылдамдығын анықтайтын тұрақты шама.
Индукция (лат. іnductіo - ой салу, бағыттау) - тұрақты магнитті өрісте қозғалғанда немесе айналасындағы магнитті өрістің өзгеруі кезінде өткізгіштің бойындағы электр қозғаушы күштің қозуы.
Ферменттер (лат. fermentum - «ашу») немесе энзимдер (гр. ζύμη - «ішінде», гр. ἔνζυμον «ашытқы») - барлық тірі организмдер құрамына кіретін арнайы ақуыздар.
Субстрат (лат. sub - астынғы, stratum - қабат, қатпар) - екі тілдің тоғысуы кезінде женген тілдін құрамында сақталып қалған женілген тілдің іздері.
Кіріспе
Химиялық кинетика-химиялық реакциялардың жылдамдығын сипаттайтын физикалық химияның бір саласы. Химиялық кинетика процесстің жүру бағытын сипаттайды . Химиялық кинетика космологияның, геологияның, биологияның, инженерияның және тіпті психология салдары . Химиялық кинетика принциптері таза физикалық процестерге де, химиялық реакцияларға да қолданылады.
Химиялық кинетиканың зерттейтін саласы : химиялық реакцияның жылдамдығын ; химиялық реакцияның жүру механизмін ; химиялық реакция жылдамдығын түрлі факторларға тәуелділігін зерттейді ;
Химиялық термодинамика химиялық реакциялардың стихиялық ағымының негізгі мүмкіндігін немесе мүмкін еместігін болжауға, сонымен қатар реактивті заттардың тепе-теңдік концентрациясын есептеуге мүмкіндік береді. Алайда, қарастырылған заңдылықтарды білу химиялық реакцияның нақты мүмкіндігін болжау, реакция жылдамдығы мен оның механизмін анықтау, сонымен қатар процесті басқару үшін жеткіліксіз. Химиялық реакция жылдамдығы реакция кеңістігінің бірлігіндегі уақыт бірлігіндегі зат мөлшерінің өзгеруіне тең. Химиялық реакция түріне байланысты (гомогенді немесе гетерогенді) реакциялық кеңістіктің сипаты өзгереді. Біртекті реакция- зат күйінің бір фазасындағы реакция. Гетерогенді реакция зат күйінің әртүрлі фазасында жүреді. Зат мөлшерінің көлемге қатынасы концентрация деп аталады. Біртекті реакцияның жылдамдығы кез-келген бастапқы заттардың немесе реакция өнімдерінің уақыт өте келе концентрациясының өзгеруіне тең.
Химиялық кинетика гомогенді реакцияның да, гетерогенді реакцияның да жылдамдығын зерттейді. Химиялық реакцияның жылдамдығы деп бастапқы заттардың немесе өнімнің біреуінің концентрациясының уақыт бірлігіндегі өзгеруін айтады.
Біртекті ортада жүретін реакциялар гомогенді химиялық реакциялар деп аталады (мысалы ерітінділердің немесе газдардың арасындағы) .
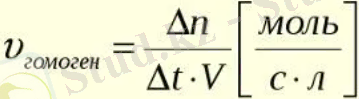
Әртүрлі фазадағы заттардың әрекеттесуі нәтижесінде жүретін реакциялар гетерогенді реакциялар деп аталады (мысалы, газдар мен сұйықтықтар, қатты заттар мен сұйықтықтар т. б. ) .
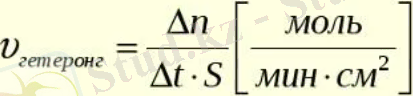
Химиялық кинетика, реакция кинетикасы деп те аталады, бұл химиялық кинетиканың жылдамдығын зерттеу химиялық реакциялардың процестері мен механизмдері, сондай-ақ әртүрлі айнымалылардың әсері, оның ішінде атомдардың орнын ауыстырудан, аралық өнімдердің пайда болуынан және т. б. студенттерге, зерттеушілер, ғалымдар, ғалымдар, химиктер және өнеркәсіптік қоғамдастық қажет химиялық кинетиканы түсініп, өнеркәсіптік реакцияларды бақылауға болады және олардың тетіктерін түсіну. Химиялық кинетика сонымен қатар болжам жасау туралы түсінік береді атмосферадағы газдар арасында болатын реакциялар сияқты салыстырмалы түрде маңызды реакциялар. Бұл физикалық химияның көптеген аспектілерін қамтитын үлкен сала.
1865 жылы Н. Н. Бекетов және 1867 жылы К. М. Гулдберг пен П. Вааг белсенді массалар заңын тұжырымдады, оған сәйкес химиялық реакция жылдамдығы әр уақытта белгілі бір дәрежеде көтерілген. Концентрациядан басқа химиялық реакция жылдамдығына келесі факторлар әсер етеді :
« Температура
« Қысым
« Катализатор
« Реакцияға қатысқан заттардың табиғаты
Реакция жылдамдығының температураға тәуелділігі
Ас пісіру кезінде, егер біз газды төмен температурада ұстасақ, тамақ баяу дайындалады. Бірақ біз температураны максимумға дейін көтергенде, тамақ тез дайындалады. Сондықтан температура реакция жылдамдығын арттырады.
Температураның жоғарылауымен реакция жылдамдығы артады. Мысалы, металды ерітуге кететін уақыт төменгі температурада әлдеқайда көп болады, бірақ біз температураны көтергеннен кейін ол азаяды. Температураның 10°жоғарылауымен химиялық реакция үшін жылдамдық константасы екі есе көп екендігі анықталды.
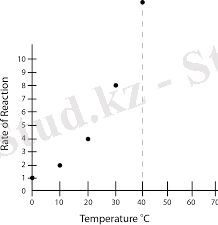
Химиялық реакция жылдамдығының температураға тәуелділігін Вант-Гофф Аррениус теңдеуімен түсіндіре аламыз.
Температураның реакция жылдамдығына әсері Вант-Гофф ережесі. Температураның жоғарылауы көптеген химиялық реакцияларды тездетеді. Вант-Гофф ережесіне сәйкес, температура 10 К-ге көтерілгенде, көптеген реакциялардың жылдамдығы 2-4 есе артады v2 және v1 Т2 және Т1 температурасындағы реакциялар жылдамдығы, Y эндотермиялық реакция үшін мәні экзотермиялық реакцияға қарағанда жоғары болатын коэффициент. Көптеген реакциялар үшін Y 2-4 аралығында болады. Теңдеуді тек индикативті есептеулер үшін қолдануға болады, өйткені олардың дәлдігі өте жоғары емес.
Аррениус теңдеуі. k - реакция жылдамдығының тұрақтысы ;
k - экспоненциалды фактор; e - табиғи логарифмнің негізі; E - реакция табиғатымен анықталатын активтендіру энергиясы деп аталатын тұрақты. Химиялық реакциялар үшін Ea мәні 40-400 кДж/моль аралығында болады.
Реакция және катализ механизмі
Бұрын бұл реакциялардың жүруіне себеп болатын бөлшектердің соқтығысуы және осы соқтығысулардың тек кейбіреулері сәтті болатындығы айтылды. Себебі, реагент бөлшектері кинетикалық энергияның кең спектріне ие және бөлшектердің аз ғана бөлігі химиялық реакцияның пайда болуы үшін байланыстарды нақты бұзу үшін жеткілікті энергияға ие болады (және дұрыс бағдар) . Реакцияға қажетті минималды энергия активтендіру энергиясы деп аталады;
Катализаторлар қалай жұмыс істейді?
Катализатор реакция жылдамдығын реакцияның жылдамдығын арттырудың басқа тәсілдеріне қарағанда сәл өзгеше түрде арттырады. Катализатордың функциясы-бөлшектердің көп бөлігі реакция үшін жеткілікті энергияға ие болу үшін активтендіру энергиясын азайту. Катализатор реакцияның активтену энергиясын төмендетуі мүмкін:сәтті соқтығысулар ықтималдығы жоғары болатындай реакцияға түсетін бөлшектерді бағдарлау өнімді қалыптастыру үшін аз энергияны қажет ететін аралық өнімді қалыптастыру үшін реактивтермен әрекеттеседі;
Платина, мыс және темір сияқты кейбір металдар белгілі бір реакцияларда катализатор бола алады. Біздің ағзамызда биологиялық реакцияларды тездетуге көмектесетін катализаторлар болып табылатын ферменттер бар. Катализаторлар әдетте химиялық аралық өнімді қалыптастыру үшін бір немесе бірнеше реактивтермен әрекеттеседі, содан кейін ол соңғы өнімді қалыптастыру үшін реакцияға түседі. Химиялық аралық өнімді кейде активтендірілген кешен деп атайды. Химиялық катализаторлар реакцияның өзіне қатыспай раекция жылдамдығын арттырып, кеміте алатын заттар.
Энергетикалық диаграммалар катализатордың реакция жылдамдығына әсерін көрсету үшін пайдалы. Катализаторлар реакцияға қажетті активтендіру энергиясын азайтады, сондықтан реакция жылдамдығын арттырады. Есіңізде болсын, катализаторды қолданған кезде молекулалардың орташа кинетикалық энергиясы өзгеріссіз қалады, бірақ қажетті энергия азаяды
Химиялық реакцияның жылдамдығы әрекеттесуші заттардың концентрациясына тәуелді .
Химиялық реакция жылдамдығына реагенттер концентрациясының әсері - химиялық кинетиканың негізгі заңы - әрекеттесуші массалар заңымен өрнектеледі (“әрекеттесуші массалар” - қазіргі “концентрация” түсінігінің синонимі) . Температура тұрақты болғанда реакцияның жылдамдығы әрекеттесуші заттар концентрациясының көбейтіндісіне тура пропорционал.
Реактивтер концентрациясының жоғарылауы әдетте реакция жылдамдығын арттырады, өйткені реакция өнімдерін құрайтын реактивті молекулалар немесе иондар көп болады. Бұл әсіресе концентрация төмен болған кезде және бірнеше молекулалар немесе иондар реакция жасаған кезде дұрыс. Концентрация жоғары болған кезде көбінесе концентрацияның жоғарылауы реакция жылдамдығына аз әсер ететін шекке жетеді. Бірнеше реактивтер тартылған кезде, олардың біреуінің концентрациясының жоғарылауы, егер басқа реактивтер жеткіліксіз болса, реакция жылдамдығына әсер етпеуі мүмкін. Жалпы алғанда, концентрация реакция жылдамдығына әсер ететін факторлардың бірі болып табылады және байланыс әдетте қарапайым немесе сызықты емес. Реактивтердің концентрациясы реакцияның басында максималды болады, сондықтан концентрацияның өзгеру жылдамдығы да максималды болады. Реактивтер концентрациясы төмендеген сайын бұл реакция жылдамдығының төмендеуіне әкеледі. Бұл реакция жылдамдығы Реактивтердің концентрациясына тура пропорционал екенін білдіреді.
Мысалы: Жылдамдығы жану ағаш концентрациясына байланысты оттегі . Ағаштың бір бөлігі ауада баяу күйіп кетеді (шамамен 20% оттегі бар), бірақ таза оттегіде тез күйіп кетеді (яғни 100% оттегі), өйткені ауадағы оттегінің концентрациясы аз.
Қорытынды қорытындылай келе, біз химиялық кинетика ұғымын ғылым ретінде тағы бір рет анықтаймыз. Химиялық кинетика (грек. кинетикос - қозғаушы) - химиялық реакциялар механизмдері және олардың уақыт бойынша жүру заңдылықтары туралы ғылым. 19 ғ. химиялық термодинамика негіздерін дамыту нәтижесінде химиктер қайтымды химиялық реакциялар үшін тепе-теңдік қоспасының құрамын есептеуді үйренді. Сонымен қатар, қарапайым есептеулер негізінде эксперименттер жүргізбей, осы жағдайларда белгілі бір реакция жүруінің іргелі мүмкіндігі немесе мүмкін еместігі туралы қорытынды жасауға болады. Алайда реакцияның "принципті мүмкіндігі" оның жүретінін білдірмейді. Мысалы, термодинамика тұрғысынан c + O2 = CO2 реакциясы өте қолайлы, кез-келген жағдайда 1000° C-тан төмен температурада (жоғары температурада СО2 молекулаларының ыдырауы орын алады), яғни көміртегі мен оттегі (100% шығуымен) көмірқышқыл газына айналуы керек. Алайда, тәжірибе көрсеткендей, көмірдің бір бөлігі бірнеше жыл бойы ауада жатуы мүмкін . Қарастырылған реакцияларға ұқсас термодинамикалық реакциялар белгілі бір жағдайларда ғана жүруі мүмкін. Мысалы, тұтанғаннан кейін көмір немесе күкірт өздігінен оттегімен біріктіріледі; температура көтерілгенде немесе ультрафиолет сәулесінің әсерінен сутегі хлормен оңай әрекеттеседі; сутегі мен оттегі қоспасы (жарылғыш газ) тұтанған кезде немесе катализатор қосылған кезде жарылады. Неліктен осы реакциялардың барлығын орындау үшін арнайы әсерлер қажет - қыздыру, сәулелену, катализаторлардың әрекеті? Химиялық термодинамика бұл сұраққа жауап бермейді-онда уақыт ұғымы жоқ. Сонымен қатар, практикалық мақсаттар үшін бұл реакция бір секундта, бір жылда немесе көптеген мыңжылдықтарда өтетінін білу өте маңызды. Тәжірибе көрсеткендей, әртүрлі реакциялардың жылдамдығы әртүрлі болуы мүмкін. Су ерітінділеріндегі көптеген реакциялар дереу жүреді. Сонымен, таңқурай түсті фенолфталеиннің сілтілі ерітіндісіне артық қышқыл қосылған кезде, ерітінді бірден түссізденеді
Ферменттер дегеніміз не?
"Ферменттерді биохимиялық реакцияларды катализдейтін биологиялық катализатор ретінде атауға болады". Ферменттердің екінші атауы энзим.
Ферменттерді зерттейтін ғылым саласы энзималогия деп аталады .
Ферменттердің көпшілігі әртүрлі процестерді орындау үшін өте маңызды каталитикалық қасиеттері бар ақуыздар. Жасушадағы метаболикалық процестер мен басқа химиялық реакциялар тіршілікті қамтамасыз ету үшін қажетті ферменттер жиынтығымен жүзеге асырылады. Ферменттердің функциялары метаболикалық процестерді бағыттау және реттеу болып табылады. Бейорганикалық катализаторлар ретінде ферменттер кейде тікелей және кері биореакцияны жеделдете алады. Айта кету керек, олардың әрекеті кезінде химиялық тепе-теңдікті бұзылмайды. Пайда болған реакциялар жасушаларға енетін қоректік заттардың ыдырауын және тотығуын қамтамасыз етеді. Ферменттер табиғаты бойынша ақуыздарға жататыны дәлелденді . Әр ақуыз молекуласы минутына көптеген әрекеттерді орындай алады. Ферменттерді *биологиялық катализаторлар* деп те атайды бірақ олардың айырмашылықтарыда жеткілікті ;
Мысалы: 1) Ферменттер жоғарға арнайылыққа ие
2) Ферменттердің активтілігін реттеуге болатын катализаторлар
3) Ферменттердің табиғаты белоктан құралған
4) Ферменттер жоғары биологиялық активті заттар
Метаболизм процесінің бастапқы кезеңі молекуламен әрекеттесетін және субстрат деп аталатын ферменттерге байланысты. Субстрат дегеніміз фермент әсер ететін зат . Ферменттер субстраттарды өнімдер деп аталатын басқа жеке молекулаларға айналдырады. Кофермент құрамында витаминдер метал иондары нуклеотидтер кіреді.
Ферменттерді реттеу өмірлік процестерді қолдаудағы рөліне байланысты клиникалық диагностиканың негізгі элементі болды. Барлық ферменттердің макромолекулалық компоненттері рибозим деп аталатын РНҚ катализаторлар класынан басқа ақуыздан тұрады. "Рибозим" сөзі рибонуклеин қышқылы ферментінен шыққан. Көптеген рибозимдер-бұл рибонуклеин қышқылының молекулалары, олар реакцияларды өздерінің байланыстарының бірінде немесе басқа РНҚ-да катализдейді.
Ағзамызда кездесетін әрбір ферменттің атқаратын қызметі бар . Төменде кейбір ферменттердің әсер ету аймағы көрсетілген :
Оксидоредуктаза ферменті тотығу реакциясын катализдейді, онда электрондар молекуланың бір формасынан екіншісіне ауысады.
Трансфераза ферменттері акцепторлар мен донорлық молекулалар арасында функционалды топты тасымалдауға көмектеседі.
Гидролаз ферменттері, олар гидролиз реакциясын байланыс пен гидролизді ыдырату үшін су қосу арқылы катализдейді.
Лиазалар суды, көмірқышқыл газын немесе аммиакты қос байланыс арқылы қосады немесе қос байланыс жасау үшін оларды жояды.
Изомераза ферменттері молекуладағы құрылымдық ығысуларды катализдейді, осылайша молекуланың пішінін өзгертеді.
Лигазалар атф энергиясын пайдаланып энергия синтездеуін жүзеге асырады
ФЕРМЕНТТЕРДІҢ ТАМАҚ ДӘРІ ДӘРМЕК СУСЫН ӨНДІРІСІНДЕ ҚОЛДАНЫЛУЫ
Сусындар
Ашыту нәтижесінде алынған алкогольді ішімдіктер көптеген факторларға байланысты әр түрлі болады. Ашытылған өнім қолданылатын өсімдік өнімінің түріне және қолданылатын ферменттің түріне байланысты өзгереді.
Мысалы, қол жетімді материалдарға байланысты жүзім, бал, құлмақ, бидай, кассава тамыры және картоп. Сыра, шарап және басқа да сусындар өсімдік ашытуынан жасалады.
Тамақ өнімдері
Нанды күнделікті өмірде ашытудың ең жақсы мысалы ретінде қарастыруға болады.
Аз мөлшерде ашытқы мен қант нан қамырымен араласады. Содан кейін ашытқыдағы ферменттердің әсерінен қанттың ашытуы нәтижесінде нанның ісінгенін байқауға болады, бұл көмірқышқыл газының пайда болуына әкеледі. Бұл процесс нанға ашыту процесі болмаған кезде жетіспейтін құрылым береді.
Препараттың әсері
Ферменттердің әсері, әдетте, d болатын дәрі-дәрмектерді қолдану арқылы басылуы немесе күшейтілуі мүмкін
Мысалы күнделікті өмірде қолданатын МЕЗИМ дәрілік препататы ол асқортуды ішек жолдарын жақсартады
Фермент-субстраттың өзара әрекеттесуі
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz