7-сынып химиясында жану реакцияларын ақпараттық-коммуникациялық технологиялар арқылы оқыту әдістемесі


Қазақстан Республикасының Ғылым және жоғары білім министрлігі
А. Байтұрсынов атындағы Қостанай өңірлік университеті
Жаратылыстану- ғылыми пәндері кафедрасы
«7-сынып химия курсындағы «Жану реакциялары» тарауын АКТ- ны қолдану әдістемесі» тақырыбы бойынша
КУРСТЫҚ ЖҰМЫС
Пәні: «Химияны оқыту әдістемесі»
Білім беру бағдарламасы: 6ВО1511 - Химия - Биология
Курстық жұмысты қорғау
2022 ж өтті
Баға
Қостанай 2022
КІРІСПЕ3
I ӘДЕБИ ШОЛУ5
1. 1 Жану реакциялар5
1. 2 Өздігінен жану және оның түрлері8
1. 3 Химия пәнінен АКТ-ны қолданылуы9
II НЕГІЗГІ БӨЛІМ11
2. 1 7-сынып химия курсындағы «Жану реакциялары» тақырыбы бойынша қысқа мерзімді сабақ жоспары11
2. 2 Қысқа мерзімді сабақ жоспарын талдау14
ҚОРЫТЫНДЫ16
ПАЙДАЛАНЫЛҒАН ӘДЕБИЕТТЕР17
Жану процестеріне тән қасиет олардың жоғарғы жылдамдығы болып табылады, жоғарғы температурада жалында болатын реакцияларға және көптеген химиялық процестер жылдамдығының температураға күшті тәуелділігіне байланысты. Бірқатар жағдайларда әрекеттесуші орта біртекті емес болғанда, нәтижесінде алынған конверсия жылдамдығы ең алдымен компоненттердің реакция аймағына жеткізілу жылдамдығына байланысты болады, ал нақты химиялық процестің жылдамдығы мардымсыз болады. Мұндай жағдайда реакцияға түсетін компоненттердің физикалық күйі өте маңызды. Біртекті емес ортада, мысалы, фазалық шекарада жану әдетте біртектес қоспаға қарағанда әлдеқайда баяу жүреді.
Курстық жұмыстың өзектілігі, химияны оқыту әдістемесі бойынша берілген «жану реакциялар» тарауын талдай отырып, АКТ-ны қолдану бойынша жүргізу.
Мақсаты: қысқа мерзімді сабақ жоспарын тақырып негізінде құрастыра отырып, жану реакциясын талдай отырып, АКТ-ның тиімді жақтарын қарастыру.
Міндеттер:
1. Жану реакциясының жіктелуін қарастыру;
2. Жану реакцияларының теңдеулерін құрудың жолдарын қарастыру;
3. АКТ-ны қолдану әдістемесі бойынша қысқа мерзімді сабақ жоспарын құрастыру.
Жанудың ең маңызы түрі-газдардың жануы. Жануға қатысатын қатты және сұйық өнімдердің көпшілігі негізгі реакцияға түсер алдында не буланады немесе ішінара газ тәріздес өнімдерге (газдандырылған) айналу арқылы ыдырайды, олар кейін газ фазасына әрекеттеседі. Бұл жалын аймағынан жылу беру есебінен сәйкес компонентті (әдетте отын) қыздыру нәтижесінде пайда болады. Фаза шекарасында тек ұшпайтын жанғыш заттар, мысалы, кокс, көмірдің қатты пиролиз өнімдері, кейбір металдар іс жүзінде гетерогенді түрде жанып кетеді. Сондықтан газдың жану заңдылықтары үлкен қызығушылық тудырады.
Күнделікті тәжірибиеде жану процесін әртүрлі жанғыш заттардың оттегімен-көмірмен, газ тәрізді көмірсутектермен, мұнай өнімдерімен тотығуымен байланысты.
Жанғыш жүйелер отын мен тотықтырғышты ажыратады. Заманауи технологияда азот оксидтері, галогенидтер және озон тотықтырғыш ретінде қызмет ететін жүйелер жиі кездеседі. Кейбір жағдайларда жануға тек бір бастапқы өнім қатысады, айтарлықтай жылу бөлетін жылдам ыдырау, полимерлеу немесе аутототығу. Соған қарамастан, атмосфералық оттегі тотықтырғыш ретінде қызмет ететін жанғыш жүйелер ең көп таралған.
Жану реакциялары жүруі үшін отын мен тотықтырғыш қоспасының тұтануына жағдай жасау қажет.
21 ғасыр - жоғарғы компьютерлік технологиялар ғасыры. Білім берудің алдында тұрған маңызды міндеттерінің бірі - ақпаратпен жұмыс істеуде жалпы білімдік және жалпы мәдени дағдыларды қалыптастыру үшін ақпараттық-телекоммуникациялық технологияларды меңгеру.
Ақпараттық-коммуникациялық технологияларыд тиімді пайданалуға мүмкіндік беретін маңызды әдістемелік принциптердің бірі компьютерлік технологияны дәстүрлі формалар мен әдістермен үйлестіру.
I ӘДЕБИ ШОЛУ- Жану реакциялар
Жану-заттардың жылу және жарық бөліп, тотыға жүретін химиялық реакция. Жану кезінде жай заттардың атомдары оттек атомдарымен қосылып, оксид түзеді. Жай заттардың оттекпен әрекеттесуі:
Оксидтер-құрамы екі элементтен тұратын, біреуі оттек болатын күрделі заттар. Заттар ауада жанғанда да оксидтер түзіледі. Бірақ заттар ауада қарағанда баяу жанады, өйткені ауа құрамындағы оттектің мөлшері бес еседей аз.
Оттегімен толтырылған ыдысқа жарқыраған шоқты салсаңыз, қызып, жанып көміртегі (IV) тотығы түзіледі.

1-Сурет. Көмірдің жануы.
Қандай зат пайда болғанын анықтау үшін ыдысқа әк суы құйылады, шайқағанда ерітінді лайланады. Бұл көмірқышқыл газының болуын дәлелдейді.
Темір қасыққа күкірттің алдын ала қыздырылған бір бөлігін оттегі бар ыдысқа салғанда, күкірт оттегіде ашық көк жалынмен жанып, күкірт оксидінің өткір иісі бар газды түзеді.
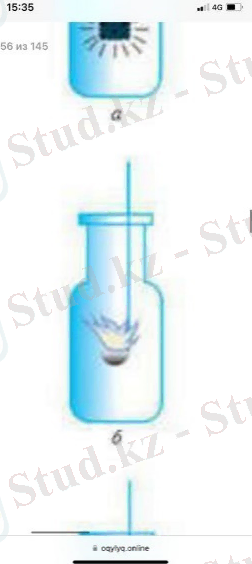
2-сурет. Күкірттің жануы
Фосфор оттегіде ашық жалынмен жанып, фосфор (V) оксидінің қатты бөлшектерінен тұратын ақ түсті түтін түзеді.
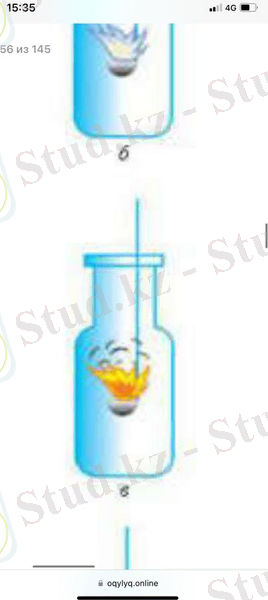
3-сурет. Фосфордың жануы
Оттегі әдетте жанбайды деп саналатын заттарды, мысалы темірді де жағады. Егер жіңішке болат сымға сіріңкені бекітіп, оны жағып, оттегі бар ыдысқа түсірсек, сіріңкеден темір жанады. Темірдің жануы темір қағының Fe 3 O 4 балқытылған тамшыларының жарқыраған ұшқындарымен жүреді. Оны былай жазып көрсетуге болады:

4-сурет. Темірдің жануы
Басқада металдар оттегімен әрекеттесе алады, дегенмен реакциялар жану арқылы жүзеге аспауы мүмкін. Мысты оттегіде қатты қыздырса ол жанбай қара мыс (II) оксиді ұнтағына айналады.
Мензуркада парафинді шам жанған кезде оның қабырғаларында су тамшылары пайда болады. Егер әк суын стақанға құйса лайланады, бұл көміртегі тотығының бар екенін дәлелдейді. Парафин көміртек пен сутек атомдарынан тұрады. Осылайша, күрделі заттың жануы, оның құрамына кіретін оксидтердің түзілуі [1] .
Жану басталғаннан кейін тұрақты жану көзі жану аймағы болып табылады. Жанудың пайда болуы және жалғасуы жанғыш зат пен оттегінің белгілі бір сандық қатынасында, сондай-ақ белгілі бір температурада және тұтану көзінің жылу энергиясының қорында болуы мүмкін. Ең жоғары тұрақты күйдегі жану жылдамдығы таза оттегіде, ең төменгісі - ауада 14-15% оттегі болғанда байқалады. Ауадағы оттегінің аз болуымен заттардың көпшілігінің жануы тоқтайды.
Жанудың келесі түрлері бар :
- Толық - оттегінің жеткілікті мөлшерімен немесе артық мөлшерімен жану;
- Толық емес - оттегінің жетіспеушілігімен жану.
Толық жану кезінде жану өнімдері көмірқышқыл газы, су, азот, күкірттің қос тотығы, фосфор ангидриді болып табылады. Толық емес жану кезінде әдетте күйдіргіш, улы, жанғыш және жарылғыш өнімдер түзіледі.
Заттардың жануы тек оттекті ортада ғана емес, сонымен қатар құрамында оттегі, хлор, бром буы, күкірт және т. б белгілі бір заттардың ортасында да жүруі мүмкін.
Жанғыш заттар агрегацияның үш күйінде болуы мүмкін: сұйық, қатты, газ тәрізді. Бөлек қатты заттар қыздырғанда балқиды және буланады, басқалары ыдырайды және газ тәрізді өнімдерді және қатты қалдықты көмір және шлак түрінде шығарады, басқалары ыдырамайды және балқымайды. Көптеген жанғыш заттардың агрегаттық күйіне қарамастан, қыздыру кезінде газ тәрізді өнімдер түзіледі, олар атмосфералық оттегімен араласқанда жанғыш орта түзеді.
Жану теориясындағы ең маңызды мәселе - жалынның таралуы (температураның күрт көтерілу аймақтары және қарқынды реакция) . Жалынның таралуының келесі режимдері бар:
- Қалыпты жану режимі;
- Дефлеграциялық жану;
- Жарылыс;
Қалыпты жану режимі тыныш гетерогенді екі фазалы диффузиялық жану кезінде байқалады. Жану жылдамдығы жану аймағындағы жаңғыш затқа оттегінің диффузия жылдамдығымен анықталады. Жалынның таралуы жалын фронтының әрбір нүктесінен оның бетіне нормаль бойымен жүреді. Мұндай жану мен жалынның қозғалмайтын қоспаның бойымен оның бетіне нормаль бойымен таралу жылдамдығы қалыпты деп аталады.
Қалыпты жану жылдамдығы төмен. Бұл жағдайда қысымның жоғарылауы және соққы толқынының қалыптасуы болмайды.
Нақты жағдайларда ішкі процестердің пайда болуына және сыртқы қиындатқыш факторлардың әсерінен жалын фронты майысқан, бұл жану жылдамдығының жоғарылауына әкелді. Жалынның таралу жылдамдығы секундына ондаған және жүздеген метрге жеткенде, бірақ берілген ортадағы дыбыс жылдамдығынан (300 - 320 м/с) аспайтын болса, жарылғыш жану пайда болады.
Жарылыс режиміне жану реакциясының ұзақтығы газдар үшін ~ 0, 1 сек, булар үшін ~ 0, 2 сек, шаң үшін ~ 0, 5сек.
Осылайша, жану жанғыш зат пен тотықтырғыштың өзара әрекеттесуінің күрделі физика химиялық процесі, реактивті қоспаның бастапқы компонеттерінің жану өнімдеріне айналуымен сипатталады және көп мөлшерде жылу мен жарықтың бөлінуімен бірге жүреді [2] .
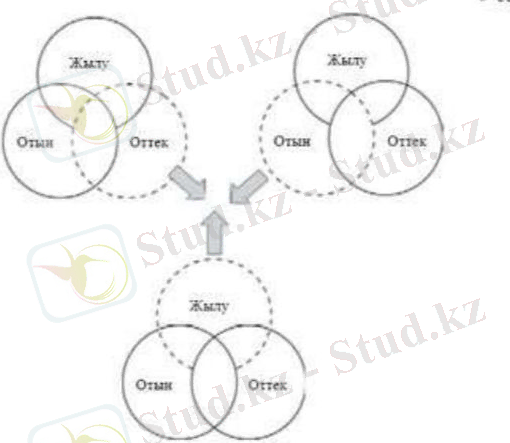
Жанудың басталуы және оны тоқтату шарттары.
Өрт түзілуінің үш құраушысы болады. Бірінші қажетті компонеті - отын (қағаз, ағаш, спирт, газ) ; екіншісі қажетті компонеті - оттек, отын мен әрекеттесіп жану процесі түзіледі; үшінші қажетті компонеті - жылу.
Белгілі температураға дейін қыздырылған отын ғана ауада жанады. Өртті сөндіру үшін оттектің өтуін жабу, не температураны барынша төмендету, не тұтану көзін жою қажет. Өртті сөндіру кезінде көмірқышқыл газы немесе көбік жалынға бағытталады, бұл ауаның жанғыш затқа жетуін қиындатады. Кішкентай өрттерді брезентпен немесе көрпе, жамылғы жабу арқылы өшіреді. Құмды да қолдануға болады. Суды көмірді немесе ағашты сөндіру үшін қолданылады. Су оларды салқындатады, нәтижесінде пайда болатын су буы ауаның енуін қиындатады [3] .
Кесте-1 Жалын түзілуінің үш құраушысы
- Өздігінен жану және оның түрлері
Өздігінен жану - сыртқы тұтану көзі болмаған кездегі жану процесі. Бұл заттың белгілі бір көлеміндегі экзотермиялық реакциялар жылдамдығының күрт жоғарылауымен, жылу бөліну жылдамдығы қоршаған ортаға жылуды шығару жылдамдығынан асатын кезде болады. Өздігінен жанғыш заттар - бұл өздігінен тұтану температурасынан төмен болатын заттар.
Материалдың өздігінен қызу механизмін іске қосатын бастапқы импульске байланысты өздігінен жанудың келесі түрлері бөлінеді:
- Термиялық;
- Химиялық;
- Микробиологиялық;
Термиялық өздігінен тұтану - бұл материалды белгілі бір температураға дейін алдын ала қыздыру арқылы басталуы мүмкін атмосфералық оттегімен материалдың тотығуының экзотермиялық процесі. Бұл материалды өндіру, сақтау немесе пайдалану кезінде қыздырылған беттермен немесе газ ортасымен байланыста болған кезде болуы мүмкін [4] .
Химиялық өздігінен жану - екі заттың бір- бірімен немесе қоршаған ортамен әсерлесуінің нәтижесі, жеткілікті мөлшерде жылу бөлінуімен жүреді.
Ауада, мысалы, сары және ақ фосфор, сілтілік металдар (литий, калий, натрий), сілтілі металдар карбидтері өздігінен тұтанады ( ылғалды ауада ацетилен бөлініп ыдырайды) . Ауада тотығу әсерінен металл ұнтақтары (алюминий, мырыш) өздігінен тұтанады.
Химиялық өздігінен жану жұп заттардың жанасуы кезінде де мүмкін болады, олардың бірі күшті тотықтырғыш, екіншісі оңай тотығатын зат.
Біріншісіне азот қышқылының, калий және натрий перманганатының тұздары, хлораттар, перхлораттар, бихроматтар, сутегі асқын тотығы және т. б.
Екінші топқа сұйық органикалық заттар (екі атомды және үш атомды спирттер, кейбір көмірсутектер) және ұсақ дисперсті қатты органикалық заттар (мысалы үгінділер, түйіршіктелген қант және ұнтақ т. б), жоғарыда аталған металл ұнтақтары жатады.
Микробиологиялық өздігінен жану органикалық дисперсті және талшықты материалдарға тән, оның ішінде микроорганизмдердің тіршілік әрекеті мүмкін (шөп, сабан, көкөністер, астық, ұнтақталған шымтезек және т. б)
Микробиологиялық өздігінен жану нұсқасын әзірлеу кезінде, мүмкіндігінше, келесі ақпаратты алу қажет:
- Өрт кезіндегі шөптің ылғалдылығы туралы (микробиологиялық өздігінен жану үшін ылғалдылық 16% кем болмауы керек)
- Өздігінен жану қауіпі 3-4 айға сақталады.
- Пішіннің өлшемдері (теориялық термофизикалық бағалау бойынша олар кемінде 2x2x2x метр болуы керек, кішірек өлшемдерде шөп үйіндісі жанбайды, өйткені қоршаған ортаға жылу шығыны тым жоғары) .
Сондай-ақ шөпті сақтау және кептіру жағдайларын білу маңызды. Ылғалдандырылған шөптің үйіндіге түсуі немесе шөп қоймасының ағып тұрған төбесінен жекеленген учаскелердің ылғалдануы нәтижесінде процестің ошақтық көрінісі болуы мүмкін. «Пластикалық» өздігінен жану температура айырмашылығына байланысты шөп массасында ылғалдың ауысуы кезінде басталуы мүмкін, мысалы, біркелкі емес қыздыру немесе салқындату кезінде, ал шеткі қабаттарда, жер бетіне жақын жерде конденсациялық ылғал пайда болады [5] .
1. 3 Химия пәнінен АКТ-ны қолданылуыБүгінгі таңда АКТ-ны пайданалу өте маңызды. Қазіргі оқу іс-әрекетінде сабақта ақпараттық-коммуникациялық технологияларды қолданбай жұмыс істеу мүмкін емес. Химия сабақтарында әртүрлі мультимедиялық құралдарды және интерактивті кешенді пайдалану кезінде студенттердің оқулықта көрсетілген жазық кескінінде орындау қиын органикалық қосылыстардың молекулаларының кеңістік құрылымын көру және зерттеу мүмкіндігі бар. Әсіресе, мұғалімнің ғана емес, оқушылардың өздері де материалды игеру деңгейін жылдам тексеруге мүмкіндік беретін өзін- өзі бақылау және тест тапсырмалары өте ыңғайлы.
Жұмыстың мақсаты - химия пәні мұғалімінің жұмысын жүйелеу, 7-11 сыныптарында химияны оқытуда жиі қолданылатын АКТ құралдарын анықтау, химияны оқытуда ақпараттық технологияларды қолдану мүмкіндіктерін көрсету.
Заманауи оқыту жүйесі -бұл әртүрлі технологияларды (аппараттық, бағдарламалық қамтамасыз ету, перифериялық құрылғылар және интернетке қосылу мүмкіндігі) және бір- бірімен бөлісетін білімі мен практикалық тәжірибесі бар адамдарды қамтитын ақпараттық инфрақұрылым.
Тақырып бойынша келесі міндеттер қойылады:
- «Оқу процесінде АКТ қолдану» теориясын оқу;
- Химияны оқытуда АКТ қолдану мүмкіндіктерін ашу;
- АКТ құралдарын сабақтың әртүрлі кезеңдерінде енгізу үшін жүйелеу.
АКТ-ны қолданылатын сабақтар классикалық оқыту жүйесінен түбегейлі ерекшеленеді. Бұл айырмашылық мұғалім рөлінің өзгеруінде жатыр, ол енді білімнің негізгі көзі болып табылмайды, оның қызметі кеңесші нұсқаушыға ауысады. Бұл виртуалды химиялық зертханаларды, интернетті, жаңа оқу құралдарын пайданалудың арқасында болып табылады. Мұғалімнің міндеті - бұл құралдарды оқу материалының мазмұнына, мектеп оқушыларының жас және психологиялық ерекшеліктеріне, сонымен қатар оқушылардың компьютерді пайдалана білуіне сәйкес таңдау [6] .
Химия ең қиын жалпы пәндердің бірі. Мектептегі химия курсының бастапқы деңгейін де ойдағыдай меңгеру оңай емес. Сондықтан мұғалімнің міндеті - әрбір оқушының танымдық іс-әрекетінің қалыптасуы мен дамуын қамтамасыз ететін белсенді іс-әрекетке қосу, оқушылардың химия пәніне деген қызығушылығын арттыру, себебі оқушылардың білім сапасы көбіне олардың химия пәніне деген қызығулығымен анықталады. Бұл мәселені шешуге ақпараттық- технологиялар көмектеседі.
Мультимедиялық оқыту құралдары әмбебап болып табылады, өйткені оларды сабақтың әртүрлі кезеңдерінде қолдануға болады. «Жану реакциялары» тақырыбында аз уақыт ішінде үлкен көлемдегі ақпаратты беру үшін Power Point бағдарламасында жасалған компьютерлік презентацияны пайдаланған жөн деп ойлаймын. Бұл материалды құрылымдауға, оны жалпыма түрде көрсетуге көмектеседі. Презентацияға енгізілген анимацилар, бейне тәжірбиелердің дауысты фрагменттері материалды көрнекі және қабылдау үшін қолжетімді етеді. Жаңа тақырыптың мазмұнын ашу үшін «Телерадио эфир» әдісін Youtube желісі арқылы фосфордың, темірдің, оттектің қарқынды жану үрдісін көрсете аламыз.
Химиялық тәжірбиені жүргізу, бақылау және түсіндіре білу - химиялық сауаттылықтың маңызды құрамдастарының бірі. Химиялық зертханада заттрамен және құрал-жабдықтармен жұмыс істеу, әрине эксперимент дағдыларын құру үшін өте маңызды. Бірақ улы немесе жарылғыш заттар зерттелетін болса, химия кабинетінің белгілі бір реагенттер болмаса, химияны оқытуда ақпараттық технологиялар өте қажет. Бұл жағдайда виртуалды әлемде эксперимент жүргізу жалғыз мүмкіндік болып табылады, мысал ретінде Bilimland сайтын айтуға болды.
Нәтижесінде шынайы материалдарды, ең алдымен көрнекі материалдары пайдаланудың арқасында сабақ дараланады. Сонымен қатар әртүрлі фотосуреттер, плакаттар, мәтіндер, бейнелер диаграммаларды біріктіруге болады [7] .
Барлық оқушылар: Заттың жануын сипаттау және жану реакциясын ұғыну;
Көпшілігі: жану өнімдерінің қоршаған ортаға әсерін білу;
Кейбіреуі: Теорияларды түсіне отырып, ауызша жауап беру;
Қажеттіліктері бар балалар үшін: жану реакцияларын білу ;
Заттың жануын сипаттап, жану реакциясын ұғынады,
Жану өнімдерін қоршаған ортаға әсерін біледі;
Теорияларды түсіне отырып, ауызша жауап береді;
Жану реакцияларын біледі;
Қажеттіліктері бар балалар: Жану реакцияларын біледі;
Сабақтың барысы
Ұйымдастыру кезеңі
(2 минут)
Амандасу.
Сабаққа дайындығын тексеру, психологиялық дайындық, сабақ мақсатын айту.
Сабақтың басы
(5 минут)
Оқушылардың алған білімдерін арттыру мақсатында, «Миға шабуыл» әдісі арқылы жаңа сабақты байланыстыру мақсатында ой қозғау сұрақтарын ұжымдық талқылау. Оқушыларға жалпылама төмендегі сұрақтар беріледі. Әр оқушы өз ойымен бөліседі.
1. Изотоптар дегеніміз не?
2. Сутектің изотоптары:
3. Массалық сан дегеніміз?
Жауабы:
1 Ядро заряды бірдей, бірақ атомдық массалары әртүрлі бір элемент атомдарының түрөзгерісі изотоптар деп аталады.
2 Протий, дейтерий, тритий
3 Атомдағы протондар мен нейтрондардың қосылысы массалық саны деп аталады.
Сабақтың ортасы
(30 минут)
«Жану реакциялар» тақырыбына байлансты Youtube. com платформасы арқылы
видео-ролик.
1-тапсырма
«Миллион кімге бұйырады» әдісі арқылы оқушылар «learningappsapps. org» платформасында берілген сұрақтарға жауап береді.
Дескриптор :
- Жаңа сабақты түсінеді.
- АКТ мен жұмыс жасайды.
2-тапсырма
Топтар суретте бейнеленген жануыды белгілеп, анықтама береді.
Дескриптор:
- Жанудың түрлерін анықтайды
Сергіту сәті
«Сөз тізбегі» әдісі химияға байланысты сөздің соңғы әріпінен жаңа сөз құрастырады.
ЕҚБ-ға тапсырма:
Оттың «үш құраушысын» тап
Дескриптор:
- Оқушылар берілген сұраққа жауап береді.
Экранда көрсетілген видео-роликке назар аударып, зейін қойып тыңдайды. .
Оқушылар оқулықтың көмегімен берілген сұрақтарға жауап береді.
Оқушылар жаңа сабақты түсіне отырып жану реакциялардың түрлерін ажыратады.
Мысалы:
Қан-нуклеотид-ДНҚ
Жауабы: оттек, тұтану көзі, отын
.
https://www. youtube. com/watch?v=tygKiGImuSo
https://learningapps. org/watch?v=p0zo0y30n22
Үлестірме қағаздар
Презентация
Сабақты қорытындылау
(5 минут)
Қорытындылай келе, «Wordwall. net»
платформасы арқылы сәйкестендіру тапсырмасын орындайды.
Дескриптор:
- Білімді бекітеді;
Сабақтың соңы
(3 мин)
Рефлексия
Рефлексия, сабақ туралы өз пікірін білдіру.
-Не сәтті болды?
-Немен жұмыс істеу керек?
-Нені білді?
Өзін-өзі бағалау парағында рефлексивті жазбалар жасаңыз.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz