Каустикалық сода (NaOH): қасиеттері, өндіріс әдістері және өнеркәсіптегі қолданылуы


«ЕСЕНОВ КОЛЛЕДЖІ» ЖШС

Курстық жұмыс
Пәні: Бейорганикалық заттардың химиялық технологиясы
Тақырыбы: Күкірт қышқылының өнеркәсібіндегі шикізаты
Дайындаған: ХТП-19 тобының студенті : Ерленова Назерке
Тексерген: Смагулова Ж.
Ақтау 2023 ж.
Тіркеу №
Мамандығы: 0816000 «Химиялық технология және өндіріс»
Курс: 4
Тобы: ХТП-19
Студенттің аты-жөні: Ерленова Назерке
Пәні: Бейорганикалық заттардың химиялық технологиясы
Курстық жоба тақырыбы: Күкірт қышқылының өнеркәсібіндегі шикізаты
Курстық жоба қорғауға жіберілді « » 2022ж.
Курстық жоба қорғау керек « » 2022ж.
Жетекші: Смагулова Ж.
Қолы
РЕЦЕНЗИЯ
Cтyдeнт, курстық жұмыcындa каустикалық соданы сипаттай отырып, өндіретін цехтың сұлба-нұсқасын және жұмыс істеу принциптеріне толықтай тоқтала отырып және аппараттарының макетін жобалау үшін есептеулерін өз жұмысында толықтай келтірген.
Coнымeн қaтap, автор өз жұмысында каустикалық соданың қасиетеріне де тоқтай келе, каустикалық сода ерекшеліктер мен кемшіліктеріне көп көңіл бөлген.
Автор, жұмысында электрохимиялық әдіс арқылы каустикалық сода өндіру сұлба-нұсқасын макет ретінде келтіріп, керекті есептеулерін жүргізе отырып толықтай сипаттама берген.
Cтyдeнттiң кypcтық жұмыcының мaзмұны ocы мәceлeлepдi қapacтыpғaн 0816000 «Химиялық технология және өндіріс» мамандығы бойынша 4 - кypc cтyдeнтi Ерленова Назерке «Күкірт қышқылының өнеркәсібіндегі шикізаты» aтты кypcтық жұмыcы cтaндapттық тaлaпқa caй тaқыpыбы өзeктi, caпaлы түpдe жaзылғaн жұмыc дeп қapayғa ұcынaмын.
Курстық жобаны қорғады.
Бағасы
Оқытушылар
Мазмұны
2. 3
2. 4
Каустикалық соданың қауіпті қасиеттері және ашылу тарихы
Өнеркәсіптегі синтез
7
10
3. 1
3. 2
3. 3
IV
V
Каустикалық соданы өндірісте алу
Электрохимиялық әдіс арқылы каустикалық сода өндіру
Өндірістің қалдықтары және оларды қайта өндеу
Қортынды
Пайдаланылған әдибеттер
12
16
18
24
25
Кіріспе
Натрий гидроксиді немесе каустикалық сода (NaOH) -ақ түсті ылғалданған зат суда жақсы еритін күшті сілті. Қатты түрдегі ол түссіз, инелі, кристаллды массаылғал тартқыш. Оның кептіргіш ретінде қолданылуы осы қасиетіне негізделген.
Суда өте жақсы ериді, ол жасанды жібек, сабын, органикалық бояу, қағаз, текстиль және т. б. өндірістерінде көптеп қолданылады. Өнім түрінде қатты және сұйық түрінде шығарылады. Қатты түріндегі натрий гидроксиді 2 маркалы: А және Б сәйкесін-ше химиялық және диафрагмалық түрінде шығарылса, сұйық күйінде 5 маркалы: А сынаптық, Б диафрагмалық сапаландырыл-ған, В диафрагмалық, және Д химиялық. Каустикалық соданы өндірісте 3 түрлі әдіспен алады. Олар: әкті, ферритті, электрохимиялық.
Каустикалық сода алудың өнеркәсіптік және зертханалық әдістері бір-бірімен тығыз байланысты. Көбінесе өнеркәсіптік нысандарға қарағанда кішігірім зауыттарда химиялық және электрохимиялық әдістермен аз мөлшерде алынады. Күнделікті өмірде каустикалық соданың басқа да атаулары бар: NaOH, натрий гидроксиді, каустикалық, каустикалық сілті.
II. Негізгі бөлім
2. 1 Каустикалық сода дегеніміз не?
Каустикалық сода дегеніміз не: Каустикалық сода натрий гидроксиді (NaOH) үшін ортақ аттардың бірі болып табылады. Оның жалпы атауы натрий гидраты ретінде химиялық сәйкестендірілген және ол каустикалық немесе коррозиялық болып табылады . Таза пішінде каустикалық сода балауыз, ақ қатты болып табылады. Ол суды сіңіреді және су ерітінділерін құрайды .
Егер ол адам терісіне, шырышты қабаттарға немесе көзге тисе, натрий гидроксиді айтарлықтай ауыр химиялық күйік тудырады. Дененің зақымдалған аймағын дереу көп сумен жуыңыз.
Кездейсоқ жұтып қойса, көмейге, ауыз қуысына, асқазанға, өңешке зақым келтіреді (химиялық күйік) . Алғашқы көмек ретінде жәбірленушіге су немесе сүт ішуге болады.
E524 қоспасының ғылыми атауы - натрий гидроксиді немесе каустикалық сода. Синтетикалық шыққан бұл өте агрессивті заттың табиғатта аналогтары жоқ. Табиғи жағдайда ол ұстағанда ақ үлпек немесе кішкене сабынды түйіршіктер түрінде болады.
Қазіргі уақытта ол өмірдің әртүрлі салаларында, соның ішінде медицинада, фармакологияда және тамақ өнеркәсібінде кеңінен қолданылады. Ауыл шаруашылығында, мысалы, каустикалық сода сиырларды қоспаларға тексеру үшін қолданылады. Бұл зат тұрмыстық химияның әртүрлі түрлерін өндіруде қолданылады (ең танымалы су мен кәріз құбырларын тазалауға арналған) . Косметологияда каустикалық сода сусабындарға, сабындарға, лак кетіргіштерге, кремдерге, сонымен қатар кератинденген теріні кетіруге арналған өнімдерге қосылады. Сонымен қатар, натрий гидроксиді мұнай өңдеуде, целлюлоза-қағаз өнеркәсібінде және дизельдік отын өндірісінде таптырмас зат болып табылады.
Тамақ өнеркәсібінде натрий гидроксиді қышқылдықты реттеу үшін тұрақтандырғыш және эмульгатор ретінде қолданылады. Өте агрессивті қасиеттерге және жанама әсерлердің әсерлі тізіміне қарамастан, каустикалық сода бүкіл әлемде диеталық қоспа ретінде рұқсат етілген. [1]
2. 2 Каустикалық соданың физикалық және химиялық қасиеттері
Молекуланың химиялық формуласы және құрылысы: Бұл затты химия тұрғысынан қарастыратын болсақ, онда ол екі ионнан тұрады: натрий катионы (Na+) және гидроксидті анион (OH -) . Әртүрлі зарядталған бөлшектердің электростатикалық тартылуына байланысты бір-бірімен байланысқан бұл иондар күйдіргіш сода түзеді. Эмпирикалық формула NaOH болады.
Гидроксо тобы оттегі мен сутегі арасында түзіледі, ал натриймен ол иондық байланыста болады. Ерітіндіде сілті күшті электролит бола отырып, иондарға толығымен диссоциацияланады.
Физикалық қасиеттері:
Ақ ұнтақты зат, кейде түссіз. Ол майда кристалды ұнтақ түрінде немесе үлпек түрінде болуы мүмкін. Көбінесе ірі кристалдар түрінде. Балқу температурасы айтарлықтай төмен - 65, 1 o C. Ол ылғалды өте тез сіңіреді және гидратталған NaOH 3, 5H 2 O түріне өтеді. Бұл жағдайда балқу температурасы одан да төмен, небәрі 15, 5 o C. Спирттерде шексіз дерлік ериді. , су. Қатты және сұйық сабынды сезінеді.
Концентрлі және сұйылтылған түрде өте қауіпті. Ол оптикалық нервтерге дейін көздің барлық қабықтарын зақымдауы мүмкін. Көзге тию соқырлыққа әкелуі мүмкін. Сондықтан бұл қосылыспен жұмыс істеу өте қауіпті және қорғаныс құралдарын қажет етеді.
Химиялық қасиеттері:
Каустикалық сода барлық сілтілер сияқты дәл осындай қасиеттерді көрсетеді: ол оксидтермен, амфотерлі оксидтермен және гидроксидтермен, тұздармен әрекеттеседі. Бейметалдардан күкіртпен, фосформен және галогендермен әрекеттеседі. Сондай-ақ металдармен әрекеттесуге қабілетті.
Органикалық химияда натрий гидроксиді амидтермен, эфирлермен және галогенмен алмастырылған алкандармен әрекеттеседі. [2]
2. 3 Каустикалық соданың қауіпті қасиеттері және ашылу тарихы
Каустикалық сода - өте қауіпті зат. Тері мен шырышты қабаттармен байланыста терең және өте ауыратын жаралар пайда болады. Каустикалық соданың көзге тиюі өте қауіпті, өйткені ол көру нервінің атрофиясын тудырады, бұл соқырлыққа әкеледі. Егер каустикалық сода ұнтағы кездейсоқ ингаляцияланса, ауыр жөтелдің шабуылы басталады, тыныс алудың қысқаруы, тамақ ауруы пайда болады, тіпті тыныс алу жолдарының ісінуі мүмкін. Және бұл заттың ішкі ағзаларымызбен не істей алатынын елестетуге болады. Егер сіз каустикалық соданы кездейсоқ жұтып қойсаңыз, іште қатты ауырсыну және жану сезімі өте тез пайда болады, анафилактикалық шок мүмкін. Натрий гидроксидімен улану туралы ең аз күдік туындаған кезде дереу жедел жәрдем шақыру маңызды. Күйдіргіш содадан зардап шеккен тері аймақтарын бор немесе сірке қышқылының жұмсақ ерітіндісімен, шырышты қабаттарды таза сумен, көзді алдымен бор қышқылының өте әлсіз ерітіндісімен, содан кейін сумен өңдеу керек.
Натрий гидроксиді тамақ өнеркәсібінде микродозаларда қолданылғанымен, құрамында E524 бар тағамды үнемі қолданғанда жанама әсерлер болуы мүмкін.
E524 тағамдық қоспасы әртүрлі функцияларды орындайтын әртүрлі өнім топтарында болуы мүмкін. Кем дегенде, жиі натрий гидроксиді бар джемдер мен мармеладтарды алыңыз. Өнімдердің осы тобында қоспа қышқылдық деңгейін реттеуші және тұрақтандырғыш рөлін атқарады. Егер сіз пісіруге арналған қамырға белгілі бір мөлшерде каустикалық сода қоссаңыз, онда дайын өнім әдемі қызғылт қытырлақ қыртыс алады. [3]
Күйдіргіш содадан жасалған ең танымал тоқаш - неміс бауырсақтары. Қара консервілер E524 қосымшасының арқасында қара түсті және тән құрылымын алады. Майлардың басқа түрлерінен жасалған өнімдерде натрий гидроксиді ыдырауды тездетеді. Бұл қосымша жемістерді теріден тез және оңай тазарту қажет болған кезде де көмекке келеді. Мұны істеу үшін жемістер, жидектер немесе көкөністер жай ғана каустикалық содамен өңделеді. Сонымен қатар, E524 қышқылдық реттегіші ашытылған сүт өнімдерін, тәттілердің әртүрлі түрлерін өндіруде қолданылады.
Натрий гидроксиді - қауіпті химиялық қосылыс. Тамақ өнеркәсібінде E524 әдетте адамдарға қауіп төндірмейтін шағын дозаларда қолданылғанымен, шамадан тыс сақтық зиян келтірмейді. Егер сіз E-құрамы бар тағамдардан бас тартқыңыз келмесе немесе бас тарта алмасаңыз, кішкентай балалардың диетасындағы «жаңғақтардың» санын барынша азайтуға тырысыңыз. Бұл үшін өнімді сатып алмас бұрын оның неден тұратынын тексеруді ұмытпаңыз.
Жыл сайын үлкен партиялармен синтезделетін маңызды химиялық қосылыстардың бірі сілтілі натрий гидроксиді болып табылады. Ол өзінің қасиеттерінің арқасында осындай танымалдыққа ие болды. формуласы NaOH, адам үшін үлкен өнеркәсіптік маңызы бар. Бұл затты толығырақ қарастырайық.
Ашылу тарихы
Қасиеттері бойынша дәл каустикалық содаға ұқсайтын қосылыс туралы ескертулер алғаш рет ежелгі уақытта пайда болды. Тіпті Киелі кітапта Мысыр көлдерінен алынған нетер заты туралы кейбір мәліметтер бар. Болжам бойынша бұл каустикалық сода болған.
Аристотель, Платон және басқа да ежелгі грек және рим философтары мен ғалымдары табиғи су қоймаларынан алынатын және әртүрлі түсті үлкен кесектер (қара, сұр, ақ) түрінде сатылған нитрум затын атап өтеді. Өйткені, ол кезде тазалау әдістері туралы ештеңе білмейтін, сондықтан қосындыны ластайтын көмірден ажырату мүмкін болмады. [4]
Біздің эрамызға дейінгі 385 жылы сабын жасау қолданылған. Процесс каустикалық содаға негізделген. Оның формуласы, әрине, әлі белгісіз болды, бірақ бұл оны Солянка тұқымдас өсімдіктердің күлінен, көлдерден алуға және тұрмыстық заттарды тазалауға, кір жууға және әртүрлі сабын жасауға пайдалануға кедергі болмады.

Сурет-1 Каустикалық сода
Біраз уақыттан кейін арабтар өнімге эфир майлары мен хош иісті заттарды қосуды үйренді. Содан кейін сабын әдемі және жағымды иісті болды. Сабын жасау процестері мен технологияларының белсенді дамуы басталды.
17 ғасырға дейін қасиеттері күшті және негізгі қолданылған каустикалық сода химиялық қосылыс ретінде зерттелмеген. Ол сода, натрий гидроксиді сияқты заттармен қосылды. Олардың барлығы күйдіргіш сілтілер деп аталды.
Кейінірек ғалым Дюамель дю Монсо бұл заттардың арасындағы айырмашылықты дәлелдеп, сілтілер мен тұздарға бөлді. Содан бері каустикалық сода бүгінгі күнге дейін өзінің шынайы және тұрақты атауын алды.
2. 4 Өнеркәсіптегі синтез
Каустикалық сода сияқты зат өнеркәсіпте қалай алынады: Сұйық және қатты күйдіргіш көбінесе электрохимиялық әдіспен алынады. Ол табиғи минералды галит ерітіндісінің электролизіне негізделген, оның басым көпшілігі ас тұзымен түзіледі.
Бұл синтездің негізгі ерекшелігі, жанама өнімдер күйдіргіш содамен бірге газ тәрізді хлор және сутегі болып табылады. Процесс үш нұсқаның кез келгенінде жүзеге асырылады:
• қатты катодта диафрагмалық электролиз;
• сұйық сынап катодымен;
• қатты катодты мембрана.
Әлемде өндірілетін каустиктің басым көпшілігі әлі де мембраналық әдіспен түзіледі. Алынған сілтінің жеткілікті жоғары тазалығы бар. [5]
Қолдану аймақтары: Каустикалық сода өзекті болып табылатын бірнеше салалар бар. Қолданба оның химиялық және физикалық қасиеттеріне негізделген, бұл қосылысты көптеген синтездер мен процестерде таптырмас етеді. Натрий гидроксиді таптырмайтын элемент болып табылатын бірнеше негізгі аймақтар бар.
1 Химиялық өндіріс (көптеген процестерде катализатор ретінде күрделі эфирлерді, сабындарды, майларды синтездеу, талшықтарды өндіру, алюминийді қию, мұнай өнімдерін алу үшін; бұл қышқылдарды және оларға сәйкес оксидтерді бейтараптандырудың негізгі заты; аналитикалық химияда бұл титрлеу үшін қолданылады, сонымен қатар таза металдарды, көптеген тұздарды, басқа негіздер мен органикалық қосылыстарды алу үшін қолданылады) .
2 Ағаш массасын өңдеуге арналған қағаз өндірісінде (ағаш заты лигниннен құтылу) .
3 Каустикалық сода адамның шаруашылық қызметінде де таптырмас зат. Көптеген жуғыш заттарды және оған негізделген тазалау құралдарын пайдалану өте маңызды. Сабын жасау, сусабындар алу - мұның бәрі каустикалық содасыз аяқталмайды.
4 Биоотын синтезі үшін қажет.
5 Ол организмдерге әсер ететін агенттерді газсыздандыру және бейтараптандыру үшін ұлттық ауқымда қолданылады.
6 Дәрілік заттар мен препараттарды өндіру.
7 Тамақ өнеркәсібі - кондитерлік өнімдер, шоколад, какао, балмұздақ, тәттілерді бояу, зәйтүн, нан өнімдерін пісіру.
8 Косметологияда бөтен түзілімдерді (мольдер, папилломалар, сүйелдер) жоюға арналған.
9 Ол алкогольдік сусындар мен темекі зауыттарында қолданылады.
10 тоқыма өнеркәсібінде.
11 Шыны өндірісі: түсті, қарапайым, оптикалық және т. б.
Әлбетте, натрий гидроксиді адам әрекетінде өте маңызды және пайдалы зат. Оның әлемде жыл сайын тоннамен - 57 миллион немесе одан да көп синтезделетіні бекер емес.
Сұйық натрий сілті: Кристалдан басқа, каустикалық соданың су ерітіндісі де бар. Оның формуласы қатты зат сияқты. Химиялық тұрғыдан ерітінділер неғұрлым қолайлы және қолдануға ыңғайлы. Сондықтан бұл пішінде каустик жиі қолданылады. Формула NaOH болатын каустикалық сода ерітіндісі жоғарыда аталған барлық салаларда қолданылады. Бұл тек тасымалдау кезінде ыңғайсыз, өйткені құрғақ каустикті тасымалдау жақсы. Барлық басқа қасиеттері бойынша ол кристалдардан ешбір кем түспейді, ал кейбіреулерінде олардан асып түседі.
ІІI. Техникалық бөлім
3. 1 Каустикалық соданы өндірісте алу
Каустикалық соданы өндірісте 3 түрлі әдіспен алады. Олар: әкті, ферритті, электрохимиялық. Әкті әдіс негізінде мына реакция арқылы алынады:
Na₂CO₃ + Ca(OH) ₂ = 2NaOH + CaCO₃↓
Бұл кезде пайда болған натрий гидроксиді тұнбадан бөлініп алып, буландырылады. Бұл үрдіс қайтымды тепе-теңдік шарттары кальций гидрототығы мен карбонатының ерігіштіктің арақатына-сымен анықталады. Каустификациялау дәрежесі берілген ерітінді-дегі соданы шоғырлануы азайған сайын және температурасы тө-мендеген сайын көтеріле береді. Алайда іс-жүзінде үрдісті реагенттердің әрекеттесу жылдамдығын арттыру үшін және кальций карбонатының ірі кристалды тұнбасын алу үшін 800-1100°С арасында жүреді. Әдетте натрий карбонатын натрий гидроксидіне айналуы 90-95%-ға жетеді және құрамында 100-120г/дм3 натрий гидроксиді бар сілтілік ерітінді алады.
Әкті әдістің негізгі сатылары:
1. Сода ерітіндісін декарбонатор сұйығынан жуатын сулардан және уландыру тұзының ерітіндісінен дайындайды.
2. Сода ерітіндісін әкпен сөндіргіш каустификаторда өндеу және каустификаторда суспензияны ары қарай алмастыру.
3. Тұнбалықты бояу.
4. Декарбонатор ерітіндінің 1 бөлігін бөліп алынған тұнбалықпен өңдеу.
5. Тұнбалықты жуу. 6. Вакуум буландырғыш аппараттарда натрий
7. Сусыздандырылған сілтілікті скді ерітіндісін кептіру.
8. Сілті еріткіш 610г/дм" қа дейін шоғырландыру үшін буландыры-лады.
9. Сілтілікті одан әрі буландыру.
10. Ең соңғы буландыру және каустикалық соданы балқыту.
11. Балқытылған натрий сілтісін барабандарға құю. [6]
Натрий гидроксиді немесе каустикалық соданы ферритті әдіс арқылы алуға болады:
Na₂CO₃ + Fe₂O₃ = Na O-Fe₂O₃ + CO↑
Na₂O * Fe + 2H₂O = 2NaOH + Fe₂O₃*H₂O
Бұл әдіс арқылы да натрий гидроксидін тұнбадан (Fe2O3-H2O) бөліп алып, буландырып, кептіріп және балқытып, өнім ретінде алады. ТМД елдерінде, сонымен қатар Қазақстанда каустикалық соданы ферриттік әдіспен алу кеңінен қолданылады. Оған себеп өндірістік қалдықтың болмауы, өнім шоғырының жоғарылығы, нат-рий гидроксиді ерітіндісін буландыруға қажетті бу шығымының төменділігі.
Каустикалық соданы ферритті әдіспен өнді үлгісі.
1) рельсті жол өндіру процесінің технологиялық
2) сода тасымалдауға арналған вагонетка
3) сода қабылданатын сыйымдылық
4) элеватор
5) сода шаңына арналған сыйымдылық
6) қоспа элываторы
7) қоспа араластырғышы
8) тac
9) қоспа дозалагышы
10) қоспа элеваторы
11) феррит пеші
12) шаң камераларына апаратын
13) мазут қыздырғышь
14) сөндіргіштен буды әкететін желдеткіш
15) рекуператор
16) феррит сөндіргіштік элеватор
17) сілтілегіштер
18) шайылған темір тотығын тасымалдагын
Ферритті пеште температура 1050-1100°С болады. Пештен шыққан феррит сумен әрекеттесіп сілті түзеді, ал тұнбаға түскен темір тотығы жуылып, ондірістің басына қайтарылады. Каустикалық сода өндірісі тұндырғыштарға, одан әрі буландыруға жібері-леді және қажетті шоғырлы сілті алады. Феррит пешінен шыққан газдар 420-450°С-та газ жолымен әкетіледі, онда 20%-ға дейін сода шаңы болады. Олар тазаланып, электрофильтрлерден өткізіліп, таза газ ауаға жіберіледі, ал ұсталынған сода шаңдары қайтадан араластырғышқа беріледі. Феррит пеші болаттан жасалған барабан тәрізді аппарат. Ішкі диаметрі-2м, ұзындығы-12, 5-14м, қабырғасының қалыңдығы -15мм, пешті ферригті түсіретін жағындағы түбінде диаметрі-400мм саңылаулары бар. Олар арқылы пешке ауа келіп, феррит пешінің өнімділігі 14. 2-17т/тәулік аралығында болады. [7]
Натрий гидроксидін немесе каустикалық соданы өндірудің 3-ші жолы -электрохимиялық әдіс. Электрохимиялық әдіс негізінде ас тұзы ерітінділерін электролиздеу арқылы жүргізеді. Бұл әдіс өте көп шығынды, яғни энергиялық шығынды көп жұмсауына байланысты әдіс көп қолданылмайды.
Сода ерітіндісін каустификациялау - каустикалық соданы алудың әктік тәсілін негізгі операциясы. Сода ерітіндісін әкпен немесе әк сутімен өндеу кезінде алмасу реакциясы жүреді де натрий гидрокарбонатының ерітіндісі пайда болады: Na₂CO₃ + Ca(OH) ₂ - 2NaOH + CaCO₃ (1)
Реакцияның тепе-теңдік константасы:
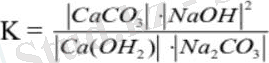 (2)
(2)
Жүйеде қатты заттар бар кезінде Са(ОH) ₂ CaCO₃ концентратциясы бір шамада тұрақты деуге болады, яғни:концентрациясын бір
(3)
[ОН⁻] және [СО₃⁻] мәндерін тұздардың ерігіштік көбейтілерімен алма алмастыру арқылы тепе-теңдік константасының мәнін табуға болады.
ПР (Са(OH) ₂) = [Caᵌ⁺] [ОН⁻] (4)
ПР (CaCO₃) = [Caᵌ⁺] -[CO₃ᵌ⁻] (5)
Теңдеулерді өзгерту арқылы
(6)
Бұл тепе-теңдіктің негізгі көрсеткіштері 1 кестеде келтірілген. Кестедегі сандарға қарағанда сода ерітіндісінің концентрациясы төмен кезінде каустификация дәрежесі өседі. [8]
1-кесте
Жалпы концентрация (каустификацияга
дейін (г-экв) /л
Каустификациядан кейінгі концентрация
Каустифика-ция
дәрежесі, А %
5, 375
5, 125
4, 900
3, 842
3, 073
2, 045
4, 34
4, 220
4, 095
3, 444
2, 903
1, 982
0, 518
0, 408
0, 403
0, 199
0, 085
0, 032
36, 4
39, 3
41, 7
59, 6
99, 1
124, 9
80, 7
82, 3
83, 6
89, 6
94, 5
96, 9
Температура көтерілгенде кальций гидроксроксидінің ерігіштігі азаяды, сондықтан тепе-теңдік константасының мәні төмендейді. Мысалы, СаСО3 гидролизы мен карбонатының ерігіштігі арқылы анықталғанда, 20°С кезінде K'=2100, ал 90°С кезінде К = 90. Сондықтан каустификацияны толық жүргізу үшін температураны 15-20°С ұстауға болар еді. Бірақ, төмен температурада реакци жыдығы төмен және пайда болатын кальций карбонаты өте майда болғандықтан оны сүзу қиындыққа әкеледі. Оңай сүзілетін тұнба алу үшін процессті жоғары температурада жүргізеді.
Практикада каустификацияны Na₂CO₃ 2-3 н ерітіндісімен (шамада 10-15%масс) 80°С кезінде жүргізеді. Соданын 90%-не дейінгісі NaOH айналады да, құрамында 100-120 г/л NaOH бар ерітінді алады. Процесс жылдамдығы пайдаланған әк мөлшеріне және қасиетіне, түйіршіктер өлшеміне, әк тасын күйдіру режиміне, материалда қоспалардың болуына байланысты.
3. 2 Электрохимиялық әдіс арқылы каустикалық сода өндіру
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz