Ауаны сұйылту арқылы оттегі өндіру технологиясы және технологиялық есептеулер


МАЗМҰНЫДИПЛОМДЫҚ ЖҰМЫС
Тақырыбы: Ауаны сұйылту арқылы оттегі өндіру
Үдерістің материалдық балансы
Негізгі аппараттың құрылымдық есептері
КІРІСПЕ
Соңғы жиырма жылда оттегі, азот, аргон, криптон-ксенон қоспаларын алу үшін терең салқындату арқылы ауаны бөлу техникасының дамуы дербес саланың қалыптасуына әкелді.
Қазіргі уақытта бір қондырғыда 30 мың м3/сағ-тан астам ауаны өңдейтін көптеген ауа бөлу қондырғылары жұмыс істейді.
Оттегі инженериясының қарқынды дамуы қазіргі заманғы технологияның көптеген маңызды салаларында оттегін, сондай-ақ ауаны бөлудің басқа өнімдерін пайдаланудың жоғары тиімділігіне байланысты.
Оттегі, азот және аргон өндірісінің экономикалық мәні мен ауқымы негізінен қара және түсті металлургия мен химия өнеркәсібінің дамуымен анықталады.
Түсті металлургияда оттегін пайдалану да бірдей маңызды. Мырыш, мыс, қорғасын, никельді балқытуда, мыс штейнін конверсиялауда, тотыққан никель рудаларын шахталық балқытуда және қорғасын агломератында, мырыш концентраттарын «сұйықталған қабатта» күйдіруде және басқа процестерде оттегін пайдалану. балқыту қондырғыларының өнімділігін 50-70%-ға арттыру. Химия өнеркәсібі оттегі мен азотты аммиак, метанол, ацетилен, азот қышқылы және басқа да химиялық өнімдер алуда пайдаланады.
Оттегі машина жасауда және металл өңдеуде металды кесу және дәнекерлеу процестерінде кеңінен қолданылады.
Соңғы онжылдықтарда оттегі авиациялық және зымырандық техниканың дамуында маңызды рөл атқарды, ол реактивті қозғалтқыштар мен күшейткіштердегі ең жақсы отын тотықтырғыштарының бірі болды.
Өнеркәсіптің әртүрлі салаларында оттегімен қатар газ және сұйық түрдегі азот кеңінен қолданылады. Газ тәріздес азот қара және түсті металлургияда, химия және мұнай-химия өнеркәсібінде арнайы болаттар мен қорытпаларды балқыту және әртүрлі өнімдерді өндіру үшін инертті орта ретінде қолданылады.
Сұйық азот қазіргі криогендік технологияда, ауыл шаруашылығында мал ұрығын сақтау үшін, медицинада, тамақ өнеркәсібінде ұзақ сақтау және тасымалдау кезінде тамақ өнімдерін мұздату үшін, машина жасауда металдарды қатайту үшін және техниканың басқа салаларында кеңінен қолданылады.
Ауадан бөлінетін инертті газдардың маңызы артып келеді. Аргон болат балқытудың жаңа металлургиялық процестерінде, титан-магний өнеркәсібінде, жартылай өткізгіштер өндірісінде, металдарды аргон-доғалық дәнекерлеу процестерінде кеңінен қолданылады. Электр лампа өнеркәсібінде криптон, ксенон, неон кеңінен қолданылады, ал сұйық неон криогендік технологияда қолданылуы мүмкін.
Бұл жұмыста оттегін алу және технологиялық процесті ұйымдастыру туралы теориялық мәліметтер қарастырылады, содан кейін ауаны бөлу қондырғысының жылулық есебі, ректификация процесін есептеу және буландырғыш конденсаторды таңдау жүргізіледі.
Азот қышқылы өзінің өндірілетін мөлшері жағынан күкірт қышқылынан кейін екінші орын алады. Азот қышқылының жылдан жылға өндіру көлемінің артуы, азот қышқылының және оның тұздарының халық шаруашылығындағы маңызымен түсіндіріледі. Азот қышқылы азот қосылыстарының ішіндегі өте көп және әр түрлі маңызды жерлерде қолданылады. Халық шаруашылығында оның көп мөлшері азотты фосфор, таза фосфор тыңайтқыштарын, пластмассалар, жасанды талшықтар, органикалық бояулар, қопарғыш заттар, дәрі-дәрмек алуға жұмсалады. Сонымен қатар азот қышқылы оның тұздарын (нитраттарды) өндіруге, күкірт, фосфор қышқылдарын алуға көптеген металдарды ерітуге және түтінденетін азот қышқылы ракета техникасында, ракета отыннан тотықтыратын зат ретінде де қолданылады.
Қазіргі кезде 75-80 % азот қышқылы нитраттар және күрделі тыңайтқыштар алуға, 10-15 % жарылғыш заттар және синтетикалық бояулар алуға жұмсалады.
Концентрлі азот қышқылы қопарғыш заттар: тротил, гексаген, мелинит, ксилил, тетрил, нитроглицерин өндірісінде пайдаланылады. Қопарғыш зат ретінде аммониттер -аммоний селитрасының ароматты қосылыстарының нитротуындыларының қоспасы кең қолданылады. Азот қышқылы мен сұйық азот төрт оксиді ракета техникасында тотықтырғыш ретінде қолданылады.
Азот қышқылы негізінде азот тұздары (нитраттар) мен күрделі тыңайтқыштар өндірісінде қолданылады. Нитрат күйіндегі азотты өсімдіктер жақсы сіңіреді, ауыл шаруашылығына құрамында азоты бар минералды заттар өте көп пайда келтіреді.
Біздің Республикамызда аммиак және азот қышқылы өндірісі Ақтау қаласында орналасқан. Жылына 300 мың тонна аммиак және 400 мың тонна азот қышқылын өндіруге болады.
II НЕГІЗГІ БӨЛІМ
2. 1 Оттегінің физикалық қасиеттері
Дүниежүзілік мұхитта еріген O2 мөлшері суық суда көп, ал жылы суда аз болады. Сұйық оттегі қалыпты жағдайда оттегі-түсі, дәмі мен иісі жоқ газ. 1 л оның массасы 1, 429 г құрайды. Ауадан сәл ауыр. Суда әлсіз ериді (0 °C температурада 4, 9 мл/100 г, +50 °C температурада 2, 09 мл/100 г) және алкоголь (+25 °C температурада 2, 78 мл/100 г) . Ол балқытылған күмісте жақсы ериді (+961 °C температурада 1 Ag көлемінде 22 O2 көлемі) . Перфторланған көмірсутектерде жақсы ериді(20-40 айн/айн%) . Атомаралық қашықтық-0, 12074 нм. Бұл парамагнетик. Сұйық түрінде ол магнитпен тартылады. Оттегі газын қыздыру кезінде оның атомдарға қайтымды диссоциациясы жүреді: +2000 °C - 0, 03%, +2600 °C - 1 %, +4000 °C - 59 %, +6000 °C - 99, 5 %. Сұйық оттегі (қайнау температурасы -182, 98 °C) - ақшыл көк сұйықтық.
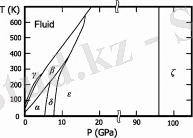
Сурет 1. O2 фазалық диаграммасы
Қатты оттегі (балқу температурасы -218, 35 °C) - көк кристалдар. 6 кристалды фаза белгілі, олардың үшеуі 1 атм қысымда болады. :
α - O2-23, 65 к-ден төмен температурада болады; ашық көк кристалдар моноклиндік сингонияға жатады, ұяшық параметрлері a=5, 403 Å, b=3, 429 Å, c=5, 086 Å; β=132, 53°.
β - O2-23, 65-тен 43, 65 К-ге дейінгі температура аралығында болады; бозғылт көк кристалдар (қысым жоғарылаған кезде түсі қызғылт түске айналады) ромбоэдрлік торға ие, ұяшық параметрлері a=4, 21 Å, α=46, 25°.
γ-O2 - 43, 65-тен 54, 21 К-ге дейінгі температурада болады; бозғылт көк кристалдардың текше симметриясы бар, тор кезеңі a=6, 83 Å.
Жоғары қысымда тағы үш фаза пайда болады:
δ-O2-температура аралығы 20-240 К және қысым 6-8 ГПа, сарғыш кристалдар;
ε-фаза, құрамында O4 немесе o8 молекулалары бар, 10-нан 96 гПа-ға дейінгі қысымда болады, кристалдардың түсі қою қызылдан қараға дейін, моноклиникалық сингония;
ζ-давление-96 ГПа-дан жоғары қысым, металл күйі.
Ауада оттегі жай ғана ерекшеленбейді, өйткені қалыпты жағдайда ол дәмсіз, түссіз және иіссіз газ болып табылады. Бірақ оттегін жасанды түрде басқа агрегаттық күйлерге ауыстыруға болады. Сонымен, - 183ос кезінде ол сұйық болады, ал-219ос кезінде ол қатаяды. Бірақ қатты және сұйық оттегін тек адам ала алады, ал табиғатта ол тек газ күйінде болады. Сұйық оттегі келесідей көрінеді.

Сурет 2. Сұйық оттегі
Ол қатты мұзға ұқсайды. Оттегінің физикалық қасиеттері де қарапайым зат молекуласының құрылымы болып табылады. Оттегі атомдары осындай екі затты құрайды: оттегі (O2) және озон (O3) . Төменде оттегі молекуласының моделі көрсетілген.

Сурет 3. оттегі молекуласының моделі көрсетілген.
2. 2 Оттегінің химиялық қасиеттері
Оттегінің электрондық құрылымы (1s22s22p4) О атомы екі электронды сыртқы деңгейге қабылдайтындай, тұрақты сыртқы электрондық қабат түзіп, O2- ионын құрайды. Сілтілік металдар оксидтерінде негізінен иондық байланыстар түзіледі. Бұл металдардың электрондары толығымен дерлік оттегіге тартылады деп болжауға болады. Белсенділігі аз металдар мен бейметалдардың оксидтерінде электрондардың ауысуы толық емес, ал оттегідегі теріс заряд тығыздығы азырақ көрінеді, сондықтан байланыс аз ионды немесе ковалентті болады.
Металдардың оттегімен тотығуы кезінде жылу бөлінеді, оның шамасы M-O байланысының беріктігімен корреляцияланады. Кейбір бейметалдардың тотығуы кезінде жылу жұтылады, бұл олардың оттегімен байланысының әлсіздігін көрсетеді. Мұндай оксидтер термиялық тұрақсыз (немесе иондық байланысқан оксидтерге қарағанда тұрақты емес) және жиі реактивтілігі жоғары. Салыстыру үшін кесте ең типтік металдардың, өтпелі металдардың және бейметалдардың, А және В топшаларының элементтерінің оксидтерінің түзілу энтальпияларының мәндерін көрсетеді (минус белгісі жылу бөлінуін білдіреді) .
Кесте 1
Күшті тотықтырғыш, фтордан кейінгі ең белсенді бейметал, гелий, неон және аргоннан басқа барлық элементтермен екілік қосылыстар (оксидтер) түзеді. Ең көп таралған тотығу дәрежесі -2. Әдетте, тотығу реакциясы жылудың бөлінуімен жүреді және температураның жоғарылауымен жеделдейді (Жануды қараңыз) . Бөлме температурасында жүретін реакциялардың мысалы:
4Li + O 2 → 2Li 2 O
2Sr + O 2 → 2SrO
Құрамында максималды емес тотығу дәрежесі бар элементтер бар қосылыстарды тотықсыздандырады:
2NO + O 2 → 2NO 2 ↑
Жану реакцияларында көптеген органикалық қосылыстарды тотықсыздандырады:
2C 6 H 6 + 15O 2 → 12CO 2 + 6H 2 O
CH 3 CH 2 OH + 3O 2 → 2CO 2 + 3H 2 O
Белгілі бір жағдайларда органикалық қосылыстардың жұмсақ тотығуын жүзеге асыруға болады:
CH 3 CH 2 OH + O 2 → CH 3 COOH + H 2 O
Оттегі Au және инертті газдардан (He, Ne, Ar, Kr, Xe, Rn) басқа барлық жай заттармен тікелей (қалыпты жағдайда, қыздырғанда және/немесе катализаторлардың қатысуымен) әрекеттеседі; галогендермен реакциялар электр разрядының немесе ультракүлгін сәулеленудің әсерінен жүреді. Алтын оксидтері және ауыр инертті газдар (Xe, Rn) жанама түрде алынды. Оттегінің басқа элементтермен барлық екі элементті қосылыстарында, фторы бар қосылыстарды қоспағанда, оттегі тотықтырғыштың рөлін атқарады (төменде #Оттегі фторидтерін қараңыз) .
Оттегі формальды түрде -1-ге тең оттегі атомының тотығу дәрежесімен пероксидтер түзеді.
Мысалы, пероксидтер сілтілік металдарды оттегіде жағу арқылы алынады:
2Na + O 2 → Na 2 O 2
Кейбір оксидтер оттегін сіңіреді:
2BaO + O 2 → 2BaO 2
А. Н. Бах пен К. О. Энглер әзірлеген жану теориясына сәйкес, тотығу аралық асқын тотығы қосылысының түзілуімен екі кезеңде жүреді. Бұл аралық қосылысты бөліп алуға болады, мысалы, жанып тұрған сутегінің жалыны мұзбен салқындаған кезде сумен бірге сутегі асқын тотығы пайда болады:
H 2 + O 2 → H 2 O 2
Супероксидтерде оттегінің тотығу дәрежесі ресми түрде -½, яғни екі оттегі атомына (ион О2) бір электрон.
Жоғары қысымда және температурада пероксидтердің оттегімен әрекеттесуінен алынады:
Na 2 O 2 + O 2 → 2NaO 2
Калий К, рубидий Rb және цезий Cs оттегімен әрекеттесіп, супероксидтер түзеді:
K + O 2 → KO 2
Бейорганикалық озонидтердің құрамында O− ионы бар 3 оттегінің тотығу дәрежесі формальды түрде -1/3-ке тең. Сілтілік металдар гидроксидтеріне озон әсерінен алынған:
3KOH + 3O 3 → 2KO 3 + KOH ∗ H 2 O + 2O 2 ↑
Химия өнеркәсібінде оттегі тотықтырғыш ретінде көптеген синтездерде қолданылады, мысалы, көмірсутектерді құрамында оттегі бар қосылыстарға (спирттер, альдегидтер, қышқылдар), күкірттің қос тотығынан күкірт триоксидіне дейін, аммиакты азот оксидтеріне дейін тотықтыру. азот қышқылы. Тотығу кезінде дамыған жоғары температураға байланысты соңғысы жиі жану режимінде жүзеге асырылады.
2. 3 Оттегінің шығу тарихы
Ресми түрде оттегін ағылшын химигі Джозеф Пристли 1774 жылы 1 тамызда герметикалық жабылған ыдыста сынап оксидін ыдырату арқылы ашты (Престли күшті линзаның көмегімен күн сәулесін осы қосылысқа бағыттады) . Алайда Пристли бастапқыда жаңа қарапайым субстанцияны ашқанын түсінбеді, ол ауаның құрамдас бөліктерінің бірін оқшаулады деп есептеді (және бұл газды «дефлогистикалық ауа» деп атады) . Пристли өзінің ашқаны туралы көрнекті француз химигі Антуан Лавуазьеге хабарлады. 1775 жылы А. Лавуазье оттегінің ауаның, қышқылдардың құрамдас бөлігі және көптеген заттардың құрамында болатынын анықтады.
Осыдан бірнеше жыл бұрын (1771 жылы) швед химигі Карл Шееле оттегін алды. Ол селитраны күкірт қышқылымен күйдірді, содан кейін алынған азот оксидін ыдыратты. Шееле бұл газды «отты ауа» деп атады және 1777 жылы жарық көрген кітабында өзінің ашылуын сипаттады (дәл бұл кітап Пристли өзінің ашқан жаңалығын жариялағаннан кейінірек жарияланғандықтан, соңғысы оттегінің ашушысы болып саналады) . Шееле де өз тәжірибесін Лавуазьеге баяндады.
Оттегінің ашылуына ықпал еткен маңызды кезең француз химигі Пьер Байеннің жұмысы болды, ол сынаптың тотығуы және оның оксидінің кейінгі ыдырауы туралы еңбектерін жариялады.
Ақырында, А. Лавуазье Пристли мен Шелидің мәліметтерін пайдалана отырып, нәтижесінде пайда болған газдың табиғатын анықтады. Оның еңбегі үлкен маңызға ие болды, өйткені оның арқасында сол кезде үстемдік еткен және химияның дамуына кедергі болған флогистон теориясы жойылды. Лавуазье әртүрлі заттардың жануы бойынша тәжірибе жүргізіп, жанған элементтердің салмағы бойынша нәтижелерді жариялау арқылы флогистон теориясын жоққа шығарды. Күлдің салмағы элементтің бастапқы салмағынан асып түсті, бұл Лавуазьеге жану кезінде заттың химиялық реакциясы (тотығуы) жүреді, осыған байланысты бастапқы заттың массасы артады деп айту құқығын берді, бұл оны жоққа шығарады. флогистон теориясы.
Есімнің шығу тарихы: Оттегі сөзі (19 ғ-дың басында ол әлі де «қышқыл» деп аталды), оның орыс тілінде пайда болуы белгілі бір дәрежеде басқа неологизмдермен бірге «қышқыл» сөзін енгізген М. В. Ломоносовқа байланысты; осылайша «оттегі» сөзі, өз кезегінде, А. Лавуазье (басқа грек тілінен ὀξύς - «қышқыл» және γεννάω - «мен босанамын») ұсынған «оттегі» (фр. oxygène) терминінің
калькасы болды. , ол «генерациялайтын қышқыл» деп аударылады, бұл оның бастапқы мағынасымен байланысты - «қышқыл», ол бұрын заманауи халықаралық номенклатура бойынша оксидтер деп аталатын заттарды білдіреді.
Табиғатта болуы: Оттегі - жер бетіндегі ең көп таралған элемент, оның үлесі (әртүрлі қосылыстардың, негізінен силикаттардың құрамында) қатты жер қыртысының массасының шамамен 47% құрайды. Теңіз және тұщы суларда байланысқан оттегінің көп мөлшері бар - 85, 82% (масса бойынша) . Жер қыртысының 1500-ден астам қосылыстарының құрамында оттегі бар.
Атмосферада бос оттегінің мөлшері көлемі бойынша 20, 95% және массасы бойынша 23, 10% (шамамен 1015 т) . Алайда, 3, 5 миллиард жыл бұрын алғашқы фотосинтетикалық археялар пайда болғанға дейін ол атмосферада іс жүзінде болмаған. Атмосфера құрамының жаһандық өзгеруі (оттегі апаты) нәтижесінде палеопротерозойда (3-2, 3 млрд. жыл бұрын) көп мөлшерде бос оттегі пайда бола бастады. Алғашқы миллиард жыл ішінде оттегінің барлығы дерлік мұхиттарда еріген темірмен қабылданып, жаспилит шөгінділері пайда болды. 3-2, 7 млрд жыл бұрын ол атмосфераға шығарыла бастады және 1, 7 млрд жыл бұрын қазіргі деңгейдің 10%-ына жетті.
Мұхиттар мен атмосферада көп мөлшерде еріген және бос оттегінің болуы анаэробты организмдердің көпшілігінің жойылуына әкелді. Алайда, оттегімен жасушалық тыныс алу аэробты организмдерге анаэробты организмдерге қарағанда әлдеқайда көп АТФ өндіруге мүмкіндік берді, бұл оларды басым етеді.
540 миллион жыл бұрын кембрийдің басынан бері оттегі мөлшері көлем бойынша 15%-дан 30%-ға дейін ауытқиды. Карбон дәуірінің соңында (шамамен 300 миллион жыл бұрын) деңгейлер көлем бойынша 35% шыңына жетті, бұл осы уақыт ішінде жәндіктер мен қосмекенділердің үлкен мөлшеріне ықпал еткен болуы мүмкін. Адамның іс-әрекеті, соның ішінде жыл сайын 7 тонна қазбалы отынды жағу атмосферадағы бос оттегінің мөлшеріне өте аз әсер етеді. Фотосинтездің қазіргі жылдамдығымен атмосферадағы барлық оттегін қалпына келтіру үшін шамамен 2000 жыл қажет.
2. 4 Оттегінің қолдану аймағы
Оттегі медицинада, су астындағы және ғарыш кемелеріндегі тіршілікті қамтамасыз етуде, тыныс алу, жану және ыдырау процестерінде, өндірістік процестерде жоғары температура жасау үшін, химиялық заттар өндірісінде, әртүрлі қондырғыларда отынға тотықтырғыш ретінде кеңінен қолданылады. Оттегі 40 литрлік көк цилиндрлерде (таза салмағы 80 кг) 150-160 атм қысымда және көлемі 6-7 оттегі химиядағы химиялық элемент ретінде сақталады - формулалар, мысалдармен анықтамасы (оттегі салмағы 9-10 кг) және техникалық мақсатта сатуға шығарылады.
Оттегінің қолдану өрісі кең: Металлургияда металл сынықтарынан және шойыннан алынатын болат өндіру үшін қажет. Көптеген металлургиялық қондырғыларда отынның жақсы жануы үшін оттегімен байытылған ауа қолданылады. Авиацияда оттегі зымыран қозғалтқыштарында отынды тотықтырғыш ретінде қолданылады. Сондай-ақ ғарышқа ұшулар үшін және атмосфера жоқ жағдайларда қажет. Машина жасау саласында оттегі металдарды кесу және дәнекерлеу үшін өте маңызды. Металды балқыту үшін металл құбырлардан тұратын арнайы қыздырғыш қажет. Бұл екі құбыр бір-біріне салынған. Олардың арасындағы бос кеңістік ацетиленмен толтырылып, тұтанады. Бұл кезде оттегі ішкі түтік арқылы өтеді. Оттегі де, ацетилен де қысымды цилиндрден беріледі. Жалын пайда болады, оның температурасы 2000 градусқа жетеді. Бұл температурада кез келген метал дерлік балқиды. Целлюлоза-қағаз өнеркәсібінде оттегін пайдалану өте маңызды. Қағазды ағарту үшін, алкоголизациялау кезінде, целлюлозадан артық компоненттерді жуғанда (делигнификация) қолданылады. Химия өнеркәсібінде оттегі реагент ретінде қолданылады. Оттегінің табиғатта және адам өмірінде қолданылуы : Оттегі адам мен жануарлар өмірінде ең маңызды рөл атқарады. Біздің планетамызда фотосинтез нәтижесінде бос оттегі бар. Фотосинтез - көмірқышқыл газы мен судың көмегімен жарықта органикалық заттардың түзілу процесі. Осы процестің нәтижесінде жануарлар мен адамдардың тіршілігіне қажетті оттегі түзіледі. Жануарлар мен адамдар оттегін үнемі тұтынса, өсімдіктер оттегін тек түнде тұтынып, күндіз өндіреді.
Оттегінің медицинада қолданылуы: Оттегі медицинада да қолданылады. Оны қолдану әсіресе белгілі бір аурулар кезінде тыныс алу қиынға соғады. Өкпе туберкулезінде тыныс алу жолдарын байыту үшін қолданылады, сонымен қатар анестезия аппараттарында қолданылады. Оттегі медицинада бронх демікпесі мен асқазан-ішек жолдарының ауруларын емдеу үшін қолданылады. Осы мақсаттарда оттегі коктейльдері қолданылады. Оттегі жастықтары да үлкен маңызға ие - оттегімен толтырылған резеңкеленген контейнер. Ол медициналық оттегін жеке қолдану үшін қызмет етеді.
III Технологиялық бөлім
3. 1 Оттегі өндіру әдістері
Оттегі - адамзат ең көп қолданатын газдардың бірі, ол біздің өміріміздің барлық дерлік салаларында кеңінен қолданылады. Металлургия, химия өнеркәсібі, медицина, халық шаруашылығы, авиация - бұл осы заттың таптырмайтын салаларының қысқаша тізімі ғана.
Оттегі өндірісі екі технологияға сәйкес жүзеге асырылады: зертханалық және өндірістік. Түссіз газды алудың алғашқы әдістері химиялық реакцияларға негізделген. Оттегі катализатордың қатысуымен калий перманганатының, бертолет тұзының немесе сутегі асқын тотығының ыдырауы нәтижесінде алынады. Дегенмен, зертханалық әдістер осы бірегей химиялық элементке деген сұранысты толық қанағаттандыра алмайды.
Оттегін алудың екінші жолы - криогенді айдау немесе адсорбциялық немесе мембраналық технологияларды қолдану. Бірінші әдіс бөлу өнімдерінің жоғары тазалығын қамтамасыз етеді, бірақ ұзағырақ (екінші әдістермен салыстырғанда) іске қосу кезеңіне ие.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz