Хроматография: әдістері, теориялық негіздері және фармацевтикалық талдауда қолданылуы


ТАҚЫРЫБЫ: Хроматография. Сандық талдаудағы хроматографияның әдістері. Органикалық және бейорганикалық заттарды анықтау және бөлуде хроматографияны қолдану
МАҚСАТЫ: Хроматографиялық талдаудың түрлері және негізгі түсініктерімен, олардың фармацияда қолданылуымен танысу. Газ-сұйықтық хроматография әдісінің теориялық негіздерін меңгеру. Фармацевтикалық талдауларда қолдана білуге үйрену. Жұқа қабатты және қағаз хроматографиясымен катиондар мен аниондарды талдау және бөлу принциптерімен студенттерді таныстыру. Хроматографиялық талдау әдісі бойынша теориялық білімдерін пайдаланып, заттарды анықтау үшін пайдаланылатын жұқа қабатты хроматография әдісін меңгеру.
ДӘРІС ЖОСПАРЫ:
- Хроматография, маңызы, топтастырылуы.
- Тұндыру хроматографиясы, қолданылуы.
- Ионалмасу хроматографиясы, қолданылуы.
- Газ-сұйықтық хроматография және газ-адсорциялық хроматография
- Жұқа қабатты және қағаз хроматографиясы.
ДӘРІСТІҢ ҚЫСҚАША МАЗМҰНЫ
Хроматография құрамы күрделі қоспаларды бір-бірінен ажыратуға қолданылатын физика-химиялық әдіс. Хроматографияның негізін қалаған орыс ғалымы М. С. Цвет. Хроматография әдісі күрделі бейорганикалық және органикалық қоспалардан оның компоненттерін бір-бірінен бөлуге (иондар және өсімдік пигменттерін бөлуге), өте сұйылтылған ерітіндіден қосылыстарды концентрлеуге (мұхит, теңіз суларынан, топырақтан, тау кендерінен микроэлементтерді концентрлеуге), заттарды қоспалардан (витаминдерді, антибиотиктерді) тазартуға қолданылады. Кез келген хроматографиялық әдіс қоспадағы заттардың екі фаза аралығында әртүрлі таралуына негізделген. Бір фаза қозғалмайтын, екіншісі қозғалмалы фаза. Қозғалмалы фаза - тасығыш. Қозғалмайтын фаза арқылы қоспа компоненттері қозғалмалы фазамен әртүрлі жылдамдықпен өтіп бөлінеді. Бөліну процесі сорбция-десорбция процестеріне негізделген. Қозғалмайтын фаза - сорбент деп аталады, оның қоспа компоненттерін сорбциялау қасиеттері әртүрлі. Қозғалмайтын фазада немесе фазалардың жанасу беттерінде компоненттердің жиналуын сорбция деп атайды.
Хроматографиялық әдістерді топтастыру. Хроматография фазалар табиғатына, бөліну механизміне, орындалу тәсіліне және т. б. қасиеттеріне негізделіп топтастырылады. Қозғалмайтын фаза ретінде - қатты зат немесе қатты затқа қондырылған гель қолданылады. Қозғалмалы фаза - сұйық немесе газ болады . Қозғалмалы фазаның агрегаттық күйіне қарай хроматография сұйықтық, газды және газ-сұйықтық деп бөлінеді. Бөліну механизміне қарай адсорбциялық, ионалмасу, иондық, тұндыру, таралу, гель-фильтрациялық хроматография деп бөлінеді. Сұйық қозғалмалы фазалы хроматография орындалу тәсіліне қарай үшке бөлінеді: бағаналық хроматография - қозғалмайтын фаза бағанада болады, жұқа қабатты хроматография - қозғалмайтын фаза пластинкаға қондырылады, қағаз хроматографиясы - қозғалмайтын фаза қағаз бетіне үлдір түрінде таратылады немесе қондырылады. Бағанадан өтетін еріткіш элюент деп аталады. Элюентке қосылыстың ауысуын элюирлеу деп атайды. Осының нәтижесінде түрлі-түсті бөлек-бөлек химиялық зоналар пайда болады, оны хроматограмма деп атайды. Көп тараған және жиі пайдаланылатын хроматографияның екі түріне тоқталуға болады.
Таралу (үлестірілу) хроматографиясы.
Бұл әдіс өзара бір-бірімен араласпайтын, қозғалмайтын және қозғалмалы екі фазада компоненттердің әртүрлі таралуына негізделген. Қозғалмайтын фаза бағанаға салынған бейтарап тасушының бетіне ұсталады. Талданатын қоспа - сынама бағанаға салынып, оның компоненттері қозғалмалы фазамен - еріткішпен жылжытылады. Әр компоненттің екі сұйық арасында таралуы, олардың таралу коэфициенттеріне тәуелді.
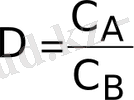 мұнда С
А
- қозғалмайтын фазадағы компоненттің концентрациясы; С
В
- қозғалатын фазадағы компоненттің концентрациясы.
мұнда С
А
- қозғалмайтын фазадағы компоненттің концентрациясы; С
В
- қозғалатын фазадағы компоненттің концентрациясы.
Қағаз хроматографиясы.
Қозғалмайтын фаза - су, ол қағаз бетіне адсорбцияланады. Қозғалмалы фаза - сумен араласпайтын органикалық еріткіш. Бөліну адсорбцияға негізделген. Бөлінетін компоненттер қағаз капиллярлары арқылы әртүрлі жылдамдықпен жылжиды. Қозғалу жылдамдығы таралу коэффициентіне тәуелді. Хроматографиялық процесте қосылыстың бір бөлігі қағаздан қозғалмалы фазаға ауысады. Органикалық қозғалмалы фаза қағаздың еріген қосылысы жоқ бөлігіне жеткенде қайта бөлу процесі жүреді - қосылыс органикалық фазадан сулы фазаға ауысады. Процестің ең сонында әр компонент қағаз бетінің әр бөлігінде, ауданында концентрленеді. Хроматограммада әр компонентке тән бөлек-бөлек зоналар пайда болады. Компонент зонасының ауысуы
бөліну коэфициентімен R
f
анықталады. R
f
- зонаның қозғалу жылдамдығының еріткіштің қозғалу жылдамдығына қатынасымен анықталады
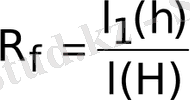 .
.
Тұндыру хроматографиясы. Тұндыру хроматография әдісі - талданатын қоспаның құрамындағы қосылыстардың ерігіштіктерінің айырмашылығына негізделген. Қосылыстарды тек бағанада ғана емес қағазда да бөлуге болады. Тұндыру хроматографиясы әдісімен қосылыстарды бөлу үшін тазартылған арнайы сүзгіш қағазын тұндырғыш реагенті бар ерітіндіге батырып сіңдіреді. Хроматографияланатын қосылыстар осы тұндырғыш реагентімен әрекеттесіп суда нашар еритін қосылыс түзеді. Орталықтан шетке қарай қосылыстардың ерігіштігіне байланысты сақиналар жүргізіледі. Неғұрлым екі қосылыстың ерігіштігінің айырымы жоғары болса, соғұрлым бөлу процесінің дәрежесі жоғары болады. Қағазда орындалатын тұндыру хроматографиясы әдісін Н. Ф. Кулаев ұсынған. Осы әдіспен катиондардың және аниондардың қоспасын бөлуге қолдануға болады.
Ионалмасу хроматографиясы.
Бұл талдау тәсілі электролиттерді бөлу үшін пайдаланылады. Тәсіл адсорбенттің (ионит) құрамына кіретін иондар мен зерттелетін сынама иондарының қайтымды алмасу процесіне негізделген. Компоненттерді бөлу олардың ионалмасу константалары шамасының әртүрлі болуына негізделген. Кез келген иониттің құрамында қышқылдық немесе негіздік қасиет көрсететін ионогенді топтар болуы тиіс. Ионит молекуласының негізгі қаңқасында (матрицасы) ковалентті байланысқан және диссоциацияланатын топтар үлестірілген. Осы топтардың диссоциациялануы нәтижесінде қозғалмалы иондар түзіледі, оларды зарядына байланысты катиониттер және аниониттер деп бөледі. Катиониттер катиондарға алмасады және аниониттер аниондарға алмасады. Катиониттер екі топқа бөлінеді: күшті және әлсіз қышқылды, біріншісінің құрамында көбінесе сульфотоптар - SO
3
H болады, екіншісінде карбоксил тобы -COOH болады. Катиониттердің химиялық формуласы RSO
3
H, RSO
3
Nа немесе RH (Н
+
- формасы), R-Nа (тұз формасы) . Аниониттерді күшті негізді (құрамына төртіншілік аммоний негіздері кіреді), әлсіз негізді (құрамына -NH
2
, =NH,
 N топтары) деп екіге бөледі. Химиялық формуласы R-NH
3
OH, RNH
3
CI немесе R-OH негіздік түрі, RCI тұз түрі. Амфотерлі иониттер (амфолиттер) бұлар катиондармен де аниондармен де алмасады. Ионалмасу схемасын келесі теңдеулер арқылы көрсетуге болады: Катион алмасу: R-SO
3
-
-H
+
+ Me
+
N топтары) деп екіге бөледі. Химиялық формуласы R-NH
3
OH, RNH
3
CI немесе R-OH негіздік түрі, RCI тұз түрі. Амфотерлі иониттер (амфолиттер) бұлар катиондармен де аниондармен де алмасады. Ионалмасу схемасын келесі теңдеулер арқылы көрсетуге болады: Катион алмасу: R-SO
3
-
-H
+
+ Me
+
 R(SO
3
)
-
Me + H
+
R(SO
3
)
-
Me + H
+
катионит ер. ионит ерітіндіде
Жалпы түрде: R-H + Me
+
 R-Me + H
+
R-Me + H
+
Анион алмасу: [R-N(CH
3
)
3
]
+
OH
-
+ An
-
 [R-N(CH
3
)
3
]
+
An
-
+ OH
-
[R-N(CH
3
)
3
]
+
An
-
+ OH
-
анионит ер. ионит ерітіндіде
Жалпы түрде: R-OH + CI
-
 R-CI + OH
-
R-CI + OH
-
Мұнда R - матрица, -SO 3 - -H + немесе -N(CH 3 ) 3 ] + OH - функционалдық топ.
Ионалмасу хромотографиясында иондарды бөлу иониттердің талғағыштығына негізделген.
Иониттерге қойылатын шарттар. 1) Иониттар қатты заттар болуы тиіс, суда және органикалық еріткіштерде ерімеуі тиіс. 2) Химиялық тұрақты болуы қажет. 3) Механикалық берік және температураға тұрақты болуы тиіс. 4) Алмасу сыйымдылығы жоғары, демек құрамында иондарға алмасатын функционалды топтарының саны өте көп болуы қажет. Иониттің алмасу сыйымдылығы 1 г құрғақ немесе 1 мл ионитпен жұтылған (алмасқан) иондардың миллимоль эквивалент санымен анықталады. Алмасу сыйымдылығы статистикалық тәсілмен (САС) немесе динамикалық тәсілмен (ДАС) анықталады. САС анықтау үшін құрамында сутегі ионы бар катиониттің нақты мөлшерін NаCI ерітіндісіне салады. Nа + иондары иониттегі Н + иондарына алмасады. Ерітіндідегі алмасу нәтижесінде түзілген Н + ионын алкалиметриялық тәсілмен анықтауға болады. Құрамында қозғалмалы металл иондары бар иониттердің түрін Nа + - форма деп атайды. ДАС анықтау үшін ішінде Nа + формалы катионит бар бағанадан элюентте сутек иондары пайда болғанша біртіндеп тұз қышқылын жібереді (бұл жағдайда Nа + иондары толық Н + иондарына алмасады) . Алмасу сыйымдылығының шамасы функционалды топтар санына тәуелді. Ионалмасудың қайтымдылығына регенерация процесі негізделген. Nа + түріне ауыстырылған катионитті тұз қышқылымен жуу арқылы қайтадан Н + күйіне келтіруге болады. Регенерация нәтижесінде иониттерді аналитикалық практикада бірнеше рет пайдалануға болады.
Иониттер, топтастырылуы, олардың қасиеті. Барлық иониттерді екі үлкен топқа бөлуге болады: органикалық және бейорганикалық. Әр топты табиғи және синтетикалық деп тағы бөледі.
Табиғи бейорганикалық иониттер. Ионалмасу хроматография тәсілінің дамуының алғашқы кезеңінде пайдаланылған. Бұл алюминий силикаттары хNа 2 O·yAl 2 O 3 ·zSiO 2 (катиониттер) және апатиттер (аниониттер) . Бірақ табиғи иониттердің үлкен бір кемшілігі бар: олар химиялық тұрақсыз және алмасу сыйымдылығы төмен.
Синтетикалық бейорганикалық иониттер. Силикагель (әртүрлі дәрежеде гидратталған SiO 2 ), пермутиттер (жасанды алюмосиликаттар), титан немесе цирконийге негізделген иониттер. Бұлардың кемшіліктері табиғи иониттерге қарағанда төмен.
Табиғи органикалық иониттер. Олар шымтезектің, қоңыр көмірдің, топырақтың, жүннің, целлюлозаның құрамына кіреді. Бұлардың кемшілігі: алмасу сыйымдылығы төмен, химиялық тұрақсыз, бірақ өңдеу нәтижесінде бұл кемшіліктерін азайтуға болады. Мысалы, көмірді термиялық және химиялық өңдеуден кейін сульфокөмір алуға болады.
Жасанды органикалық иониттер.
Ионалмасатын шайырлар. Бұл көмірсутекті тізбектен тұратын бекітілген ионогенді топтары бар кеңістікті торлы матрицалар. Оларды полимеризация немесе поликонденсация реакциялары нәтижесінде алады. Мономер ретінде көбінесе стирол, фенолдар және оның туындылары т. б. пайдаланылады. Мономерлердегі функционалды топтарды ауыстырып қажетті шайырлар даярлауға болады. Жасанды органикалық катиониттер құрамында қышқылдық топтары SO
3
-
, COO
-
бар қышқылдық қасиет көрсететін қосылыстар, мысалы R-SO
3
H, H
+
- формасы, R-SO
3
-Nа, Nа
+
-формасы. Жасанды органикалық аниониттер құрамында белсенді негіздік топтары (-NH
2
, =NH,
 N) бар негіздік қасиет көрсететін қосылыстар, R-NH
3
+
-OH, OH
-
- түрі, R-NH
3
+
-CI, CI
-
- түрі. Иониттің иондану дәрежесі оның табиғатына және ерітіндінің қасиетіне тәуелді. Мысалы, R-SO
3
H жақсы ионданады, кез келген ортада иондарға алмасады. Мұндай катиониттерді күшті қышқылды деп атайды. R-COOH қышқыл ортада иондану дәрежесі төмен, сондықтан ерітіндінің рН > 7 ортасында пайдаланылады, бұл әлсіз қышқылды катионит деп аталады. Құрамында әлсіз негіздік топтары бар аниониттер ерітіндінің рН = 7 немесе рН > 7 болған жағдайда ион алмасады. Егер аниониттің құрамына күшті негіздік топтар кіретін болса, олар кез келген ортада ионалмасу процесіне қатысады. Күшті негіздік анионит - ТУ-2, 272, AB-17, AP-18; жиі пайдаланылатын аниониттер: KУ-1, KУ-2, KУ-23, An-2ф, An-1.
N) бар негіздік қасиет көрсететін қосылыстар, R-NH
3
+
-OH, OH
-
- түрі, R-NH
3
+
-CI, CI
-
- түрі. Иониттің иондану дәрежесі оның табиғатына және ерітіндінің қасиетіне тәуелді. Мысалы, R-SO
3
H жақсы ионданады, кез келген ортада иондарға алмасады. Мұндай катиониттерді күшті қышқылды деп атайды. R-COOH қышқыл ортада иондану дәрежесі төмен, сондықтан ерітіндінің рН > 7 ортасында пайдаланылады, бұл әлсіз қышқылды катионит деп аталады. Құрамында әлсіз негіздік топтары бар аниониттер ерітіндінің рН = 7 немесе рН > 7 болған жағдайда ион алмасады. Егер аниониттің құрамына күшті негіздік топтар кіретін болса, олар кез келген ортада ионалмасу процесіне қатысады. Күшті негіздік анионит - ТУ-2, 272, AB-17, AP-18; жиі пайдаланылатын аниониттер: KУ-1, KУ-2, KУ-23, An-2ф, An-1.
Иониттердің талғағыштығы. Бөлу талғағыштығы бөлінетін иондардың ионалмасу константасына негізделген. Заряд шамасы жоғары, сольватталған күйде иондық радиусы төмен, поляризациялануы жоғары иондарға шайырлардың ұқсастығы жоғары болып келеді. Мысал ретінде ионалмасудың талғағыштық қатарын келтіруге болады. Катиондар үшін: Bа 2+ > Рb 2+ > Sr 2+ > Ca 2+ > Ni 2+ > Cd 2+ > Cu 2+ > Co 2+ > Zn 2+ > Mg 2+ ≥ Ag + > K + > NH 4 + > Na + > H + > Li + .
Аниондарда иониттердің қасиеттеріне байланысты талғағыштық қатарлары өзгеруі мүмкін. Бөлінетін иондардың талғағыштығы төмен болған жағдайда, элюенттің табиғатын өзгертіп бөлу дәрежесін арттыруға болады. Сонымен қатар, элюенттің рН-ын өзгертіп, әлсіз электролиттерді ионитпен ұстап қалуына әсер етуге болады. Себебі, рН-қа байланысты олар иондық немесе молекулалық күйде болады. Ионитпен иондарды ұстап қалуына элюенттің иондық күші де әсер етеді. Бөлу дәрежесін арттыру үшін көбіне комплекс түзу реакцияларын пайдаланады, бөлінетін иондардың біреуін немесе бірнешеуін қарама-қарсы зарядталған комплексті иондарға айналдырады. Мысалы Fe 3+ , Cu 2+ , AI 3+ - сульфосалицил қышқылымен қарама-қарсы зарядталған комплексті қосылыстар [Fe(R) 3 ] 3- , [AIR 3 ] 3- , [CuR 2 ] 2- түзеді. Мұнда R-cульфосалицил қышқылының қалдығы. Аммиак ерітіндісін қосқан кезде бірінші және екінші комплекстер өзгермей қалады, ал мыс комплексі бұзылып, мыс аммиакатын түзеді, осы ерітіндіні катионит арқылы өткізгенде оң зарядталған мыс комплексі катионит бетінде сорбцияланады. Ал сульфосалицилат комплекстері өзгермей қалады. Содан соң мыс иондарын тұз қышқылымен элюирлеуге болды.
Ионалмасу тепе-теңдігі.
Ионалмасу тепе-теңдігіне түрлі факторлар әсер етеді: иониттің қасиеті, ерітіндінің қасиеті, концентрация, температура. Ионалмасу тепе-теңдігін әрекеттесуші массалар заңымен сипаттауға болды. Жалпы түрде ионалмасу реакциясын келесі түрде көрсетуге болады: R-A + B
+
 R-B + A
+
R-B + A
+
ионит ерітінді
K
AB
=
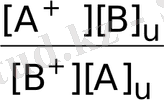 , мұнда K
AB
- ионалмасу константасы немесе талғағыштық коэффиценті; [B]
u
және [A]
u
- иондардың қатты фазадағы концентрациялары; [B
+
] және [A
+
] - иондардың сұйық фазадағы концентрациялары. Бұл шама иониттің талғағыштығын бағалауға мүмкіндік береді, неғұрлым константа шамасы жоғары болса, солғұрлым алмасу процесі толық және жоғары жылдамдықпен жүреді.
, мұнда K
AB
- ионалмасу константасы немесе талғағыштық коэффиценті; [B]
u
және [A]
u
- иондардың қатты фазадағы концентрациялары; [B
+
] және [A
+
] - иондардың сұйық фазадағы концентрациялары. Бұл шама иониттің талғағыштығын бағалауға мүмкіндік береді, неғұрлым константа шамасы жоғары болса, солғұрлым алмасу процесі толық және жоғары жылдамдықпен жүреді.
Үш түрлі жағдай болуы мүмкін: 1) K
AB
= 1 талғағыштық байқалмайды. 2) K
AB
> 1 ионалмасу процесі жақсы жүреді. 3) K
AB
< 1 ионалмасу процесі жақсы жүрмейді. Ионалмасу константасын эксперимент нәтижесінде анықтауға болады. Екі фаза арасындағы ионалмасу процесінің жылдамдығы және тепе-теңдік орнауы иониттің, хроматографияланатын қосылыстың табиғатына, эксперимент техникасына (немесе оның орындалуына) тәуелді. Ионалмасу процесінің кинетикасын зерттеу нәтижесінде сорбенттің құрылымын, оның белсенді топтарын және олардың алмасу процесіне қатысуын анықтауға болады. Ионалмасу процесін сипаттайтын маңызды шама ол үлестіру коэффициенті - К
ү
. Бұл шаманы өте жиі анықтайды және иондарды хроматографиялық тәсілмен бөлу жағдайын таңдау үшін пайдаланады. Үлестіру коэффициенті иониттегі иондар мөшерінің қатынасымен анықталады. Үлестіру коэффициентін тәжірибе нәтижесінде статистикалық немесе динамикалық тәсілдермен анықтауға болады, K
Y
=
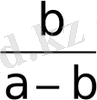 .
.
 , мұнда а - алғашқы ерітінді көлеміндегі иондардың мөлшері; b - ионитпен сорбцияланған иондардың иөлшері; V - электролит ерітіндісінің көлемі, мл; m - иониттің массасы, г. Егер бір жағдайда анықталған екі ионның үлестіру коэффициенті бірдей болса, ондай иондарды бөліп алуға болмайды. Екі ионның бір жағдайда анықталған үлестіру коэффициентінің қатынасы -
бөлу коэффициенті
деп аталады. Бұл шама иондарды хроматографиялық тәсімен бөліп алу мүмкіндігін сипаттайды, сондықтан иондарды бір-бірінен бөліп алу үшін бөлу факторы жоғары болуы тиіс, демек үлестіру коэффициентінің қатынасы жоғары.
, мұнда а - алғашқы ерітінді көлеміндегі иондардың мөлшері; b - ионитпен сорбцияланған иондардың иөлшері; V - электролит ерітіндісінің көлемі, мл; m - иониттің массасы, г. Егер бір жағдайда анықталған екі ионның үлестіру коэффициенті бірдей болса, ондай иондарды бөліп алуға болмайды. Екі ионның бір жағдайда анықталған үлестіру коэффициентінің қатынасы -
бөлу коэффициенті
деп аталады. Бұл шама иондарды хроматографиялық тәсімен бөліп алу мүмкіндігін сипаттайды, сондықтан иондарды бір-бірінен бөліп алу үшін бөлу факторы жоғары болуы тиіс, демек үлестіру коэффициентінің қатынасы жоғары.
Бөлу факторы келесі қатынаспен анықталады D
Y
=
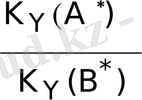 .
.
Бағаналарда орындалатын ионалмасу хроматографиясы. Хроматографиялық бағана дегеніміз ұзындығы 30 cм диаметрі 1 см шүмегі бар шыны түтікшенің төменгі жағында мақта тампоны болады, иониттің нақты мөшерін су мен шыны таяқша арқылы өлшеуірге құяды, өлшеуірді толтырғанда ионит түйіршіктері арасында ауа қалмауы тиіс. Иониттің биіктігі 8-12 см болған кезде шүмекті жауып, ионит түйіршіктерінің бетін мақта тампонымен жабады. Ионит түйіршіктері қалқып шықпау үшін тампон үстінде сұйық болуы қажет. Зерттелетін иондар толық адсорбциялануы үшін қажетті жағдай жасау қажет. 1) зерттелетін ерітінді -бастапқы немесе инфлюент, 2) ағып шығатын ерітінді - эффлюент, 3) жуу үшін арналған ертінді - элюент. Ионалмасу процесінің сатылары: сіңіру сатысы, элюирлеу сатысы. Сіңіру сатысы зерттелетін ерітіндіні хроматографиялық бағана арқылы өткізу. Ертінді белгілі жылдамдықпен өтеді. Өту уақыты аралығында зерттелетін ион ионитпен толық сіңірілуі қажет, сіңіру дәрежесі өту жылдамдығының алмасу жылдамдығына қатынасымен анықталады. Неғұрлым алмасу жылдамдығы жоғары болса, солғұрлым сіңіру дәрежесі жоғары болады. Алмасу жылдамдығына әсер ететін факторлар: 1) неғұрлым ионит түйіршіктері ұсақ, соғұрлым иониттің сіңіру жылдамдығы жоғары; 2) неғұрлым ерітінінің ағу жылдамдығы төмен, соғұрлым алмасу сыйымдылығы жоғары; 3) температура жоғарлаған сайын алмасу сыйымдылығы артады; 4) бағана жіңішке және ұзын болғаны жөн; 5) иониттер әлсіз қышқылды немесе әлсіз негізді болған жөн. Элюирлеу сатысы элюирлеуді жақсарту үшін хроматографияны келесі жағдайда орндаған жөн: 1) ионит түйіршіктері ұсақ болуы тиіс; 2) ерітіндінің бағанадан ағу жылдамдығы төмен болуы тиіс; 3) элюирлеуді қышқыл ерітінділермен орындаған дұрыс. Ионалмасу хроматографиясы катиондарды, аниондарды, кедергі келтіретін қоспаларды бөлу үшін, таза препараттар алу үшін, қоспаларды бөлуде қолданылады.
Газ-сұйықтық хроматография және газ-адсорциялық хроматография лық тәсілдерін салыстыратын болсақ, газ-адсорбциялық хроматография ертерек дамыған. Бірақ бұл тәсілдің газ-сұйықтықты хроматографиялық тәсілге қарағанда аналитикалық мүмкіндігі төмен. Осыған қарамастан газ-адсорбциялық хромотография үздіксіз дамыды, оны газдарды және қайнау температурасы төмен қосылыстарды айыру үшін кеңінен пайдаланды. Көптеген дәрі-дәрмектерді, түрлі препараттарды, көптеген қосылыстарды іс жүзінде газ-сұйықтық хроматографиялық тәсілмен бөліп талдайды.
Газ-сұйықтық хроматография
Жалпы сипаттамасы. Негізгі принциптері. Бұл тәсілді алғаш 1952 ж. Мартин және Джеймсон ұсынған. Тәсілдің негізгі принципі зерттелетін сынама газ ағынымен (тасушы) араласып бағанаға түседі. Бағананың ішінде қайнау температурасы жоғары жұқа қабатты сұйық қондырылған тасушының қатты түйіршіктері болады. Зерттелетін қоспаның компоненттері осы сұйықта еріп, қозғалмалы газды фаза (ҚГФ) мен қозғалмайтын сұйық фаза (ҚСФ) арасында үлестіріледі. Үлестірілуі олардың үлестіру коэффициентіне тәуелді. Бірінші кезеңде қозғалмалы газды фаза мен қозғалмайтын сұйық фаза арасында тепе-теңдік орналған соң, газ қозғалмайтын сұйық фазада ерімеген компонентермен бірге бағананың ішкі жағына қарай жылжиды, онда да тепе-теңдік орнайды. Сонымен қатар таза газдың жаңа порциясы (тасушы) құрамында зерттелетін қосылыстың компоненттері бар қозғалмайтын сұйық фазамен тепе-теңдік орнайды. Бір бөлігі қозғалмалы газ фазасына ауысады. Бұл процестер, демек бір фазадан екінші фазаға ауысуы, мысалы қозғалмалы газ фазасынан қозғалмайтын сұйық фазаға немесе керісінше, зерттелетін қосылыстың молекулалары бағанадан толық өткенше байқалады. ҚСФ-да нашар еритін компонент бағанадан жылдам өтеді, себебі, оның стационарлық фазада болу уақыты төмен. Екі компоненттің үлестірілу коэффициентін - К 1 және К 2 деп белгілесе, онда осы екі шаманың қатынасы неғұрлым жоғары болса, соғұрлым үлестіру дәрежесі жоғары болады. К 1 /К 2 = 1 болған жағдайда жүйе бөлінбейді. Хроматографиялық бағанада бөлінгендер детекторға келеді, ал ол концентрацияны электр сигналға айналдырады.
Газды хроматографтың құрылысы. 1-баллоннан тасушы газды даярлайтын жүйеге (2) барады. Бұл жерде сүзгіштер арқылы газ механикалық және химиялық қоспалардан тазартылады. Даярлау жүйесі (2) сонымен қатар газдың жұмсалуын өлшеуге мүмкіндік береді. Содан соң газ анализаторға (3) барады. Анализатор буландырғыштардан тұрады, мұнда сынаманы буға айналдырылады, оның құрамына хроматографиялық бағана және детектор кіреді. Барлық процесті басқару жүйесі (4) арқылы бақылайды. Электр сигналы тұрақты тоқты күшейткіш арқылы тіркегішке барады (көбіне электронды потенциометр) .
1 2 3 4 6
Газды хроматографтың құрлысы
1- газы бар баллон; 2 - газды даярлау жүйесі; 3 - анализатор: а) буландырғыш; б) бағана; в) детектор; 4 - басқару блогы; 5 - тұрақты тоқтың күшейткіші; 6 - тіркегіш.
Тасушы газ. Тасушы газ ретінде гелий, азот, сирек аргон, көміртек (IV) оксиді т. б. қолданылады.
Сынаманы енгізу. Газ қоспасын дозалаушы шүмек көмегімен қосады. Сұйық сынамаларды микрошприцпен 0, 1 мкл-ден 50 мкл-де дейін дозалайды. Қатты үлгілерді органикалық еріткіштерде ерітеді немесе жеңіл балқитын амидтерге айналдырады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz