Ерітінділердің қасиеттері, құрамы, концентрациясы және түрлері


Жоспар
Кіріспе
Негізгі бөлім
1Ерітінділер қасиеті мен құрамы
2 Ерітінділер концентрациясы
3 Ерітінді түрлері
Қорытынды
Пайдаланылған әдебиеттер
Кіріспе
Ерітінділер-кем дегенде екі құрамдас бөліктерден тұратын құрамы өзгермелі гомогенді, біртекті жүйелер. Ерітінділер газ тәрізді, сұйық және қатты болуы мүмкін. Олардың ішінде жан-жақты зерттелгені және жиі қолданылатыны сұйық, әсіресе, сулы ерітінділер. Сондықтан тұрмыста ерітінділер деп, көбінесе, сұйық күйдегі молекула-дисперстік жүйелерді айтады. Ерітінділердің құрамы құрамдас бөліктердің конценрацияларымен сипатталады. Ерітінділер қаныққан, қанықпаған және аса қаныққан деп бөлінеді. Берілген температурада жақсы еритін заттардың ерігіштігінің де шегі бар. Еріген заттың концентрациясы белгілі бір мөлшерден асқанда, оның артығы ерімей, ерітіндінің түбіне шөгеді. Бұл кезде ерітінді мен еріген зат тепе-теңдік жағдайда болады. Мұндай ерітінділерді қаныққан ерітінділер, ал концентрациялары қаныққан ерітіндінің концентрациясына дейінгі барлық ерітінділерді қанықпаған ерітінділер деп атайды. Кейбір еріткіштің белгілі бір мөлшерінде еритін заттың ерігіштігіне сәйкес мөлшерінен де артық мөлшерін ерітуге болады. Мұндай ерітінділер аса қаныққан ерітінділер деп аталады. Аса қаныққан ерітінділердің тұрақтылығы нашар болады. Кез келген сыртқы әсерден еріген заттың артық мөлшері ерітіндіден бөлініп, тұнбаға түседі. Сөйтіп аса қаныққан ерітінді жай қаныққан ерітіндіге айналады. Кей заттар ерігенде олардың молекулалары иондарға ыдырайды, яғни диссоциацияланады. Электр тогын өткізетін болғандықтан, ондай заттардың ерітінділерін электролит ерітінділері деп атайды. Оған көптеген қышқылдар мен негіздердің, әсіресе, тұздардың ерітінділері жатады. Керісінше, ерігенде молекулалары иондарға ыдырамайтын, сондықтан электр тогын өткізбейтін заттардың ерітінділері бейэлектролиттердің ерітінділері деп аталады.
Негізгі бөлім.
1. Ерітінділердің қасиеті мен құрамы
Ерітінді деп екі немесе бірнеше компоненттен тұратын гомогенді системаларды айтады. Әдетте ерітінділердің тығыздығы, қайнау және қату температурасы, тұтқырлығы сияқты касиеттері өзгеріп отырады. Ерітінділерді жай механикалық қоспа деп те, химиялық қосылыс деп те қарастыруға болады.
Ерітіндінің механикалық қоспадан басты айырмашылығы ондағы әрбір микроскопиялық өте кіші, ұсақ бөлшектерді химиялық құрамы мен физикалық қасиеттерінің көлемде бірдей болуында. Ал химиялық қосылыстардан негізгі өзгешелігі оның құрамында еритін зат көп еріткіштің мөлшеріне тәуелділігінде және еселік қатынас заңына бағынбауында. Мысалы, ас тұзы суда тек белгілі мөлшерде ғана ериді. Айталық, 20°С, 293Қ-та алынған 100 мл суда ас тұзының 36, 8 грамы ғана ериді де, одан әрі оның мөлшерін қанша көбейтсек те ол ерімейді. Бұл қалыпты жағдайда кездесетін құбылыс. Ерітіндінің химиялық қосылыстан тағы бір өзгешелігі-химиялық байланыс табиғатында. Егер химиялық қосылыстар негізінен ионды, ковалентті байланыстармен сипатталса, ерітіндідегі байланыс, газдарда кездесетін аса әлсіз ван-дер-ваальстік, ал кейбір жағдайларда қосымша сутектік байланыстармен түсіндіріледі
Жай қоспалардағы заттар өзара ешбір байланыссыз-ақ араласса, ерітіндідегі еріткіш пен еритін заттар арасында әлсіз болса да химиялық байланыс болады. Мысалы, бірдей өлшемдегі құм мен ағаш немесе темір үгіндісін араластырса, қоспа пайда болады және оларды бір-бірінен бөлуге болады. Ал, ас тұзын немесе қантты су да ерітсе, олар оңайлықпен әуелгі жеке заттарға бөлінбейді.
Еріткіші су болатын ерітінділер табиғатта кең тараған. Жер қыртысындағы, өсшдіктер мен тірі организмдердегі процестер су-сыз жрмейді. Осыдан ерітінді дегешміз жай ғана құбылыс емес, ол өте күрделі физикалық және химиялық касиеттері бар күрделі құбылыс екенін көреміз.
Еру процестері кейде жылу бөліну арқылы жүрсе, енді бірде жылу сіңіру арқылы да жүреді, яғни зат қыздырғанда ғана ериді.
Сондай-ақ кей заттарды еріткенде ерітіндінің көлемі кемуі немесе артуы мүмкін. Мысалы, күкірт қышқылын не натрий гидроксидін суда еріткенде едәуір жылу бөлінеді. Бұл еріген зат пен еріткіш арасында химиялық реакцияның жүргендігін көрсетеді. Бұл процесті сольватация, ал пайда болған қосылысты сольват дейді. Зат суда еритін болса, процесс, гидратация, қосылыс гидрат делінеді.
2. Ерітінділердің концентрациясы.
Ерітіндінің концентрациясы дейтініміз-ерітіндінің белгілі бір салмақ мөлшерінде, не белгілі бір көлемінде еріген заттың мөлшері. Ерітінділердің концентрациясын, яғни ерітінділердің құрамын кескіндеудің бірнеше әдісі бар:
1 Массалық процент пен өлшенетін проценттік ерітінділер, яғни ерітіндінің 100 масса бөлігінде еріген заттың массасы. Мысалы, қанттың 12 проценттік ерітіндісі десек, ол ерітіндінің 100 грамында 12г қант, 88г су бар. Еріген заттың массалық үлесі ω=омега-ол еріген зат массасының ерітіндінің жалпы массасына қатынасын көрсететін өлшемсіз шама. Өлшем бірлігі үлес, %.

Еріген заттың массалық үлесін ерітіндінің пайыздық проценттік концентрациясы деп атайды.
2 Мольдікпен өлшенетін мольдік ерітінділер. Ерітіндінің метрінде бір моль зат еріген ерітіндіні мольдік ерітінді дейді, сондықтан ерітіндінің бір литрінде мольдің қаншасы ерігендігін көрсететін сан сол ерітіндінің мольдік концентрациясын көрсетеді: оны М әрпімен белгілейді.
С м немесе еріген зат мөлшерінің 1л ерітіндіге қатынасын көрсетеді. Өлшем бірлігі моль/л;
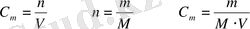
1М - бір молярлық ерітінді 1л - де еріген заттардың 1мольі болады.
0, 5М - жарты молярлық ерітінді.
0, 1М - децимолярлылық ерітінді.
0, 01М - сантимолярлық ерітінді.
0, 001М - миллимолярлық ерітінді.
Мысалы, 3М делінсе, 1л ерітіндіде 3моль, ал 0, 2М делінсе 0, 2моль зат ерігені. Мольдік концентрациялары бірдей ерітінділер эквимольді, эквимолярлық немесе эквимолекулалық деп атайды.
3. Нормальдықпен өлшенетін нормальдық ерітінділер. Ерітіндінің 1 литріндебір моль-эквивалент зат ерісе ерітіндіні нормаль ерітінді дейді; сондықтан ерітіндінің бір литрінде моль-эквиваленттің, заттың эквивалентіне тең етіп алынған грамм саны қаншасы ерігенін көрсететін сан, сол ерітіндінің нормальдық концентрациясын көрсетеді. Оны С н немесе Н әрпімен белгілейді. Өлшем бірлігі моль/л:

Мысалы, ерітіндінің 1 литрінде 3моль эквивалент ерітілсе, оны 3 нормальдық 3н, ал 0, 5моль эквивалент ерітілсе, оны жарты нормальдық 0, 5н ерітінді дейді.
4. Титр-еріген зат массасының ерітінді көлеміне қатынасын көрсетеді. Өлшем бірлігі г/мл:

мұндағы: m - еріген заттың массасы (г)
V - ерітінді көлемі (мл) ;
Э - эквиваленттің молярлық массасы;
С н - эквиваленттік концентрациясы.
Титрі белгілі ерітіндіні, титрленген ерітіндіні дайындай үшін, қажетті көлемге есептелінген заттың дәл өлшендісін алып, дистилденген суда толық ерітіп, оны керекті көлемге жеткізеді.
5. Моляльдықпен өлшенетін ерітінділер.
Еріткіштің 1000 грамында еріген заттың бір молі болса, ондай ерітіндіні моляльдық ерітінді деп атайды. Еріткіште еріген заттың мөлшеріне сай ерітінді 0, 1 0, 05 2, 0 т. б. моляльды бола алады. Мәселен, қанттың С 12 Н 22 О 11 судағы децимоляльды ерітіндісі 34, 2г қанттан және 1000г немесе 1 литр судан тұрады.
3- Ерітінді түрлері
Ерітінді - бір заттың екінші бір заттық ортада біркелкі таралуы аркылы әзірленген гомогенді жүйе; кем дегенде екі компоненттерден, бірі еріткіш екіншісі еритін зат болатын айнымалы құрамның химиялық тепе теңдік күйі болатын жүйе. Ерітінділер газ тәрізді сұйық және қатты болуы мүмкін (сондай-ақ полимерлердің ерітінділері ерітінділердің үлкен тобын құрайды) . Олардың ішінде жан-жақты зерттелгені және жиі қолданылатыны сұйық, әсіресе, сулы ерітінділер. Сондықтан тұрмыста ерітінділер деп, көбінесе, сұйық күйдегі молекула -дисперстік жүйелерді айтады.
Ерітінділер концентрация түрлері
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz