Хром тотығымен мыс электролитінен сүрмені тұндыру және тазарту технологиясы


Қазақстан Республикасы Білім және ғылым министрлігі
Академик Е. А. Бөкетов атындағы
Қарағанды мемлекеттік университеті
Аленхан М. Ж.
Мыс электролитін хром тотығымен тазалау
ДИПЛОМДЫҚ ЖҰМЫС
5В072000 - «Бейорганикалық заттардың химиялық технологиясы» мамандығы
Қарағанды 2017
Қазақстан Республикасы Білім және ғылым министрлігі
Академик Е. А. Бөкетов атындағы
Қарағанды мемлекеттік университеті
«Қорғауға жіберілді»
Химиялық технология және
мұнайхимия кафедрасының меңгерушісі
х. ғ. д., профессор М. И. Байкенов
ДИПЛОМДЫҚ ЖҰМЫС
Тақырыбы:«Мыс электролитін хром тотығымен тазалау»
5В072000 - «Бейорганикалық заттардың химиялық технологиясы» мамандығы
Орындаған: М. Ж. Аленхан
Ғылыми жетекшісі:
х. ғ. к., доцент Н. Ж. Рахимжанова
Қарағанды 2017
Қысқартылған сөздер
- акционерлік қоғам
- тәжірибені ықтималды-детерменді жоспарлау;
- инфрақызыл
- рентген фазалық анализ
- сызықтық емес көптік корреляция коэффициенті;
- сызықтық емес көптік корреляция коэффициентінің маңыздылғы;
- тұндырғышты мөлшерлеу еселігі;
- сызықтық емес көптік корреляция коэффициенті;
- сынап бағана миллиметрі
Мазмұны
Кіріспе
Дипломдық жұмыc тақырыбының маңыздылығына негіздеме. Қазіргі таңда ауыр металдар металлургия облысы бойынша Қазақстан әлемдегі ең ірі мемлекеттің бірі болып табылады. Мыс шығару бойынша мемлекетіміз ғаламшардағы мемлекеттердің бірінші ондығына кіреді. Қазақстанның нақты мыс қоры 37 млн. т (әлемдік қорда 5, 5 % -дан) деп есептеледі.
Мыс - өте бағалы және ең көп таралған түсті металлдардың бірі. Мыстың өте маңызды және кеңінен таралған қасиеті - жоғары жылу өткізгіштігі мен электр кедергісінің аз болуы.
Дамып келе жатқан халықтық шаруашылықта, бірінші ретте, электротехникалық өнеркәсіпте, көлік жасауда тазалығы жоғары тазартылған мыс пен басқа металлдың көптеген мөлшері қажет. Сондықтан, мұндай маңызды түсті металлургия саласындағы технологиялық деңгейдің өсуі мен жаңа инновациялық процесстерді үйрену, біздің республикамыз үшін маңызды стратегия болып табылады. Қазіргі таңда электрлі тазартылған мыстың тәжірибиесіне, пайдаланылған құрал-жабдық пен электролиз процессінің технологиясына қатысты көптеген жетілдірулер енгізілді. Әрі қарай өнімділіктің өсуі катодты мыстың сапасын төмендете алатын, электроэнергияның шығынын көбейтетін және анодтың пассивтелуін шақыра алатын, зиянды қоспалардан электролитті тазартумен тығыз байланысты.
Мысты электрорафинирлеу үрдісінің интенсификациясы шикізат сапасының төмендеуі мен тауарлы өнімнің талаптарының артуына байланысты мыс электролитінен сүрме сияқты зиянды қоспалардан тазалау технологиясын жаңдандыруды қажет етеді.
Мыс электролизі үрдісі кезінде электролитте сүрменің жинақталуы катодты тұнбаның ластануы мен өңдіруге шығарылатын электролит көлемінің арттыру қажеттілігіне әкеп соқтырады. Сондықтан түсті металлургия саласында сапалы өнім алу мақсатында мысты электрорафинирлеу ерітіндісінен сүрмені бөліп алу мәселесі өте өзекті болып табылады. Мысты электролитті рафинирлеу кезінде электрод потенциалдарының жақын болуына байланысты сүрме зиянды қоспа болып есептелінеді. Берілген зиянды қоспаларды бөліп алудың тиімді әдісіне олардың арсенат сияқты аз еритін қосылыстары түрінде бөліп алу жатады.
Тоқтың тығыздығының өсуі, коунрадтық кеннің сапасының төмендеуі мен әкелінген анодтық мыстың кірісінде мышьяк, сүрме және т. б. қоспалардың көп болуы электролитте осы қоспалардың біраз жинақталуына алып келеді. Бұл жағдай үрдістің техникалық-экономикалық көрсеткіштерін төмендетіп және шығарылатын заттың сапасын нашарлатады.
Біздің мемлекетіміздің экономикалық даму бағдарламасына байланысты, түсті металлургия өнеркәсіптерінің қалдықтарын пайдалану мен оларды әрі қарай қолдану - негізгі бағыттардың бірі болып табылады. Әдетте, мыс өнеркәсібінде сүрмені технологиялық циклден аз уытты және тұрақты байланыс түрінде шығару қиын. Қайта өңдеу кезінде шикізатты қолдану кешені жоғары болуын талап ететін құрамында сүрмесі бар заттар, өндірістегі әртүрлі өнеркәсіптердің арасында да айналып жүреді, жеке зауыттардың ішіндегі негізгі бөлісулердің арасында да жүреді. Бұл технологияның бұзылуы мен құнды материалдардың жоғалуына, қоршаған ортаның ластануына әкеп соғады. Сақтау немесе көмудің керекті шарттарының бірі - олардың қоршаған ортаға әсер етуі (оттек, әр түрлі суды тотықтандыратын және тотықсыздандыратын), себебі сүрмесі бар қатты заттар кеңінен тарала алмайды және қалдық қоймасына немесе үйіндіге қарай бағытталады.
Cүрме секілді қосылыстар, пайдаға жарайтын қымбат тұратын компоненттердің қатарына жатпайды, сондықтан, металлургия кәсібінің қалдықтарына, өнеркәсіптік аймақтардың табиғи қоршаған ортасына кіреді. Сонымен қатар, мышьяк, сүрмесі бар шикізаттардан тұратын металдардың өндірісінің экологиялық қорлардың қырларын қарастыруда маңызды болып, элементтің микроқоспасының жүрісін зерттеу ғана емес, сондай-ақ сыртқы ортада осы элементтердің келесі жүрісі мен шикізаттың деарсинациясының салдарын зерделеу.
Шешілетін ғылыми мәселенің қазіргі жағдайын бағалау. Cүрменің металлургиядағы жағдайы мен олардың кәсіптік аймақтардағы экологиялық мәселеге әсер етуін, қазіргі таңда оның металлға, шлаққа, газға өтетін көлемі анықталады. Осы сәттен кейін осы қоспалардың техносаладағы жолы басталады. Бірақ бұл жайлы дерек өте аз. Әдетте, мыс концентраттарында сүрменің құрамы бірнеше жүздеген пайызды, тек кейбір кезде ондық бөлшектерді құрайды. Онықайта өңдеу кезінде сүрмені, қалпына келтіретін көмір мен содасы бар балқыту арқылы шығарады. Мысты-сүрме концентраты бар осы салыстырмалы элементтерді гидрометаллургиялық әдіспен қайта өңдейді.
Ғылыми жаңалығы мен тәжірибелік маңызы. Мыс электролитіносы зиянды қоспалардан тазарту технологиясын жасап шығару өте өзекті зерттеу болып табылады. Осы дипломдық жұмыс - мыс электролитінен хром қосылысының көмегімен зянды қлспадан, оның ішінде сүрмеден тазарту мүмкіндігін тексеруге арналған, яғни алғаш рет кеңінен таралған минерал және көптеген жағдайда өнеркәсіптің қалдығы болатын мыс электролиттерінен сүрмені хром тотығы арқылы шығару зерттелді.
Дипломдық жұмыcтың зерттеудегі мақcаты хром тотығымен мыс электролитінен сүрменің тұну үрдісін зерттеу болып табылады.
Дипломдық жұмыcтың міндеттері:
- әдеби деректерге шолу жасау: сүрменің физика-химиялық қасиеті, олардың электрохимиялық үрдістегі жағдайы.
- тазартылған мыс электролитінен тәжірибенің ықтималды- детерминделген жоспарлауын пайдалана отырып Sb тұндыруын зерттеу.
- Sb хром тотығымен тұндыруының тиімді шарттарын анықтау.
Дипломдық жұмыcтың зерттеу ныcаны: Балқаш қаласындағы «Қазақмыс» АҚ мыс электролиті.
Тәжірибеден алынған зерттеулердің нәтижесі түстіметалдарды өңдеу өндірістерінде қолданылуы мүмкін.
Дипломдық жұмыcта жазудың теориялық және әдіcнамалық негізі. Әдеби шолу мен әдеби деректердің анализі монографиялардың, мерзімді ғылыми баспалардың негізінде өткізілген. Сүменің сандық анализі белгілі және құрастырылған фотоколориметрлік әдістің негізінде жасалған.
Тәжірибелік базасы. Зертханалық зерттеулер Е. А. Бөкетов атындағы ҚарМУ базасында, химия факультетінің химиялық технология және мұнайхимия кафедрасы, түсті металлдар технологиясының зертханасында жүргізілді.
- Мыстың, сүрменің және хромның физика-химиялық қасиеттері және олардың электрохимиялық үдерістегі іс-әрекеті
1. 1 Мыстың физика-химиялық қасиеттері
Жер қыртысындағы массасы бойынша мыстың мөлшері 4, 7 10 -3 % құрайды. Табиғатта тұрақты екі изотобы бар: 63 Cu және 65 Cu. Бірнеше радиоактивті изотоптары да кездеседі. Ең көп сақталынатын изотобы 64 Cu, оның жартылай ыдырау периоды 12, 7 сағ. Мыстың әртүрлі құймалары белгілі: мырыш пен жез, қола мен қалайы, мельхиор мен никель, бабит пен қорғасын және тағы басқа. Негізгі минералдары: халькопирит, халькозин, ковеллин, малахит, азурит.
Мыстың негізгі физика-химиялық қасиеттері кесте 1-де берілген [1] .
1 кесте
Мыстың физика-химиялық қасиеттері
Cu 2+ + 2e - → Cu, E = -0, 14 (құмырсқа қышқылы, 25°C)
Cu 2+ + e - → Cu + , E = 0, 153 (су, 25°C)
Cu 2+ + 2e - → Cu, E = 0, 21 (этанол, 25°C)
Cu 2+ + 2e - → Cu, E = 0, 338 (су, 25°C)
Cu 2+ + 2e - → Cu, E = 0, 43 (сұйық аммиак, 25°C)
Cu 2+ + 2e - → Cu, E = 0, 49 (метанол, 25°C)
1 кестенің жалғасы
Техникалық мыс қызғылт-сары түсті, жұмсақ металл. Ауада жылдам тотығып, ашық қызыл-сары рең береді. Мыс жұқа түрінде көгілдір-жасыл түске ие. Мыс куб тәріздес көпбұрышты торшадан құралған: = 0, 36150 нм, 8, 96 г/см 3 (20 ) құрайды. Мыс өте жоғары жылу және электр өткізгіштігімен (электрөткізгіштігі бойынша күмістен кейін 2 орында, 200°C температурада өткізгіштігі 55, 5-58МСм/м) белгілі (кесте 2) [2] .
2 кесте
Мыс ионының радиустары(нм)
Мыстың меншікті жылусыйымдылығы 25°C температурада 0, 0918кал/г тең, қатты мыстың атомдық жылусыйымдылығы 0÷1083°C аралығындағы барлық температураларда келесі теңдеумен анықталады:
=5, 44+1, 462 10 -3 T (1)
Мыстың атомдық балқу жылуы 1083°C температурада 3110кал/г тең және меншікті балқу жылуы 48, 9 кал/г тең. 1000÷1083°C температураларда мыстың булану жылуы әр түрлі деректерге сүйенеді: 75000 бастап 12кал/г ат дейін (немесе 1180 бастап 1882 кал/г дейін) . Булану жылуының температурға тәуелділігін анықтау үшін келесі формуланы қолданады:
=88500-2, 78 T (2)
Мыстың әр түрлі температураларда жылуұстағыштығы кесте 3-те келтірілген. 600°К температураға дейін нәтижелердің есептеу формуласы:
(3)
3 кесте
Мыстың атомдық жылусыйымдылғы және жылуұстағыштығы, кал/г-ат
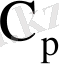
20°C температурада мыстың жылуөткізгішітгі 0, 910 кал/см∙сек∙град құрайды. Мыстың жылуөткізгіштігінің температураға тәуелділігінің өзгеруі кесте 4-те келтірілген.
4 кесте
Мыстың әр түрлі температуралдардағы жылуөткізгіштігі
Мыстың меншікті магниттік сезімталдылығы 0, 085∙10
-6
тең. Сонымен қатар еківалентті мыстың
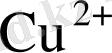 электрохимиялық эквиваленті 1, 186 г/А
сағ тең
.
электрохимиялық эквиваленті 1, 186 г/А
сағ тең
.
Таза мыстың 20°C температурада серпімділік модулі 9900 кг/мм
2
тең, және бұл шама механикалық өңдеу және күйдіру кезінде 12700÷13500 кг/мм
2
дейін өседі. Электролиттік мыстың 20°C температурада сығылғыштығы 0, 73
10
-6
кг/см2 тең. Созылған таза мыстың серпімділігінің шегі
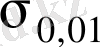 = 21, 8 и
= 21, 8 и
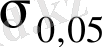 = 31, 7кг/мм
2
болады. Бұл шама мысты балқыту және өңдеу әдістерінде едәуір өзгерістерге ұшырайды [3] .
= 31, 7кг/мм
2
болады. Бұл шама мысты балқыту және өңдеу әдістерінде едәуір өзгерістерге ұшырайды [3] .
Ауада ылғалсыз және диоксид көмірсутегі болмаған жерде өзгермейді. Су қосылған тұзқышқылымен әрекеттеспейді. Оттегі қоспасының нәтижесінде ерітіндіге айналады. Мыс концентрленген күкірт және азот қышқылымен, патша арағымен, оттегімен, галогендермен, халькогендермен, металл емес оксидтерімен тотығады. Қыздыру нәтижесінде галогенсутектермен әрекеттеседі.
Мыс ылғалды ауада негізгі мыс карбонатын(II) құрап, тотығады:
{\displaystyle ~\mathrm {2Cu+H_{2}O+CO_{2}+O_{2}\longrightarrow \ Cu_{2}CO_{3}(OH) _{2}\downarrow } }2Cu+O 2 +СО 2 +Н 2 О=Cu(ОН) 2 CuСО 3
Мыс концентрленген суық күкірт қышқылымен әрекеттеседі:
{\displaystyle ~\mathrm {Cu+H_{2}SO_{4}\longrightarrow \ CuO+SO_{2}\uparrow \ +H_{2}O} } Cu + H 2 SO 4 → CuSO 4 + SO 2 + H 2 O
Мыс концентрленген ыстық күкірт қышқылымен әрекеттеседі:
{\displaystyle ~\mathrm {Cu+2H_{2}SO_{4}\longrightarrow \ CuSO_{4}+SO_{2}\uparrow \ +2H_{2}O} } Cu + 2H 2 SO 4 → CuSO 4 + SO 2 + 2H 2 O
Мыс 200°C темперaтурада сусыз күкірт қышқылымeн әрекеттеседі:
{\displaystyle ~\mathrm {2Cu+2H_{2}SO_{4}\ {\xrightarrow {200^{o}C}}\ Cu_{2}SO_{4}\downarrow +SO_{2}\uparrow \ +2H_{2}O} }2Cu + 2H 2 SO 4 → Cu 2 SO 4 + SO 2 + 2H 2 O
Мыс, күкірт қышқылын және оттегін ауада қыздырған кезде мыс сульфаты мен су бөлініп шығады:
2Cu + 2H 2 SO 4 + O 2 → 2CuSO 4 + 2H 2 O
{\displaystyle ~\mathrm {2Cu+2H_{2}SO_{4}+O_{2}{\xrightarrow {t^{\circ }}}\ 2CuSO_{4}+2H_{2}O} }
Сонымен қатар, мыс 200°C температурада оттегі жетіспеген жағдайда мыс (I) оксидіне дейін тотығады, ал 400-500°C температура оттегінің жеткілікті жағдайында мыс (II) оксидіне дейін тотығады:
4Cu + O 2 → 2Cu 2 O
2Cu + O 2 → 2CuO
Мыстың (І) көптеген қоспалары ақ немесе түссіз түрде кездеседі. Бұл мыс ионындағы (І) барлық бес 3d орбиталінің электрон буымен толыққанымен байланысты. Бірақ та Cu 2 O оксиді қызыл-қоңыр түске ие.
Екінші дәрежелі тотығу мыстың (ІІ) ең тұрақты тотығатын дәрежесі. Мыс қышқылдары (ІІ) мыстың қышқыл ерітінділерінде еруі нәтижесінде пайда болады. Бұл дәрежеде тотыққан тұздар көк немесе жасыл түске ие. Мыс қоспалары (ІІ) әлсіз тотығу қасиеттеріне ие, сондықтан оны анализдерде қолданады (мысалы, Фелинг реактивін қолдану) .
ІІІ және ІV мыс қоспаларының тотығу дәрежелері өте тұрақсыз және тек қана оттегімен, фтормен және комплекс қоспалар түрінде белгілі [4] .
1. 2 Хромның физика-химиялық қасиеттері
Хром табиғатта ең кеңінен таралған элементтердің бірі болып табылады. Жер қыртысында таралуы бойынша 21-ші орынды алады. Хромның жер қыртысындағы орта мөлшері 0, 0083 % құрайды. Хром жаратылыста хромды теміртас ҒеОСr2О3, Ғе(СrО2) 2, крокоит РbCrO4 түрінде кездеседі.
Cr(III) және Cr(VI) қосылыстары көбірек тұрақты болып келеді. Cr(VI) қосылыстары айтарлықтай күшті тотықтандырғыш, ал Cr(ІІ) қосылыстары күшті тотықсыздандырғыштар.
Техникалық хром - күмістей ақ түсті, жылтыр, қатты, бірақ морт сынғыш, ешбір пластикалық (иілгіш, созылғыш, жайылғыш) қасиеті жоқ металл. Хромның тазалығы оның физикалық химиялық қасиеттеріне айтарлықтай әсерін тигізеді. Таза металл ауыр және төзімді болады. Құрамында Al, Cu, Ni, Fe, Co, Si, W, Mn ( 1% дейін) қоспалардың болуы хромның сынғыштығын бірден жоғарлатады; ал сутегі, оттегі, азот қоспалары өте әлсіз әсер етеді.
Хромның физикалық қасиеттері кесте 5-те келтірілген [5] .
5 кесте
Хромның негізгі физикалық қасиеттері
коваленттік
металлдық
5 кестенің жалғасы
І 1 =6, 764
І 2 =16, 49
І 3 =31
ренгенттік
пикнометрлік
газтектес Cr
металдық Cr
Жасырын булану жылуы қайнау температурасында 76635 кал/моль құрайды. Температуралық тәуелділігі келесі теңдеумен көрсетіледі:
H=89450 - 4, 66T (T, K) (4)
Жасырын айдау жылуы 298K болғанда 89368 кал/моль құрайды, ал оның температуралық тәуелділігі мына теңдеумен анықталады:
H=89450 + 0, 20T -1, 48 10 -3 T 2 (T, K) (5)
Хромның бу қысымының температурадан тәуелділігі келесідей:
Сызықтық таралу коэффициенті 600 - 700°C аралығындағы температурадан тәуелділігі келесі теңдеумен анықталынады [6] :
t = 5, 88 10 -6 +1, 548 10 -8 t - 1, 163 10 -11 t 2 (t, °C) (6)
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz