Перманганатометрия, иодометрия және бихроматометрия: әдістері, қолданылуы және тотығу-тотықсыздану потенциалдары


Академик Е. А. Бөкетов атындағы Қарағанды университеті
РефератТақырыбы:Перманганатометрия. Иодометрия. Бихроматометрия
Орындаған:Курбанбаева Д. М
Тобы:ТФП216
Тексерген:Амангелді А. А
Қарағанды қаласы 2023ж
Жоспар
1. Кіріспе. . ………3
2. Перманганатометрия, Иодометрия, Бихроматометрия әдістеріне сипаттама4
3. Бұл әдістердің практикада қолданылуы . . . 7
4. Тотығу-тотықсыздану потенциалдары деген не, олар қалай анықталады және нені сипаттайды. 8
5. Қорытынды. . …. . 10
6. Пайдаланылған әдебиеттер. 12
1. Кіріспе
ТОТЫҒУ-ТОТЫҚСЫЗДАНУ РЕАКЦИЯЛАРЫ
Заттардың құрамындағы атомдардың тотығу дәрежелері өзгере жүретін реакциялар тотығу-тотықсыздану реакциялары (ТТР) деп аталады. Мұндай реакциялар, міндетті түрде, тотығу мен тотықсыздану процестерінен құралады және тотықтырғыш пен тотықсыздандырғыштың қатысуымен орындалады.
Тотығу-тотықсыздану реакциялары туралы алғашқы түсініктерді орыс ғалымы Л. В. Писаржевский (1914ж) енгізген.
Реакция барысында электрондарын беретін атомдар, иондар және молекулалар тотықсыздандырғыш, ал электрондарды қосып алатын бөлшектер тотықтырғыш болып есептеледі. Реакция барысында электрондардың берілуі тотығуға, ал электрондардың қосып алынуы тотықсыздануға жатады. Сол себепті тотығу-тотықсыздану реакцияларының нәтижесінде тотықсыздандырғыш электрондарын беріп, тотығады, ал тотықтырғыш электрондарды қосып алып, тотықсызданады.
Тотықсыздандырғыш Тотықтырғыш
тотығады. - nе ↔︎ тотықсызданады.
Электрондардың тотықсыздандырғыштан тотықтырғышқа тасымалдануы барысында белгілі бір атомның, молекуланың немесе ионның тотығу дәрежесі өзгереді және тотығатын заттың тотығу дәрежесі жоғарылайды, ал тотықсызданатын заттікі - төмендейді.
Тотығу-тотықсыздану реакциялары үшке бөлінеді: молекулааралық, молекулаішілік, диспропорция.
Тотығу-тотықсыздану реакцияларын құрастыру және
теңестіру
Тотығу-тотықсыздану реакцияларын теңестңрудің екі тәсілі бар, электронды баланс жене ионды-электронды тәсілдері. Екі тәсілдің де негізі бірдей: ол - тотығу-тотықсыздану процесінде тотықсыздандырғыш берген электрон-дардың саны тотықтырғыш қосып алған электрондар санына тең болуы шарт
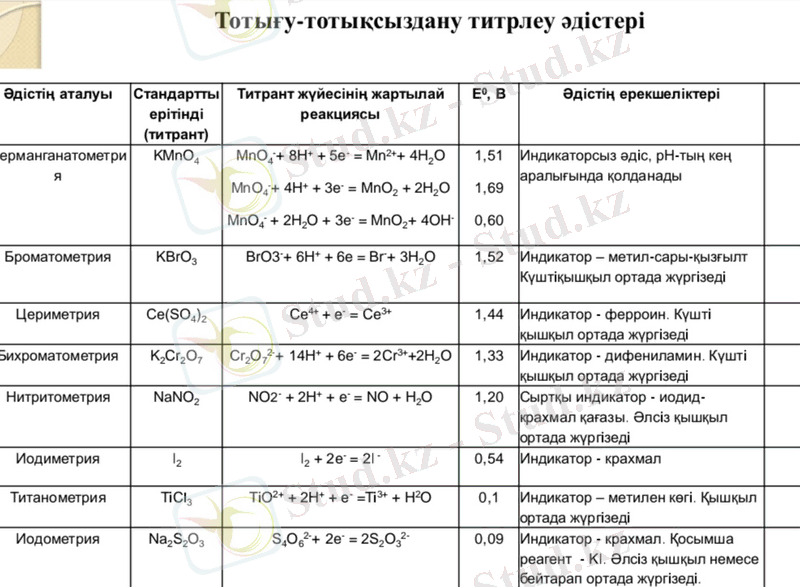
2 . Перманганатометрия, Иодометрия, Бихроматометрия әдістеріне сипаттама.
Қазіргі таңда тотығу-тотықсыздану титрлеуінің оннан астам түрі белгілі. Көбінесе оларды келесі классификацияға жіктейді. Реагенттің табиғаты бойынша классификациясы. Анықталатын затпен әрекеттесетін реагент бойынша жіктеледі. Бұл классификацияға төмендегі әдістерді жатқызуымызға болады( жақшаның ішінде осы әдістің негізгі әрекеттесуші заты берілген перманганатометрия(калий перманганаты(KMnO4), иодометрия(калий иодиді KI) және бихроматометрия әдістері. Перманганатометрия - перманганатпен көбінесе қышқыл ортада тотықтыру реакцияларына негізделген. Калий перманганатының титрленген ерітіндісін тұздың анық нақты мөлшерін алып дайындауға болмайды, себебі пераманганаттың құрамында тотықсыздану нәтижесінде пайда болған
МnО2 бар. Сонымен қатар оның судағы ерітіндісі су мен ауадан кіретін әртүрлі қоспалармен (органикалық заттар, тозаң, аммияк т. б. ) тотығу-тотықсыздану реакциясына қатысуы нәтижесінде өзінің концентрациясын өзгертеді. Сондықтан перманга-наттың ерітіндісін 7-10 күнге қараңғы жерге қалдырады. Содан кейін КМnО4 ерітіндісін ептеп МnО2 тұнбасынан бөліп алады. Осылай дайындалған КМnО4 ерітіндісінің концентрациясы ұзақ уақыт тұрақты болады. Перманганат ерітіндісінің титрін натрий оксалатын (Na2С2О4) немесе қымыздық қышқылын
(Н2С2О4) пайдаланып анықтайды. Перманганат пен қымыздық қышқылы арасындағы реакция - автокаталитикалық реакция деп аталады. Перманганаттың алғашқы тамшысының бояуы ыстық ерітіндіде де өте баяу жойылады. Титрлеу барысында Мn2+ иондарының концентрациясы артып, реакцияның жылдамдығы өседі. титрлеуде титранттың өзі индикатор ролін атқарады. Перманганаттың артық мөлшері құйылғанда ерітінді қызғылт түске боялады. Перманганатометория тәжірибеде кең қолданылады. Бұл әдіспен тікелей тотықсыздандырғыштарды титрлеуге болады(Fe2+, Н2О2, NO2-т. б. ) Перманганатометриялық титрлеуді тура, кері және жанама жолмен жүргізеді.
Тура титрлеумен анықтайды нитриттерді, сутегі пероксиді; Fe2+, Sn2+, U2+, оксидтерді
Кері титрлеумен анықтайды - PbO2тотықтырғыштарды
Жанама титрлеумен тотықтырғыш қасиеті жоқ иондарды анықтайды, мысалы аз еритін оксалаттар түзетін катиондарды: Са2+, Ba2+, Sr2+, Zn²+, Pb2+
Органикалық қосылыстарды метанол, құмырсқа, шарап, лимон, салицил қышқылдарын, глицерин, фенол, формальдегид.
Иодометрия реакцияға негізделген тотығу және қалпына келтіру үшін пайдаланылатын әдіс. Стандартты потенциалдың сандық мағынасына қарасақ, бос күйінде йод орта күшті тотықсыздандырғыш қасиетін көрсетеді. Йодометрия әдісінде йодтың тотықтырғыш қасиетін де, тотықсыздандырғыш қасиетін де пайдаланады. әдісінің негізінде келесі реакция жатыр:
тотықтырғыш
тотықсыздандырғыш.
Йодтың тотықтырғыштық және тотықсыздандырғыштық қасиеттеріне қарай йодометрияны екі әдіске бөледі:
Иодометрия- титрант I2 ерітіндісі. Титрлеуді I2 бос йод ерітіндісімен жүргізеді, мұнда йод тотықтырғыш ретінде пайдаланады, индикатор - крахмалды бірден зерттелетін ерітіндіге қосады. Эквиваленттік нүктені крахмалдың йодпен көк бояуы пайда болуымен анықтайды:
Иодометрия- титранттар KI және Na2S2O3
Титрлеуді калий йодиді KI ерітіндісімен жүргізеді, нәтижесінде бөлініп шыққан бос йодты натрий тиосульфатының стандартталған ерітіндісімен титрлейді. Мұнда (I-) йодид-ион тотықсыздандырғыш ретінде қолданады. Индикатор - крахмалды титрлеудің соңында қосады.
Йод ерітіндісінің нақты титрі стандартталған Na2S2O3*5H2O натрий тиосульфаты ерітіндісі бойынша аптасына 2-3 рет анықталады.
Ал натрий тиосульфатының жұмысшы ерітіндісін қайта кристалданған тұзынан дайындайды, оның дәл концентрациясын K2Cr2O7 калий бихроматының стандартты ерітіндісі арқылы анықтайды.
Йодометриялық реакцияларды бірнеше жолмен өткізуге болады:
Индикаторсыз жолмен - бұл жағдайда ерітіндідегі бос күйдегі йод сары түске боялады, мысалы 0, 1М 100мл ерітіндіде оның сары бояуы көзге жақсы көрінеді.
Йодтың сұйытылған немесе боялған ерітіндісін титрлегенде индикатор ретінде крахмал қолданады, оның әсерінен йод бар ерітінді қою көк түске боялады. Бұл реакцияның сезімталдығы жоғары, сондықтан йодтың концентрациясы дәлірек анықталады. Крахмалдың ерітіндісі тұрақсыз және бірнеше күн сақтағанда ауадағы бактериялардың әсерінен бұзылады, сондықтан оған хлороформ немесе HgI2 қосады. Крахмал титрлеудің соңында, ерітінді сарғыш түске боялғанда, қосылады, себебі йодтың жоғары концентрациялары крахмалды бұзады.
Йодпен қою көк бояуды крахмалмен қатар, коллоидты ерітінді түрінде болатын келесі қосылыстар береді - кейбір сирек кездесетін элементтердің ацетат тұздары, кумарин, флавон, вариамин көк, үшфениларсоний йодиді және т. б. заттар. Йод ертіндісімен заттар тура негізделіп тотықса, кейде оны йодометриялық әдіс дейді. 1) Йодометрияда қолданылатын жұмыс ерітінділері. Йодтың ерігіштігі суда көп емес (шамамен 0, 2 гр/л) сондықтан оның титрлі ерітіндісін KI концентрлі ерітіндісіндегі бос йодтың нақты өлшендісінен дайындайды. Йод өзінің қызыл сары түсі ертіндіде жеткілікті интексивті және түссіз ертінділерді титрлегенде индикатордың көмегіне жүгінбейді. 100мл ертіндіде йодтың 1 тамшы 0, 1м көзге қызыл сары түсі көрінеді. Титрлеу кезінде индикатор ретінде ерітіндіні көк түске бояйтын, крахмалдың йодпен қосылысын қолданады. Йодометрия әдісі жалпы универсалды болып келеді. Йодометриялық түрде тотығу-тотықсыздану қасиетіне ие болмайтын заттар мен қышқылдарды, тотығу, тотықсыздануды анықтауға болады. Йодометриялық әдіспен көптеген заттарды анықтауға болады: формальдегид, ацетат, қант, спирт, азот.
Иодометрияның қолданылуы:
• анықтауда - As3+, Sb3+, Sn2+ қосылыстарын, сульфиттерді, H2S,
ZnS, ;
•тотықтырғыштарды анықтауда - K2Cr2O7, аз еритін хроматтарды (Pb2+, Ba2+)
•йодометриялық әдіспен судың құрамындағы еріген оттектің мөлшерін анықтаудың дәстүрлік әдісі - Винклер әдісі болып табылады;
•майлардың сапасын зерттеуде олардың құрамындағы пероксидтердің мөлшерін йодометриялық әдіспен анықтайды. Бихроматометрия -қышқылдық ортада калий бихроматының K2Cr2O7 то-тықтырғыштық қасиетін қолдануға негізделген әдіс.
Тотықсыздандырғыш-пен әсер еткенде бихромат-ион Cr2O72- алты электрон қосып алып Cr3+ айна-лады. Бихроматометрия әдісінің перманганатометрия әдісіне қарағанда кейбір артықшылықтары да бар.
Калий бихроматын химиялық таза күйінде ерітіндісін қайта кристалдау арқылы оңай алуға болады, сондықтан оның стандартты ерітіндісін дәл өлшендісінен дайындауға болады. Калий бихроматының ерітінділері өте тұрақты, ұзақ уақыт өзгермей сақталады. Калий бихроматы хлорид иондарын тотықтырмайды. Сондықтан, тұз қышқылы қатысында титрлеуге мүмкіндік береді.
Бұл әдістің бір кемшілігі - реакцияның нәтижесінде түзілген Cr3+ ион-дарының жасыл түсі эквивалентті нүктені анықтауды қиындатады.
Бихроматометрия әдісінде индикатор ретінде дифенилсульфон қышқылы, фенилантронил қышқылы, фосфор қышқылы қатысында дифиниламин қол-данылады, ол бихроматтың аздаған ғана артық мөлшерінде түссізден көк түс-ке боялады. Дифиниламин редоксиндикаторларға жатады, оның тотығу-тотықсыздану потенциалының шамасы +0, 76В дифениламиннің тотыққан формасының түсі көк, ал тотықсызданған формасы - түссіз.
3. Бұл әдістердің практикада қолданылуы
Перманганатометрия әдісінде титрант ретінде күшті тотықтырғыш болып келетін KMnO4 - калий перманганатының тотықтырғыш қасиеттеріне негізделген. KMnO4 ортаның рН шамасына
байланысты әртүрлі өнімге дейін тотықсызданады:
қышқылдық
ортада (ерітінді түссізденеді)
бейтарап ортада
(ерітінді сары түсті)
сілтілік ортада
(ерітінді жасыл түсті) Перманганотометрия әдісі кальцийді, марганецті (II), темірді (II), сутегі пероксидін және нитриттерді анытау үшін, ал медициналық анализдерде сутегі пероксиді мен магнийдің, лактат пен кальций глюконатының және басқа фармпрепараттардың сапасын бақылау үшін қолданылады.
 Иодометрия
Na 2 S 2 O 3 Титрлеуді калий йодиді КІ ерітіндісімен жүргізеді, нәтижесінде бөлініп шыққан бос натрий тиосульфатының стандартталған ерітіндісімен титрлейді. Мұнда (1) йодид-ион тотықсыздандырғыш йодты ретінде қолданады. Индикатор:крахмалды титрлеудің соңында қосады(2Na2S2O3 + I2 = Na2S4O6 + 2Nal) Иодометрия әдісі медициналық тәжірибеде несептегі, қан плазмасындағы, он екі елі ішек сұйығындағы диастаза ферментін анықтау үшін, сол сияқты көптеген фармпрепараттарға (сульфаниламидті, мышьякты, антипирин, анальгин, витаминдер, пенициллин және т. б. ) анализ жасау үшін қолданылады.
Бихроматометрия
Бұл әдіс көптеген бейорганикалық және органикалық заттарды анықтау үшін қолданылады: (Fe (II), Cr(II), Mn (II), Ti(III), Mo(V), Te(IV) сияқты элементтерді, йодидтер, спирттер, глицерин, және т. б. заттарды анықтауға болады.
Иодометрия
Na 2 S 2 O 3 Титрлеуді калий йодиді КІ ерітіндісімен жүргізеді, нәтижесінде бөлініп шыққан бос натрий тиосульфатының стандартталған ерітіндісімен титрлейді. Мұнда (1) йодид-ион тотықсыздандырғыш йодты ретінде қолданады. Индикатор:крахмалды титрлеудің соңында қосады(2Na2S2O3 + I2 = Na2S4O6 + 2Nal) Иодометрия әдісі медициналық тәжірибеде несептегі, қан плазмасындағы, он екі елі ішек сұйығындағы диастаза ферментін анықтау үшін, сол сияқты көптеген фармпрепараттарға (сульфаниламидті, мышьякты, антипирин, анальгин, витаминдер, пенициллин және т. б. ) анализ жасау үшін қолданылады.
Бихроматометрия
Бұл әдіс көптеген бейорганикалық және органикалық заттарды анықтау үшін қолданылады: (Fe (II), Cr(II), Mn (II), Ti(III), Mo(V), Te(IV) сияқты элементтерді, йодидтер, спирттер, глицерин, және т. б. заттарды анықтауға болады.
Бұл әдістің кемшілігі: иондарының жасыл түсі эквиваленттік нүктені анықтауды қиындатып кедергі келтіредіы, сондықтан титрлеу кезінде ерітінді сұйылтылады. Дифениламин, дифениламин сульфон қышқылы индикатор бола алады. Бұл әдістің кемшілігі: иондарының жасыл түсі эквиваленттік нүктені анықтауды қиындатып кедергі келтіредіы, сондықтан титрлеу кезінде ерітінді сұйылтылады. Дифениламин, дифениламин сульфон қышқылы индикатор бола алады.
4. Тотығу-тотықсыздану потенциалдары деген не, олар қалай анықталады және нені сипаттайды
Титрлеудің тотығу-тотықсыздану әдісінде калий перманганаты ерітіндісі стандартты ерітінді болып табылады. Тотықсыздандырғышты осы әдіспен анықтауды қышқыл, бейтарап және сілтілі ортада өткізуге болады. Калий перманганатының эквиваленттік факторы бұл орталарда әр түрлі және 1/5, 1/3 және 1-ге тең.
Қышқыл ортада марганецпен (VII) тотығу.
2KMnO
4
+ 10FeSO
4
+ 8H
2
SO
4
→ 5Fe
2
(SO
4
)
3
+ 2MnSO
4
+ K
2
SO
4
+ 8H
2
O
MnO
4
-
+ 8H
+
+ 5ē → Mn
2+
+ 4H
2
O
Бейтарап немесе әлсіз сілтілі ортада тотығу.
KMnO
4
+ 3FeSO
4
+ 5KOH + 2H
2
O → 3Fe (OH)
3
↓ + MnO
2
↓ + 3K
2
SO
4
MnO
4
-
+ 2H
2
O + 3ē → MnO
2
+ 4 OH
-
Cілтілі ортада тотығу.
KMnO
4
+ FeSO
4
+ 3KOH → Fe (OH)
3
↓ + K
2
MnO
4
+ 3K
2
SO
4
MnO
4
-
+ 1ē → MnO
4
2-
Тәжірибеде калий перманганатын тотықсыздандыруды көбіне қышқыл ортада өткізеді.
Перманганат ерітіндісімен титрлегенде индикатор керек болмайды, себебі бар ерітінділер ашық күлгін қызыл түске боялған. Ерітіндінің температурасы және қышқылдығы тәжірибеде қызғылт бояудың көрінуіне әсер етпейді. Калий перманганаты қышқыл ортада көптеген тез және стехиометриялы әрекеттеседі.
Перманганатометрияның кемшілігі - перманганатты таза күйінде алудың қиындығында, ол MnO 2 ізімен ластанған болады. Сол себептен калий перманганаты ерітіндісінің дәл концентрациясын алдын ала анықтау қажет. Марганец диоксидін жою үшін ерітіндіні қолданудың алдында перманганатты тотықсыздандырмайтын шыны сүзгі арқылы сүзеді.
Марганец диоксидінен ерітінділерді ұзақ уақыт сақтауға болады. перманганаттың қышқыл ерітінділері бейтараптарына қарағанда тезірек ыдырайды. Перманганатпен титрлеу қышқыл ортада жеңіл жүреді.
Иодометрия - титранттар KI және Na 2 S 2 O 3
Титрлеуді калий йодиді KI ерітіндісімен жүргізеді, нәтижесінде бөлініп шыққан бос йодты натрий тиосульфатының стандартталған ерітіндісімен
титрлейді.
Мұнда (I-) йодид-ион тотықсыздандырғыш ретінде қолданады. Индикатор-крахмалды титрлеудің соңында қосады.
2I -2e - → I 2
2 Na 2 S 2 O 3 + I 2 → Na 2 S 4 O 6 + 2 NaI
Йодтың тотықтырғыш потенциалы күшті тотықтырғыштар мен күшті потенциалдары шамаларының арасында орташа орын алады, сондықтан йодометрия әдісінің әмбебаптылығы -тотықтырғыштар мен бірден анықтауға болады.
5. Қорытынды:
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz
