Лекция 4: Химиялық байланыс - Льюис диаграммалары, алмасу мен донорлы-акцепторлы механизмдер, ковалентті байланыстардың қасиеттері және орбитальдық гибридтену


Лекция 4.
1. Тақырыбы: Химиялық байланыс. БЖБ
2. Мақсаты: H 2 , Cl 2 , O 2 , N 2 , HCl, NH 3 молекулалары үшін Льюис диаграммасын құру;
донор-акцепторлы және алмасу механизмі бойынша ковалентті байланыстың түзілуін түсіндіру;
ковалентті байланыстың қасиеттерін сипаттау; BF 3 , CH 4 , NH 3 , H 2 O, ВеСl 2 мысалында молекуланың электронды және кеңістіктік құрылысына зат қасиетінің тәуелділігін түсіндіру;
3. Дәріс тезистері
Химиялық байланыс - атомдардың бір-бірімен жай және күрделі заттар түзіп
қосылатынын айтамыз. Онда әр түрлі химиялық байланыс түзіледі: ионды,
ковалентті (полюсті және полюссіз), металдық және сутектік. Атомдар
арасында ионды немесе ковалентті байланыстың қайсысы түзілетінін анықтайтын
элемент атомдарының ең негізгі қасиеттерінің бірі - терісэлектрлік,
яғни атомдардың қосылыстарда өзіне электрондарды тарту бейімділігі.
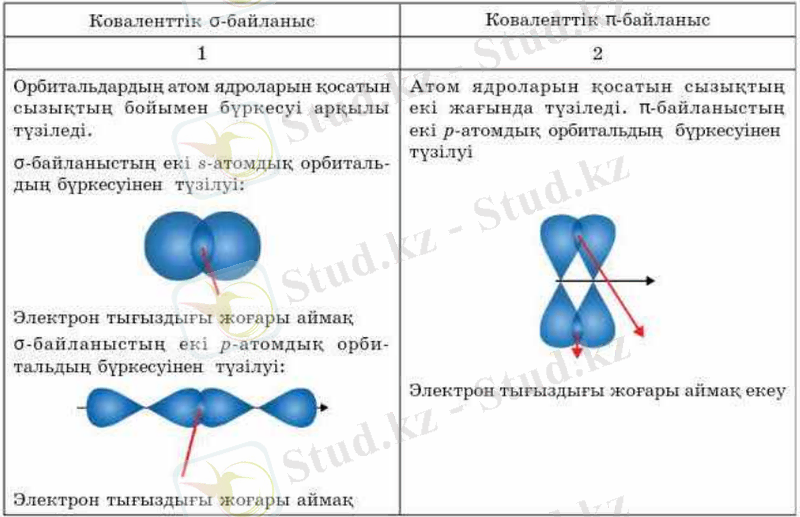
Ковалентті химиялық байланыста - әрекеттесуші атомдарға ортақ электрондар жұбы пайда болып, олардың санына қарай бір немесе бірнеше еселенген байланыстар түзіледі. Мысалы, сутек молекуласы атомдары арасында бір (Н:Н), оттек молекуласында қос (:О::О:), азот молекуласында үш (:N:::N:) еселенген ковалентті Химиялық байланыс бар. Ковалентті Химиялық байланыстар электрон жұбының атомдардың арасында орналасуына қарай полюсті және полюссіз деп екіге бөлінеді. Полюсті молекулада Химиялық байланыс түзетін ортақ электрондар электр терістілігі күшті атомға ығыса орналасады. Молекуланың полюстілігі диполь моменті арқылы көрсетіледі. Полюстік молекулалардың қайнау және балқу температурасы төмен, полюсті еріткіштерде үйектеліп иондарға ыдырайды. Полюссіз ковалентті Химиялық байланысты молекулада электрон жұбы атомға ауыспай, симметриялы түрде ортада орналасқан. Полюссіз Химиялық байланыстағы қосылыстардың қайнау және балқу температуралары төмен, полюсті еріткіштерде иондар түзбейді, электр тоғын өткізбейді.
Кез келген химиялық байланыс түзілгенде жүйенің энергиясы төмендейді . Химиялық байланыс түзілгенде атомдардың алғашқы және соңғы күйлерінің энергияларының айырымы байланыс энергиясы деп аталады, оның мәні 125-1050кДж/моль арасында болады. Екі атом ядроларының арасы байланыс ұзындығы деп аталады және d деп белгіленеді. Ортақ электрондар жұбын сызықпен де белгілейді. Байланыстың еселігі артқан сайын байланыс ұзындығы азайып, байланыс энергиясы артады: С-С, С=С, СºС сәйкесінше (нм және кДж) 0, 154 және 348; 0, 135 және 598; 0, 120 және 838. Ковалентті байланыстың қасиеттері: қанығу, бағытталу және поляризациялану. Ковалентті байланыстың қанығуын элемент атомындағы жұптаспаған.
Коваленттік байланыс - ортақ электрон жұбын түзу арқылы пайда болатын химиялық байланыс. Коваленттік байланыс түзілуінің үрдісін көбінесе схема түрінде береді, ондағы электрондар нүктемен белгіленген. Егер атомдардың арасында бір коваленттік байланыс болса (жалғыз ортақ электрондық жұп), онда ол дара, егер екеу болса, қос (екі ортақ электрондық жұп), үштік (үш ортақ электрондық жұп) деп аталады. Н 2 затын құратын ковалентті байланы екі сутегі атомдарында ортақ екі электроны бар. Коваленттік байланысты екі түрге бөледі: полярлы және полярлы емес . Полярлы емес коваленттік байланыстың электрон бұлттары ортақ электрон жұбымен құрылған, яғни электрондық байланыс бұлттары екі атом ядроларына қатысты кеңістікте симметриялы орналасқан. Полярлы емес коваленттік байланыс бейметалдарда пайда болады және металл жұптарында, химиялық элементтің бір атомынан: Н 2 , О 2 , О 3 , Н 2 , және басқалары құрылса, полярлы коваленттік байланыстың электрон бұлттары электртерістілігі жоғары атомға қарай ығысқан (НСl, H 2 О, H 2 S, NH 3 және т. б) . Бұл байланыс екі түрлі механизм бойынша түзіледі: алмасу механизмі - әр элемент байланысқа өзінің электронын береді, мысалы, сутегі молекуласы түзілуі
Н· + ·Н → Н : Н;
Донорлы-акцепторлық механизм - бір атомның электрон жұбы (донор) ортақ болады, ал екінші атомнан бос (□) орбитал (акцептор) болады:
□Н + + :NH 3 → NH + 4
Коваленттік байланыстың негізгі қасиеттеріне қанығуы, полюстенуі, бағытталуы жатады. Коваленттік байланыстың қанығуы әр атомға тән ортақ электрон жұптарының санымен анықталады. Химиялық байланыстың ерекшелігі - қанығуға қабілеті бар, яғни атом өзінің валенттік орбитальдарын толық пайдалануға тырысады. Қанығуына сай молекулалық байланыстың да белгілі құрамы болады. Сондықтан, Н 2 , НСl, Н 2 О, BCl 3 , CH 4 сияқты молекулалардағы байланыстар қаныққан, яғни атомдардың барлық орбитальдарында ортақ электрон жұптары орналасқан. Коваленттік байланыстың полюстенуі молекулалардың өздерінің және олардағы жеке байланыстардың полюстігінің сыртқы электр өрісінің әсерінен өзгеру қабілетімен сипатталады. Полюстену молекуладағы электрон тығыздығының бірдей болмауына әкеледі. Мысалы, НСl молекуласында сутек ядросына қарағанда хлор ядросының маңында электрон тығыздығы жоғары. Молекуладағы оң және теріс зарядтың орталықтары сәйкес келмейді де біраз қашықтықта болады. Коваленттік байланыстың бағытталуы молекулалардың кеңістіктік құрылымын (пішінін), яғни олардың геометриялық формасын тудырады. Мұны кәдімгі молекулалардың: НСl, Н 2 О түзілу мысалында қарастырайық. Коваленттік байланыс атомдардың қосылу сызығының бойында электрон бұлттары, (орбитальдары) максимал бүркескен бағытта пайда болады. Хлорсутек НСl молекуласы сызықты, өйткені сутек атомының s-орбиталі мен хлор атомының p-орбиталінің бүркесуі есебінен түзіледі. Су молекуласы Н 2 О түзілгенде, оттек атомы екі валенттік р-электрондары арқылы сутекпен бұрышты молекула түзеді
BeC 2 , BCl 3 және CCl 4 секілді молекулалардың құрылысын түсіндіру үшін Полинг пен Слейтер (АҚШ) атомдық орбитальдардың гибридтенуі жайлы түсінік енгізді. Олар бірнеше атомдық орбитальды энергиясы мен пішіні жағынан сәл ғана айырмашылығы бар гибридтенген орбитальдармен ауыстыруды ұсынды. Егер, атомдар арасындағы байланысты түзуге әртүрлі типті ( s- және p- ), пішіні де өзгеше орбитальдар қатысса, онда гибридтік орбитальдар түзіледі.
Орбитальдардың араласуы гибридтену деп аталады. Гибридтену моделі s- және p- орбитальдары араласқанда қолданылады. Атомдық s және p- орбитальдарына қатысты электрон толқындарының интерференциясы энергия мен пішіндері әртүрлі жаңа, қосылған орбитальдар түзуі мүмкін.
sp-гибридтену. Берилий хлориді түзілгенде бір s- және бір p- орбитальдарының гибридтелуі жүзеге асады. Be атомының қозған күйде екі жұптаспаған электрондары болады. Оның біреуі 2 s- орбитальда, екінші бір электроны - 2 p- орбитальда орналасады. Химиялық байланыс түзілгенде екі түрлі орбиталь араласып, формасы өзгерген екі бірдей гибридтенген орбитальдар түзеді. Олар өзара 180° бұрыш жасап байланысады (сурет 1) . Гибридті орбитальдардың бір-біріне қатысты сызықты орналасуы - олардың бір-бірінен аз тебілуін қамтамасыз етеді. Нәтижесінде BeCl 2 молекуласының құрылысы сызықтық болады. Өйткені, барлық үш атом да бір сызықтың бойында орналасады.

BeCl 2 молекуласы түзілгендегі электрон бұлттары бүркесуінің сызбанұсқасы.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz