Каустік соданы электрохимиялық алу және сода ерітіндісін каустификациялау: зертханалық жұмыс


ҚАЗАҚСТАН РЕСПУБЛИКАСЫНЫҢ ҒЫЛЫМЖӘНЕ ЖОҒАРЫ БІЛІМ МИНИСТРЛІГІ
«М. ӘУЕЗОВ атындағы ОҢТҮСТІК ҚАЗАҚСТАН УНИВЕРСИТЕТІ»
«Химия» кафедрасы
«БИОХИМИЯ» пәні

Зертханалық жұмыс
Тақырыбы:
Орындаған:
Тобы:
Қабылдаған:
Шымкент, 2023 ж.
№I ЗЕРТХАНАЛЫҚ ЖҰМЫС
КАУСТІК СОДАНЫ ЭЛЕКТРОХИМИЯЛЫҚ ӘДІСПЕН АЛУ
1. Жұмыс мақсаты:
- Каустік соданы электрохимиялық әдіспен алу технологиясымен
танысу. Натрий хлориді ерітіндісінің электролизі кезіндегі негізгі электродты процестерді оқып үйрену.
2) Процестің технологиялық көрсеткіштерін анықтау: электролиз
өнімдерінің ток бойынша шығымын және электр энергиясының қолдану дәрежесін есептеу.
- Электролиз параметрлерінің (процестің ұзақтығының, ерітіндінің
концентрациясының, ток күшінің) процестің негізгі көрсеткіштеріне әсерін анықтау.
2 Теориялық мәліметтер
2. 1 Электролиз туралы жалпы мағлұматтар, электрохимиялық процестердің сипаттамасы
Электролиз дегеніміз ерітінділер және электролит балқымалары арқылы электр тогын өткізгенде электродтарда жүретін процесс. Электролиттер дегеніміз ерігенде не балқығанда, ерітіндіге не балқымаға электр тогын өткізу қабілетін беретін заттар. Сонымен қатар электролиттерді екінші текті өткізгіштер деп те атайды. Натрий хлоридінің сулы ерітіндісі қолдануға ыңғайлы электролит болып саналады. Электролиттер еріген кезде оң және теріс зарядталған бөлшектерге - иондарға ( аниондар мен катиондар ) ыдырайды. Олар электролиттерге ерекше қасиеттер береді.
Электролиттер екі негізгі топқа бөлінеді: күшті (иондарға толық диссоциацияланады) және әлсіз . Күшті электролиттер салыстырып қарағанда аз болады. Оларға сілтілі және сілтілік әсері бар металдардың минералды тұздары, галогенидтер және кейбір ауыспалы металдардың перхлораттары және нитраттары жатады. Минералды қышқылдар мен сілтілер тек барынша сұйытылған сулы ерітінділерде ғана күшті электролит бола алады. Әлсіз электролиттерге органикалық тұздар, қышқылдар және негіздер, сонымен қатар ерітіндіде көп зарядты иондар түзетін көптеген бейорганикалық заттар жатады. Электролиттерде реакция басталуы үшін тұрақты электр тогын беру керек. Электролиттерге электр тогы электродтардың көмегімен беріледі. Оң зарядталған электродтың (анодтың) бетіндегі иондар, молекулалар және атомдар электрондарын береді, яғни анодта электрохимиялық тотығу реакциясы жүреді. Ток көзінің теріс полюсіне қосылған электродта (катодта) электрондардың қосылуы жүреді, яғни катодта электрохимиялық тотықсыздану реакциясы жүреді.
Электролит ерітіндісі не балқымасы арқылы электр тогын өткізу уақытының, электр тогының мөлшерінің және өндірілетін не шығындалатын заттардың мөлшерлерінің арасында Фарадей заңдарымен анықталатын нақты сандық қатынастар бар.
Фарадейдің 1-ші заңы: Электролиз кезінде бөлінетін заттардың мөлшері электролит арқылы өткен электр тогының мөлшеріне тура пропорционал.
Фарадейдің 2-ші заңы: Әр түрлі электролиттер арқылы бірдей электр мөлшерін өткізгенде электродтарда бөлінетін заттардың мөлшерлері олардың электрохимиялық эквиваленттеріне пропорционал болады.
Электр мөлшері кулон (ток күші І ампер болғанда І секундта өткен электр мөлшері), немесе ампер-сағат (І ампер-сағат = 3600 кулон) бірлігімен өлшенеді. Бір грамм-эквивалент затты алуға шығындалатын электр мөлшері тұрақты сан болып табылады, оны Фарадей саны деп атайды. Фарадей саны 96500 кулон = 96500 ампер-сек. = 26, 8 ампер-сағ . тең.
1 ампер-сағат электр мөлшері өткенде электродта түзілген заттың мөлшері сол заттың электрохимиялық эквиваленті деп аталады. Заттың атомдық салмағын (А) біле отырып, оның электрохимиялық эквивалентін (Е) есептеуге болады:
Электролиз процесінің нәтижелілігі келесі параметрлермен және көрсеткіштермен сипатталады: ток күші, кернеу, ток тығыздығы, ток бойынша шығым, электр энергиясын қолдану дәрежесі және электр энергиясының шығын коэффициенті.
Электролизерлердегі (электролиз жүретін аппарат) ток күші оның өнімділігін сипаттайды. Электролизер арқылы өтетін ток күші неғұрлым көп болса, электролиз процесінде алынатын өнімнің шығымы соғұрлым жоғары болады.
Электролизердегі нақты кернеу бірнеше құраушылардан тұрады.
U конц - концентрациялық поляризация, в:
U асқ. - анод пен катодтағы асқын кернеу потенциалы, в:
мұндағы: ϕ a және ϕ к - анодты және катодты асқын кернеулер, в.
ΣJ·R - омдық кедергілер қосындысы, яғни электролиттің, диафрагманың, электродтардың, ток өткізгіштерінің омдық кедергілеріне шығындалатын кедергі.
Натрий хлоридінің қаныққан ерітіндісінің электролизі кезіндегі анодтың және катодтың тең әсерлі потенциалдары:
ϕ aт =+1, 33в, ϕ кт = − 0, 84в.
Электролиз кезінде омдық кедергілер қосындысының және поляризацияның шамасын төмендету арқылы электролизердегі кернеуді азайтуға тырысады. Ыдырау кернеуі әрекеттесуші заттың табиғатына байланысты болғандықтан оны өзгерту мүмкін емес.
Ток тығыздығы дегеніміз электролизер арқылы өтетін ток күшінің электрод бетінің шамасына қатынасы (а/м 2 ) . Ток тығыздығының шамасы электрод бетінің бірлігінен алынатын өнімнің мөлшерін, яғни электролизердің өнімділігін анықтайды. Сондықтан, егер ток тығыздығын жоғарылатқанда өнімнің шығымы азаятын болса, онда ток тығыздығын мүмкіндігінше жоғарылатуға тырысады.
Ток бойынша шығым (η) дегеніміз электролиз кезінде алынған заттың мөлшерінің (G тәж ) оның Фарадей заңы бойынша алынуға қажет мөлшеріне (G t ) қатынасы:
«Ток бойынша шығым» деген түсінік химиялық процестегі өнімнің шығымы деген түсінікке сай. Заттың теориялық мөлшерін Фарадейдің екі заңын біріктіретін теңдеу бойынша есептейді:
мұндағы: А - электролиз барысында алынатын заттың атомдық салмағы, г; J - ток күші, а; τ - электролиз ұзақтығы, сағ; n - катионның валенттілігі;
F- Фарадей саны, а·сағ.
Электр энергиясын қолдану дәрежесі (μ) дегеніміз энергияның теориялық қажетті мөлшерінің (W теор. ) оның электролиз кезінде шығындалған тәжірибелік мөлшеріне (W тәж ) қатынасы:
Энергияның теориялық шығыны (W теор. ) келесі формула бойынша есептеледі:
Электролиз барысында жұмсалған энергияның тәжірибелік шығыны (W тәж ) . келесі формула бойынша есептеледі:
Каустік соданы алудың электрохимиялық әдісі
Натрий хлориді ерітіндісінің электролизі - сулы ерітіндідегі электрохимиялық процестің негізгі мысалы болып саналады. Бұл процестің нәтижесінде құнды өнім каустік содамен (NaОН) қатар сутегі және хлор алынады.
Электролиз процесі тор немесе тесіктері бар табақшалар түрінде жасалған темір катоды бар диафрагмалық немесе сұйық сынапты электролизерлерде жүргізіледі. Анод ретінде графит қолданылады. Өнеркәсіпте торлы болат катодқа тығыз орналасқан сүзгіш диафрагмасы бар электролизер қолданылады. Натрий хлоридінің қаныққан ерітіндісі анод кеңістігі арқылы беріледі. Ол гидростатикалық қысым әсерінен кеуек диафрагма арқылы сүзіліп, катодты жуып өтеді.
Натрий хлориді суда келесі схема бойынша ыдырайды:
NaCl ерітіндісі арқылы тұрақты ток өткенде анодта Cl - және ОН - иондары разрядталады, ал катодта Na + және H + иондары. Анодта келесі тотығу-тотықсыздану процестері жүруі мүмкін:
Ал катодта келесі реакциялар жүруі мүмкін:
NaCl-ң қаныққан ерітіндісіндегі анодтағы ОН - ионының разрядталуының тең әсерлі потенциалы +0, 82в, ал Cl - ионының разрядталу потенциалы +1, 33в. Графитті анодтағы оттегінің асқын кернеуі хлордың асқын кернеуінен жоғары болғандықтан, алдымен Cl - ионы Cl 2 -ні түзіп разрядталады. Ерітіндінің концентрациясының төмендеуімен хлор разрядының потенциалы жоғарылайды. Сондықтан процесте құрамында 310-315г/л NaCl бар қаныққан ерітінді қолданылады.
Темір катодта Na + ионын разрядтау үшін электродтағы кернеу Н + ионның кернеуінен 6, 5 есе көп болуы керек (Na + ионы үшін -2, 71в, ал Н + ионы үшін -0, 415в) . Бірақ электролизерде мұндай кернеудің болуы мүмкін емес, сондықтан тек Н + ионы ғана разрядталады. Ал Na + және ОН - иондары катодтық кеңістікте жиналып күйдіргіш натр түзеді:
Жалпы электролиз процесі мына теңдеумен өрнектеледі:
Электролиз процесінде электролиттердің құрамындағы иондардың ішінен теория жүзінде ең аз электродты потенциалы бар ион ғана разрядталады.
Электролиз барысында негізгі процестермен қатар жанама процестер де жүруі мүмкін. Жанама реакциялардың әсерін азайту үшін асбесті сүзгіш диафрагма қолданылады. Жанама процестерге газды хлор мен оттегінің ерітіндінің басқа компоненттерімен әрекеттесуі жатады. Хлор жарым-жартылай аналитте еріп, су және сілтімен әрекеттесуі нәтижесінде натрий хлориді, хлораты мен гипохлориті түзіледі:
Анодта ОН − ионының разрядталуына байланысты (1. 14) теңдеуі бойынша өте аз болса да оттегі бөлінеді, ол графитті анодтың көміртегісі мына реакция бойынша әрекеттеседі:
Жанама процестер негізгі өнім бойынша ток шығымын төмендетеді, әсіресе электр тогының көп бөлігі NaClO-ның NaClO 3 -ке дейін тотығуына шығындалады. Жанама процестерді болдырмау немесе оларды азайту үшін электролиз өнімдері араласпауы керек. Сол себептен анод және катод кеңістіктерін бөліп тұратын дифрагма қолданылады.
Ток бойынша шығымды жоғарылату мақсатымен жоғары концентрациялы электролит (310-315г/л қаныққан ерітінді) қолданылады. Температураны 70-80 0 С-ге дейін жоғарылату электролизердегі кернеуді төмендетуге және электр энергиясының меншікті шығынын азайтуға мүмкіндік береді.
Каустік соданы электрохимиялық алу әдісінің химиялық әдістермен салыстырғандағы артықшылықтарына: 1) технологиялық процестің қарапайымдылығы; 2) шикізат пен энергияның толық қолданылуы;
3) бірнеше құнды өнімдердің алынуы және 4) өнімнің жоғары сапасы жатады. Электрохимиялық процестердің негізгі кемшілігіне электр энергиясының жоғары шығыны жатады, ал электр энергиясына кететін шығындар өнімнің өзіндік құнының маңызды бөлігін құрайды. Электрохимиялық өндірістерде электр энергиясын тиімді қолдану маңызды мәселе болып саналады.
3 Қондырғының сипаттамасы және жұмысты орындау әдістемесі
3. 1 Қондырғылар, техникалық және аспаптық құралдар:
1. Диафрагмалы электролиздік қондырғы
2. Химиялық ыдыстар
3. Титрлеу қондырғысы
4. Liston А 1210 аквадистилляторы
3. 2 Қондырғының сипаттамасы
Мерзімді жұмыс істейтін электролизердің зертханалық қондырғысының сызба-нұсқасы 1. 1-ші суретте көрсетілген.
Ас тұзының сулы ерітіндісін электролиздеуге арналған қондырғы айнымалы токты түзеткіштен (18), диафрагмалы электролизерден (21), ток күшін реттейтін реостаттан (17), амперметрден (19) және вольтметрден (20) тұрады. Электролизер қораптан (4) және қақпақшадан (16) тұрады. Қорап пен қақпақшаға қысу өзегінің (5) көмегімен электролизердің конусты түбі (10) бекітіледі. Электролизердің ішіне ток өткізгіш сақина (9), торлы темір катод (8), көлденең асбестті диафрагма (7) және резеңке тығыздағыш (6) орналастырылған. Қақпақшаның бетіне NaCl-ң қаныққан ерітіндісін электролизерге беруге арналған үріңке (1), көлденең дискілі (3) көмірлі анод (2) және хлор мен сутегіні шығаратын шыны түтікше (15) орналастырылған. Ток (13) және (14) (катодты және анодты токөткізгіштер) нүктелерге беріледі. Электролизер тіреуіштерге (12) орналастырылған, ал электролизердің түбіне (10) өнімді жинайтын өлшемі бар ыдыс (11) қойылады.
Асбестті қоспаны катодта тұндыру арқылы сүзгіш асбесті диафрагма дайындалады. Бұл үшін 20-30г. асбесті ұнтақтап, су қосып 15-20минут аралығында біркелкі қоспа түзілгенше қайнатады. Алынған қоспаны (Бюхнер үріңкесін және Бунзен колбасын қолданып) вакуум-сорғыштың көмегімен тесік темір катодтың бетіне сүзіп алады. Диафрагманың беріктігін қамтамасыз ету үшін тесік темір катодтың бетіне сүзетін мата орналастырылады. Темір катодты диафрагмамен бірге электролизердің алынатын бөлігіне орналастырып, үстіне цилиндр қорап пен қақпақшаны қойып болттармен бекітеді.
3. 3 Жұмысты орындау тәртібі
1. Қондырғының жинау дұрыстығын және өлшеуіш құралдарының дұрыс қосылуын тексереді.
2. Анодтық кеңістікке натрий хлоридінің берілген концентрациялы ерітіндісін графиттік диск толық және анодтың өзегінің жартысы батып тұратындай етіп құяды.
3. Қондырғыны ток көзіне қосып, реостаттың көмегімен берілген ток күшін орнатады. Ток күшінің мәнін тәжірибенің соңына дейін тұрақты етіп ұстайды. Вольтметр мен амперметрдің көрсеткіштерін жазып алады.
4. Тұрақты ережені қамтамасыз ету мақсатымен берілген шарттарда электролизді 20минут аралығында жүргізеді, содан кейін катодты кеңістіктен 2-3сынама алып талдау жүргізеді. Талдау жүргізу үшін сынаманы келесі тәртіппен алады: электролизердің түбіне 25мм-лік өлшеуіш цилиндрді қойып, секундомерді іске қосып, 10минут аралығында катодты сұйықтықты жинайды. Содан кейін екінші сынама алу үшін цилиндрді басқа цилиндрмен алмастырады.
5. Алынған католиттің көлемін өлшеп, конусты колбаға құяды. Цилиндрдің ішін дистилденген сумен жақсылап шайып, жуындыны да колбаға құяды. Егер бастапқы сынаманың көлемі 10мл-ден көп болса, онда талдау жүргізу үшін пипетканың көмегімен оның 5мл-н алады.
6. Конусты колбадағы ерітіндіге индикатор ретінде 2-3тамшы фенолфталеин тамызып, 0, 1н НCl ерітіндісімен титрлейді. Егер индикатор ClO - ионының әсерінен түссізденіп кетсе, онда ерітіндіге сутегінің асқын тотығының 30%-қ ерітіндісінің 2-3мл қосып әдеттегідей титрлейді.
7. Титрлеу нәтижелері бойынша католиттегі күйдіргіш натрийдің концентрациясын (г/л) C NaOH есептейді:
4 Электролиздің технологиялық көрсеткіштерін есептеу
Электролиз процесінде энергияны тиімді қолданудың негізгі көрсеткіштері ретінде ток бойынша шығым және энергияны қолдану дәрежесі қолданылады.
- Ток бойынша шығымды (1. 6) формула бойынша есептейді. Ол үшін
алдымен электролиз кезінде алынған заттың мөлшерін есептейді:
NaOH-ң теориялық мөлшері (1. 7) формула бойынша есептеледі. Содан кейін күйдіргіш натрдың ток бойынша шығымы ((1. 6) формула) есептеледі.
2. (1. 8) формула бойынша электр энергиясының қолдану дәрежесі есептеледі. Ол үшін алдымен электр энергиясының теориялық (W т ) және тәжірибелік (W тәж ) шығындары сәйкесінше (1. 9) және (1. 10) формулалары бойынша есептеледі. Бұл кезде ток бойынша шығым арқылы көрсетілетін тәуелділікті алуға болады:
3. Барлық тәжірибелік мәліметтер мен есептеулер нәтижелері 1. 1 және 1. 2-ші кестелерге енгізіледі.
1. 1 кесте - Электролиз процесінің тәжірибелік мәліметтері
Сынақ
№
Сынақ алу уақыты
(τ), мин
1. 2 кесте - Электролиз процесінің көрсеткіштері
Бастапқы
ерітіндінің
концентра-циясы (С NaCl ), %
Сынақ
№
NaOH-ң концентра-циясы
(С), г/л
Ток бойынша шығым
(η), %
Электр
энергиясын
қолдану
дәрежесі (μ),
%
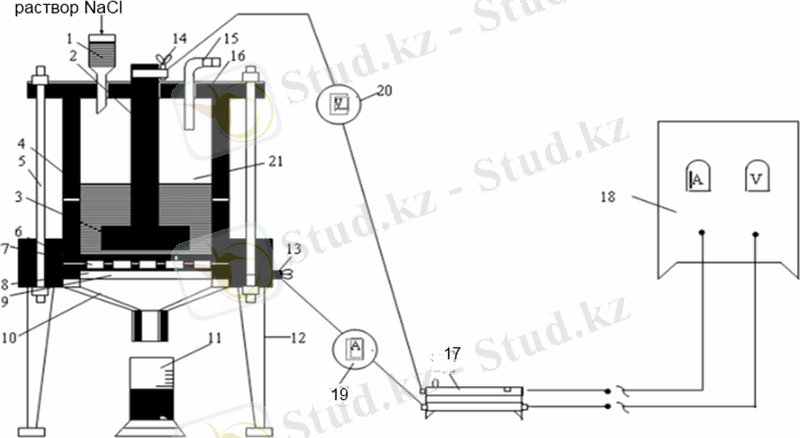
- үріңке; 2 - анод; 3 - графитті диск; 4 - қорап; 5 - қысу желесі; 6 - резеңке тығыздағыш; 7 - асбест диафрагма; 8 - торлы темір катод; 9 - ток өткізгіш сақина; 10 - электролизердің түбі; 11 - өлшемі бар ыдыс; 12 - электролизер тіреуіштері; 13, 14 - катодты және анодты токөткізгіштер; 15 - шыны түтікше; 16 - қақпақша; 17 - реостат; 18 - айнымалы токты түзеткіш; 19 - амперметр; 20 - вольтметр.
1. 1 сурет - Мерзімді жұмыс істейтін электролизердің қондырғысы.
Есептеулер нәтижелері бойынша процестің көрсеткіштерінің электролиз уақытына және католиттегі NaOH-ң құрамына тәуелділігін анықтайды. Зерттеулік жұмыстарды жүргізу барысында ас тұзы ерітіндісінің концентрациясының ток бойынша шығым мен электр энергиясын қолдану дәрежесіне әсерін зерттейді және электролиз процесінің тиімді технологиялық ережесі бойынша қорытынды жасайды.
Қауіпсіздік техникасы
1. Қондырғыны міндетті түрде жұмыс істеп тұрған сорғыш шкафтың ішінде жинау керек.
2. Оқытушымен бірге қондырғының жиналу дұрыстығын тексеру керек.
3. Жұмыс алдында сорғыш шкафты іске қосу керек.
4. Қондырғыны тек қана лаборанттың қатысуымен және реостат толық жұмыстан шығарылған кезде қосу керек.
- Электролиз кезінде электролизерге еңкейіп қарауға және газдың
шығып жатқанын иіскеп тексеруге болмайды. Себебі реакция нәтижесінде бөлінген хлор және т. б. газдардан адам уланып қалуы мүмкін.
- Катодтық кеңістікте сутегінің бөлінуіне байланысты, қондырғыны
отқа (шырақ, электр плиткасы және т. б. ) жақын орналастыруға қатаң тыйым салынады.
6 Бақылау сұрақтары
1. Электролиз туралы түсінік. . Фарадейдің 1-ші және 2-ші заңдары. Электрохимиялық эквивалент.
2. Электрохимиялық процестердің негізгі технологиялық көрсеткіштері.
3. Ас тұзы ерітіндісінің электролизіндегі катодты және анодты процестер.
4. Қатты темір катодты және сүзгіш диафрагмалы электролизердің жұмыс істеу принципі.
5. Технологиялық ереже параметрлерінің электролиз процесінің негізгі
көрсеткіштеріне әсері.
6. Электролиз процесінің технологиялық ережесінің тиімді параметрлерін таңдау.
7. Электрохимиялық процестердің химиялық процестермен салыстырғандағы артықшылықтары мен кемшіліктері.
№2 ЗЕРТХАНАЛЫҚ ЖҰМЫС
СОДА ЕРІТІНДІСІН КАУСТИФИКАЦИЯЛАУ
1. Жұмыс мақсаты:
- Сода ерітіндісін каустификациялау процесімен танысу
- Процестің параметрлерінің сода ерітіндісін каустификациялау дәрежесіне әсерін тәжірибе жүзінде және виртуалды зерттеу.
- Зертханалық жұмысты виртуалды ережеде компьютерлік бағдарлама бойынша орындау дағдыларын игеру.
2 Теориялық мәліметтер
2. 1 Каустік соданы химиялық әдіспен алу
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz