Тотығу-тотықсыздану реакциялары: жіктелуі және электрондық баланс әдісі


СӨЖ
Тақырыбы : Тотығу тотықсыздан реакциялары және жіктелу
Орындаған: Әліпбекова Балауса
Қабылдаған: Алынбекова Д
Группа 6В07214
Мазмұны- Кіріспе:
- 1Заттардың тотығу-тотықсыздану қасиеттерін анықтау
- 2Электрондық баланс әдісі
- 2. 1Электрондық баланс әдісін қолдану алгоритмі
- 2. 2Электрондық баланс әдісінің С. Дорожкин мен И. Сирота ұсынған нұсқасы
- 2. 3Электрондық баланс әдісінің кемшіліктері\
- Қолданылған әдебиеттер:
Кіріспе:
Тотығу-тотықсыздану реакциялары (ТТР) - реакцияға қатысушы заттардың құрамындағы элементтердің тотығу дәрежелерінің өзгеруімен жүретін реакциялар. [1]
18 ғасырдың аяғында А. Лавуазье жанудың оттекті теориясын ұсынған кезден бастап тотығу заттардың оттекпен қосылуы, ал тотықсыздану оттекті бөліп алу процестері деп қаралған. 1920 - 1930 ж. химияда электрондық түсініктің қалыптасуына байланысты оттек қа-тыспайтын реакциялардың да Тотығу-тотықсыздану реакциялар болатындығы анықталды. Тотығу-тотықсыздану реакциялар процестері көбінесе электрондық теңдеулермен өрнектеледі. Зарядтардың сақталу заңына қайшы келмес үшін Тотығу-тотықсыздану реакциялар кезінде тотықтырғыштың қосып алған электрондар саны тотықсыздандырғыштың берген электрондар санына тең болуы керек деген жалпы ереже сақталады. Тотығу-тотықсыздану реакцияларын коэффиценттер қойып теңестірудің екі әдісі бар: электрондық тепе-теңдік және электрон-ион. Электрондық тепе-теңдік әдісі бойынша берілген және қосып алған электрондар саны элементтердің реакцияға дейінгі және реакциядан кейінгі тотығу дәрежесінің негізінде анықталады.
Электрон-ион әдісі бойынша жалпы иондық реакцияларды құру ережесіне сәйкестеп реакция сұлбасын құ-рады. Күшті электролитті ион түрінде, бейэлектролит пен әлсіз электролиттерді, газдарды және тұнбаларды молекула күйінде жазады. Бұл әдіс реакция жүрген ортаның табиғатына байланысты. Себебі реакция бағытына орта күшті әсерін тигізеді. Мыс., +H2O⇔HCl−1+HO+1Cl болатын Тотығу-тотықсыздану реакцияларындағы тепе-теңдік қышқылдық ортада солға, ал негіздік ортада оңға ығысады. Күшті тотықтырғыш Mn+7 қышқылдық ортада Mn2+-ге дейін, сілтілік ортада Mn+6, бейтарап ортада Mn+4O2 молекуласына дейін тотықсызданады. Тотығу-тотықсыздану реакцияларының стехиометр. коэффицеттерін табудың бұлардан басқа А. Гарсиа, электронды баланс, матем. әдістері де бар. Химияда Тотығу-тотықсыздану реакциялар өте көп таралған. Мысалы, аммиак, азот қышқылы, күкірт қышқылын алу, электролиз (анодта электрхимиялық тотығу, катодта электрхим. тотықсыздану), жану процесі, металдар коррозиясы, фотосинтез, т. б. маңызды биологиялық құбылыстар Тотығу-тотықсыздану реакциялар процесіне жатады. Тотығу-тотықсыздану реакциялар өнеркәсіпте және техникада көміртек (ҚҚ, ҚV) оксидтерін, таза металл, т. б. алуда кеңінен қолданылады.
Заттардың тотығу-тотықсыздану қасиеттерін анықтауБіз күкірттің бірнеше қосылыстарын білеміз: күкіртті сутек H 2 S, күкірт қышқылы H 2 SО 4 , күкірт (VI) оксиді SО 3 , күкіртті қышқыл H 2 SО 3 , күкірт (IV) оксиді SО 2 . Міне, осы заттардың әрқайсысының тотығу-тотықсыздану реакцияларындағы атқарар рөлін тек олардың формулаларына қарап анықтауға болады. Ол үшін осы қосылыстардағы элементтердің тотығу дәрежелерін пайдалануға болады.
Көрсетілген қосылыстардағы күкірттің тотығу дәрежелері: - 2 (H 2 S), +4 (H 2 SО 3 , SO, ), +6 (H 2 SО 4 , SО 3 ) мәндерін көрсетеді, енді осы сандарды сан өсіне салып, тотығу дәрежелерінің өзгерулерін қарастыралық:
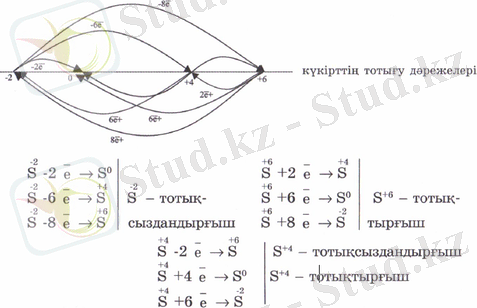
Элемент ең төменгі тотығу дәрежесінде тек тотықсыздандырғыш, ең жоғарғы тотығу дәрежесінде тек тотықтырғыш, ал аралық тотығу дәрежесінде болса әрі тотықтырғыш, әрі тотықсыздандырғыш болады.
Бөлшек (атом, молекула) электронды бергенде оның оң тотығу дәрежесі артса, қосқанда оң тотығу дәрежесі кеміп, теріс тотығу дәрежесінің абсолюттік мәні артады.
Элементтің электртерістілігі басым болса, оның тотықтырғыштық, ал төмен болса тотықсыздандырғыштық қасиеті жоғары болады.
Электрондық баланс әдісіЭлектрондық баланс әдісі бастапқы реагенттер мен соңғы өнімдердің құрамындағы элементтер атомдарының тотығу дәрежелерін салыстыруға негізделген.
NH 4 SCN + KMnO 4 + H 2 SO 4 → MnSO 4 + N 2 +CO 2 + K 2 SO 4 +H 2 O
Тотықсыздану : Mn +7 +5e → Mn +2 14
Тотығу : 2N -3 -6e → N 2 0 5
Тотығу : S -2 -8e → S +6 5
14 Mn +7 +10N -3 +5 S -2 → 14 Mn +2 +5 N 2 0 + 6 S +6 5NH 4 SCN+14KMnO 4 +16H 2 SO 4 →14MnSO 4 +5N 2 +5CO 2 +7K 2 SO 4 +26H 2 O
Электрондық баланс әдісін қолдану алгоритміТотығу-тотықсыздану реакцияларын электрондық баланс әдісімен теңестіргенде әдетте мынадай алгоритмді қолданады:
1. Реакцияның толық молекулалық теңдеуін (әрине, тәжірибелік мәліметгерге сүйеніп жазылған), яғни реагенттер мен өнімдердің формулаларын жазамыз.
Мысалы:
КМnО 4 +Н 2 SО 4 +Nа 2 SО 3 → МnSО 4 +Nа 2 S0 4 +К 2 SО 4 +Н 2 О
2. Реакция барысында өзінің тотығу дәрежелерін өзгертіп тұрған элементтерді табамыз:
+ 1+7 -2 +1+6-2 +1 +4-2 +2 +6-2 +1 +6-2 +1+6-2 +1-2 KMnO 4 + H 2 SO 4 + Nа 2 SО 3 → MnSO 4 + Na 2 SO 4 + K 2 SO 4 + H 2 O
Мұнда марганец (II) және калий сульфаттарының қүрамындағы күкірт атомдары күкірт қышқылы молекулаларынан келеді деп есептейміз. 3. Тотығу және тотықсыздану үрдістерінің сызбанұсқаларын жеке-жеке жазамыз:
Mn +7 → Мn +2 тотықсыздану үрдісі S +4 → S +6 тотығу үрдісі
4. Элементтердің тотығу дәрежелерінің өзгеруіне сүйене отырып, тотығу және тотықсыздану үрдістері кезінде берілген немесе қосып алынған электрондардың санын анықтаймыз:
Мn +7 + 5е → Мn +2 тотықсыздану үрдісі S +4 -2е → S +6 тотығу үрдісі
5. Тотықтырғыштың қосып алған электрондарының саны тотықсыздандырғыштың берген электрондарының саньна тең екендігін ескере отырып, электрондық баланс қүрамыз:
Mn +7 +5e → Mn +2 │2 S +4 -2е → S +6 │5
Ол үшін тотығу үрдісінің теңдеуінің әр мүшесін тотықтырғыштың қосып алған электрондар санына көбейтеміз, ал тотықсыздану үрдісінің теңдеуінің әр мүшесін тотықсыздандырғыштың беріп жіберген электрондар санына көбейтіп, реакцияға дейінгі және реакциядан кейінгі бөлшектерді жеке топтап жазамыз. Сонда реакцияның қысқаша иондық тендеуін аламыз:
2Мn +7 +5S +4 = 2Мn +2 +5S +6
6. Қысқаша иондық тендеудегі әр бөлшектің алдындағы коэффициентті толық молекулалық тендеудегі сол бөлшектерге сәйкес заттардың алдына апарып қоямыз:
2КМnО 4 +5Nа 2 SО 3 +3H 2 SO 4 = 2MnSO 4 +5Na 2 SO 4 + K 2 SO 4 +3H 2 O
7. Тотығу және тотықсыздану үрдістеріне тікелей қатынаспайтын элементтерді теңестіреміз. Ол үшін алдымен металл атомдарын, содан кейін қышқыл қалдықтарын, ең соңында сутека томдарын, оның алдында оттек атомдарын теңестірген ыңғайлы:
2КМnО 4 +5Nа 2 SО 3 +3H 2 SO 4 =2MnSO 4 +5Na 2 SO 4 + K 2 SO 4 +3H 2 O
Электрондық баланс әдісінің С. Дорожкин мен И. Сирота ұсынған нұсқасыОның негізгі идеясы мынада: тотықсыздандыргыштың құрамына кіретін элементтерді жай заттар ретінде қарастырады, ягни тотықсыздандырғыштың құрамына кіретін элементтердің тотығу дәрежелерін шартты түрде нөлге тең деп алады . Әрі қарай - кәдімгідей.
Мысалы :
1. Пиритті өртеу реакциясы:
FeS 2 + O 2 → Fe 2 O 3 +SO 2 ↑
Пиритті жай зат атомдарының қоспасы ретінде қарастырсақ:
FeS 2 = Fe 0 + 2S 0
Бұдан әрі теңестіруді кәдімгідей жалғастыруға болады:
Тотығу: Ғе° - 3е → Ғе +3 4
2S 0 -8е → 2S +4 4
Тотықсыздану: О 2 + 4 ё →2О -2 │11
4Ғе° + 8S°+ 11О 2 → 4Ғе +3 + 8S +4 + 22O -2 4
2O -2 атомдарын Ғе 2 О 3 және SО 2 молекулаларына бөліп жазып, молекулалық тендеуге көшсек:
4 FeS 2 + 11O 2 →2 Fe 2 O 3 +8SO 2
2 . +6 0 +4 +6 +1
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz