Әрекеттесуші массалар заңы мен гетерогенді процестердегі химиялық тепе-теңдік


№ 5 Лекция тақырыбы: Әрекеттесуші массалар заңы мен гетерогенді
процестердегі тепе - теңдік
Лекцияны оқыту нәтижелері:
1. Сапалық анализдің теориялық негізін құрайтын әрекеттесуші массалар заңын тереңірек қарастырады
2. Гомогенді және гетерогенді жүйелерден заттың химиялық құрамын анықтаудың тәсілдері туралы білімді игереді;
3. Құрамы белгісіз затты анықтаудың тиімді жолдарын ұсынады;
Лекцияның мақсаты мен міндеттері: Химиялық талдауда әрекеттесуші массалар заңы көптеген әдістердің теориялық негізі түсіну; Бұл заңның көмегімен қайтымды химиялық реакцияларға қатысатын заттардың өзара сандық қатынасын, химиялық тепе-теңдігін анықтау.
Лекция мазмұны
Әрекеттесуші массалар заңын 1867 жылы норвегия ғалымдары К. Гульдберг пен П. Вааге ашқан. Бұл заң химияның фундаментальды заңдарының бірі: қарапайым гомогенді химиялық реакциялардың жылдамдығы реакцияға түсетін заттардың концентрацияларының көбейтіндісіне тура пропорционал.
Сапалық және сандық химиялық анализде қайтымды реакциялар кеңінен қолданылады, яғни бір мезгілде бір-біріне қарама-қарсы бағытталған екі реакция жүреді. Оларға тұндыру-еріту, нейтралдану-гидролиз, диссоциация-ассоциация, тотығу-тотықсыздану және тағы басқа реакциялар жатады.
Гетерогенді жүйелерге бірнеше фазадан (газ, сұйық, қатты зат) тұратын жүйелер жатады. Бұл жүйелер газ -сұйықтық, газ -қатты, сұйықтық - сұйықтық және сұйықтық - қатты болып бөлінеді. Химиялық және физика-химиялық процестер осы жүйелердің кез келгенінде өтеді. Егер ерітіндіде тұнба пайда болса, онда жүйе гетерогенді болады. Тұнбалардағы әрбір қатты зат жекеленген фаза болып табылады. Гетерогенді жүйелерде реакциялар фазалар бетінде жүреді.
Фаза аралық процестердің жүруі аналитикалық химия практикасында аса маңызды. Олар заттарды бір-бірінен бөлуде және анықтауда кеңінен қолданылады. Бұл кезде заттардың химиялық және физика-химиялық қасиеттеріндегі ерекшеліктері негізге алынады. Фаза аралық процестер тұнба түзілгенде, ерігенде, суалтқанда, заттарды айдағанда, зат бір сұйық фазадан келесі фазаға өткенде, тұнба бетіне бөгде заттардың адсорбциясы кезінде, сондай-ақ экстракция процесі кезінде туындайды.
Фазалар арасында жүретін процестердің жылдамдығы фазалардың жанасқан сәтінде жоғары болады да, уақыт өте біртіндеп төмендеп, тұрақты мәнге жақындайды. Процестің осы кездегі жылдамдығы фаза аралық химиялық тепе-теңдік константасымен сипатталады.
Аналитикалық химияда катиондар мен аниондарды анықтауда, оларды жекеленген топтарға бөлуде екі фазадан тұратын «сұйықтық-қатты зат» жүйесі жиі пайдаланылады. Мұндай жүйеде ерітінді мен тұнба бір-бірімен жанасқанда тұнба ери бастайды. Мысалы SrSO 4 тұнбасын суда еріту процесі кезінде тұздың кристалдары судың дипольдық молекулаларына тартыла бастайды. Sr 2+ және SO 4 2- иондары кристалл бетінен гидратталған иондар түрінде біртіндеп үзіліп, ерітіндіге өтеді. Ерітіндіде жинақталған гидратталған иондардың мөлшеріне қарай олардың соқтығысулары орын алады. Қатты фаза (SrSO 4 ) кристалдарының бетіне соғылған гидратты иондар кристалдық тордың қарсы зарядты иондарымен тартылысып, нәтижесінде дегидратацияланады. Заттың осылайша біртіндеп еруінен ерітіндіде оның артық мөлшері пайда болады. Еріген заттың артық мөлшері тұнбаға қайта түсе бастайды.
Еру және тұну процестерінің нәтижесінде тұнба мен оның еріген бөлігі арасында динамикалық тепе-теңдік орнайды:
SrSO 4 ↔︎ Sr 2+ + SO 4 2-
тұнба ерітінді
Динамикалық тепе-теңдік кезінде тұнбаның еру жылдамдығы оның тұну жылдамдығымен теңеседі.
Барлық нашар еритін қосылыстар аз да болса суда ериді. Мысалы, іс жүзінде мүлдем ерімейді деп саналатын BaSO 4 , SrSO 4 , AgCl, CaC 2 O 4 және т. б. тұнбалар өте аз мөлшерде болса да ериді. Олардың ерітіндіге өткен молекулалары электролиттік диссоциацияға ұшырайды.
Қаныққан сулы ерітінділерде (тепе-теңдік жағдайдағы жүйелер) орын алған электролиттік диссоциация процесі қайтымды болып табылады. Мұндай жүйелерге әрекеттесуші массалар заңын қолдануға болады. Еру жылдамдығы мен тұздың қайта кристалдану жылдамдығы арасында тепе-теңдік орнаған кезде ерітінді аса қаныққан күйге өтеді. Тұнбасы бар қаныққан ерітіндіде тепе-теңдік қатты заттар мен олардың ерітіндідегі осы заттың молекулалары арасында орнайды. Электролиттерде бұл процесс тұнбаның кристалдары мен иондары арасында өтеді.
Тұндыру процесі. Химиялық реакциялардың негізгі бір аналитикалық белгісі тұнбалардың пайда болуы. Тұнба алу реакциялары заттарды бөлуге пайдаланылады. Тұнба түсу процесін сандық жолмен сипаттауға болады: тұнбаның массасын анықтау - гравиметриялық анализ немесе анықталатын затты түгел тұнбаға түсіруге кеткен стандартты реактивтің көлемін анықтау - титриметриялық анализ. Осының бәрі тұнба алу реакцияларын заттарды ашуға, анықтауға және бөлуге мүмкіндік береді.Тұнба түзілгенде екі фазалы «ерітінді - тұнба» жүйесі пайда болады. Тұндыру процесінің негізгі заңдылықтары негізінен, кристалдық торы иондардан тұратын нашар еритін электролиттерге арналып қорытылған. Мұндай жүйедегі тепе-тендікке
еру
МА ↔︎ М n+ + А n-
тұну қанаққан ерітіндідегі иондар
Әрекеттесуші массалар заңын қолдансақ, онда
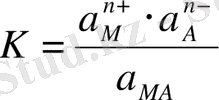
Қатты фазаның активтілігін а=1 тең деп есептесек: K . а МА =EK Т = а М n+ . а А n- .
Тұну және еру жылдамдықтары теңескенде нашар еритін электролиттің қаныққан ерітіндісіндегі иондардың концентрацияларының (активтіліктерінің) көбейтіндісі белгілі температура мен қысымда тұрақты мән. Бұл константаны ерігіштік көбейтіндісі деп атайды.
Гетерогенді тұнба түзілу және еру тепе-тендігінің константасы ЕК мәнін пайдаланып, тұнбаның түзілу процесін басқаруға болады. Нашар еритін күшті электролит тұнбаларының түзілу жағдайларын қарастырайық. Ол үшін алдымен BaSO 4 тұнбасының сулы ортада түзілу мысалын алайық.
BaSO 4 -ның таза судағы ерігіштік көбейтіндісі:
T=const кезінде EK BaSO 4 =[ Ва 2+ ] [ SO 4 2- ] = const
Таза судағы барий сульфатының ерітіндісінде Ва 2+ иондары мен SO 4 2- иондарының концентрациялары өзара тең [Ва 2+ ] = [SO 4 2- ] =C.
[Ва 2+ ] [SO 4 2- ] = C - иондар көбейтіндісі деп аталады. Барий сульфатының қанықпаған ерітіндісінде [Ва 2+ ] және [SO 4 2- ] иондарының концентрациялары оның қанық ерітіндісімен салыстарғанда біршама төмен, сондықтан иондық көбейтінді ерігіштік көбейтіндісінен аз болады.
Сонымен, барий сульфаты тұнбасының ерітіндіден түзілу жағдайы үшін [Ва 2+ ] [SO 4 2- ] > ЕК ВаSO4, яғни иондық көбейтіндісі ерігіштік көбейтіндісінен артық болуы керек.
Тұнбаның түзілуі үшін ерітіндідегі тұнба түзуге қатысатын иондардың концентрацияларының көбейтіндісі (ИК) ерігіштік көбейтіндісінен (ЕК) көп болуы керек. Бұл жағдайда ерітінді аса қанаққан күйде болады да, ал тұнба аса қанаққан ерітіндіден қанаққан ерітінді пайда болғанша түседі, яғни ИК=ЕК теңескенше. Тепе-тендік орнағаннан кейін тұнбаның пайда болуы тоқтайды. Сондықтан тұнбаның толық түсуі артады. Тәжірибеде тұндырғыштың 1, 5 есе артық мөлшері алынады, ал одан артық мөлшер, керісінше тұнбаның ерігіштігін арттыруы мүмкін. Себебі тұздық эффект және конкурентті комплекс түзілу реакциялары орын алуы мүмкін.
Көрсетілген себептер концентрациялық ерігіштік көбейтіндісінің термодинамикалық ерігіштік көбейтіндісіне қарағанда артуына (ЕК К > ЕК Т ), соған байланысты тепе-тендіктің тұнба еру жағына ығысуына әкеледі.
Ерігіштік көбейтіндісі (ЕК) - бұл тұнба үстіндегі ерітіндідегі иондардың концентрацияларының (активтілігінің) көбейтіндісін білдіреді. Мысалы, Cu 2 S үшін ЕК = [Cu + ] 2. [S 2- ] .
ЕК мәні тұнбаның еру қасиетін сипаттайды. Нашар еритін (тұнбаның) электролиттің қаныққан ерітіндісінде жекеленген иондардың концентрациясы қаншалықты өзгергенімен, олардың көбейтіндісі тұрақты температурада өзгеріссіз сақталатын шама.
Тұнбалардың түзілуі берілген температурада иондардың концентрацияларының (активтілігінің) көбейтіндісі тұнбаға түсетін қосылыстың ерігіштік көбейтіндісінің шамасынан артық болған жағдайда ғана жүзеге асады: [Ba 2+ ] [SO 4 2- ] > EK.
ЕК теңдеуінен заттың ерігіштігін есептеуге арналған формуланы қорытуға болады. Ерігіштік (S) деп заттың еріткішпен гомогенді жүйе түзу қабілетін айтады. Ерігіштік (S) г/см 3 , г/100 см 3 , моль/дм 3 арқылы өлшенеді. Тұнбалардың ерігіштігі - маңызды шамалардың бірі, ол арқылы заттың қаныққан ерітіндідегі концентрациясын есептеуге немесе оның берілген концентрациясында тұнбаның түзілу мүмкіндігін анықтауға болады.
- АВ типті формулаға жауап беретін тұнбалардың ерігіштігін (S) және ерігіштік көбейтіндісінің (ЕК) мәнін есептеуді қарастырайық.
[AB] = [A] = [B]
ЕК теңдеуіндегі [A] және [B] концентрацияларының орнына [AB] молеуласының концентрация мәнін қояйық, ол тұнбаның ерігіштігіне (S АВ ) тең:
ЕК АВ = S AB . S AB = S 2 AB . Осыдан
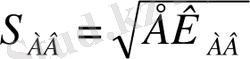
- Әртүрлі зарядты иондардан түзілген электролит тұнбасы үшін
A m B n ↔︎ mA + nB
жоғарыдағыға ұқсас етіп формула қорытамыз:
EK = [A]
m
[B]
n
;
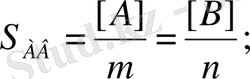 [A] = mS
AB
; [B] = nS
AB
;
[A] = mS
AB
; [B] = nS
AB
;
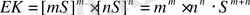
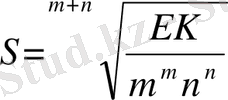
Мысалы, Ag 2 CrO 4 тұнбасы үшін (EK = 1, 44 . 10 -12 ; m = 2; n = 1) ерігіштігін есептейік:
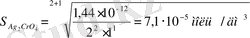
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz