Химиялық тепе-теңдік пен кинетика: Ле-Шателье ұстанымы, тепе-теңдік константасы және реакция жылдамдығы


Қазақстан Республикасының білім және ғылым министірлігі
Атырау мұнай және газ институты

Реферат
Тақырыбы:Химиялық тепе-теңдік
Қабылдаған: доцент Қалауова А. С
Орындаған: НГД 12-2 Баташев Дастан
Атырау 2012ж.
Жоспар:
1) Ле - Шателье ұстанымы
2) Тепе-теңдік константасы, тура және кері реакциялар
3) Гиббс-Гельмгольц теңдеуі
4) Химиялық реакцияның жалдамдығы
5) Реакция жылдамдығының реагенттер концентрациясына тәуелділігі
Химиялық тепе -теңдік. Химиялық тепе -теңдіктің ығысуын Ле - Шателье ұстанымына сүйене отырып, мысалдар келтіріп түсіндіріледі: 1) температура; 2) қысым; 3) әрекеттесуші заттармен реакция өнімдерінің концентрациясы.
2CO +O 2 = 2CO 2 ; ∆H = -566, 4 кДж
Химиялық тепе -теңдік. Тура және кері реакциялардың жылдамдығын теңескен жүйе күйін химиялық тепе -теңдік деп аталады.
Химиялық тепе- теңдік Ле Шателье ұстаныма сәйкес ығысады. Ле -Шателье ұстанымы : химиялық тепе -теңдікте тұрған жүйе күйіне сыртқы факторлардың біреуімен( қысым, температура, концентрация ) әсер етсек, тепе - теңдік сол факторды әлсірету бағытына қарай ығысады.
1) температура химиялық реакцияның жылу эффектісіне қарай әсер етеді. Температураны төмендеткенде химиялық тепе -теңдік экзотермиялық реакция бағытына қарай ығысады, ал температураны жоғарылатқанда эндотермиялық реакция бағытына ығысады. Бізге берілген реакция экзотермиялық болғандықтан тура реакция бағыты үшін температураны төмендету керек. Ал кері реакция бағыты үшін температураны жоғарылату қажет.
2) Қысым. Газ тәрізді заттардың арасында жүретін реакцияларды реакция нәтижесінде газдардың көлемдерінің өзгеруіне байланысты әсер етеді. Берілген реакция үшін реакцияға дейін 3 көлем(3 моль) , ал реакциядан кейін 2 көлем(2моль) қысымды арттырғанда тепе -теңдік газ көлемдерінің азаю жағына қарай, яғни оңға қарай ығысады және керісінше ;
3) Концентрация. Әрекеттесуші заттардың концентрациясын арттыру немесе реакция өнімдерінің концентрациясын азайту тепе -теңдікті оңға қарай ығыстырады. берілген реакция үшін иіс газы мен оттегінің концентрацияларын арттырып, немесе көмірқышқыл газының концентрациясын кеміту реакцияның тепе- теңдігін оңға қарай ығыстырады.
Химиялық тепе-теңдік - бір немесе бірнеше қарама-қарсы жүретін қайтымды реакциялар жылдамдықтарының теңескен күйі. Қайтымды реакция аяғына дейін жүрмейді, ол басталғанда тура жүретін реакцияның жылдамдығы (v1) жоғары, кері реакция жылдамдығы (v2) баяу болады. Тура реакция жүрген сайын реакцияға алынған заттың концентрациясы азайып, v1
1
- жылдамдығы кемиді, керісінше, тіке реакциядан пайда болған өнімнің концентрациясы артып, v2 күшейеді. Біртіндеп екі реакция жылдамдығы теңеседі: v1=v2. Осындай жағдайды химиялық тепе-теңдік деп атайды. Тепе-теңдік орнағанмен қарама-қарсы бағытталған екі реакция да тоқтамай жүре береді. Егер сыртқы жағдай (қысым, концентрация, температура) өзгермесе реакция жылдамдықтары тең болып, химиялық тепе-теңдік орнаған қалпында қала береді, сондықтан оны жылжымалы немесе динамикалық тепе-теңдік деп те атайды. Реакцияласушы жүйенің бір тепе-теңдік күйден басқа басқа тепе-теңдік күйге ауысуын химиялық тепе-теңдіктің ығысуы дейді. Химиялық тепе-теңдік орнаған кездегі реакцияға қатысқан әр заттың концентрациясы тепе-теңдік концентрациясы деп аталады. Химиялық тепе-теңдікті сан жағынан сипаттайтын көрсеткіш тепе-теңдік константасы (тұрақтысы) (К) деп аталады: aA+bB=pP+qQ, мұндағы бас әріптер - заттардың формулалары, кіші әріптер - реакциядағы молекула сандарын көрсететін коэффициенттер. Тепе-теңдік константасы тура және кері реакциялардың жылдамдық константаларының (k1, k2) қатынасы деп те аталады: K=k1/k2. К - белгілі температурада тура реакция өнімдері мен реакциясы алынған заттардың мольдік көбейтінділерінің қатынасын көрсететін тұрақты шама. Тепе-теңдік константасының теңдеуі реакцияға қатысқан заттардың тепе-теңдік концентрацияларының бір-біріне тәуелділігін көрсетеді. Химиялық тепе-теңдікті зерттеудің теориялық және практикалық маңызы бар.
Химиялық тепе-теңдік сыртқы жағдайға тәуелді өзгеріп тұратын динамикалық құбылыс. Мысалы, температура өзгерсе, химиялық реакциялардын жылдамдығы артып не кеміп, тепе-теңдікке әсер етеді. Берілген тұрақты кысымдағы тепе-теңдік константасынын температураға қатысты функционалды тәуелділігін реакция изотермасын сипаттайтын және Гиббс-Гельмгольц теңдеулері негізінде анықтауға болады.
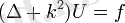
Әр түрлі температуралардағы тепе-тендікті есептеу үшін теңдеуді интегралдасақ, одан келесі өрнек шығады:
2
Қысқа аралықтағы температураларда мысалы, бірнеше ондаған градустар айналасында, реакциялардың жылу эффектілері температураға тәуелсіз болады, яғни Ср=0. Сондықтан:
LnKp=- (74)
мұндағы В - интегралдау тұрақтысы. Егер, берілген температурадағы энтальпия ( ) мен тепе-теңдік константасы (Кр) белгілі болса- онда Л-нің мәнін табу арқылы кез келген температурадағы тепе-теңдік константасын (Кр) табуға болады. (ДЯ және Кр бірдей қысымда, бірдей жағдайда болғаны абзал) . (74) теңдеуден тепе-теңдік константасының логарифмі мәнінің температураның керімәніне түзу сызықты функционалды тәуелді екенін көреміз. Осы түзудің абсциссаға көлбеу бұрышы энтальпияның универсалды газ тұрақтылығына қатынасын көрсетсе, сол түзудің ординатаны қиған бөлігі интегралдау тұрақтысы В-ЕЫ көрсетеді. Демек, реакциялардың химиялық тепе-теңдігін зерттеу тепе-теңдік кезіндегі концентрацияларды есептеп шығарумен қатар, осы реакциялардың энтальпиясы мен энтропиясын анықтауға мүмкіндік береді.
Реакцияның изобаралық және изохоралық теңдеуіне назар салсақ, одан эндо-термиялық реакциялардағы температура көтерілсе, тепе-теңдік константасы артатынын, яғни ДЯ>0 екенін көреміз. Осы негізде, мұндағы теңдеудің оң жақтағы бөлігі - оң шама, ал сол жақтағы бөлік те оң болу үшін, температура көтерілгенде оған сәйкес тепе-теңдік константасы (Кр) жоғарылауы керек. Ал реакциялар эндо-термиялық болса, энталышя нөлден кіші (ДЯ<0), температура төмендегенде Кр жоғарылайды. Жоғары температурада термия-лық реакциялар аяғына дейін жүреді, ал изотермиялық реакция-лар төменгі температурада аяғына дейін жүреді.
Егер системада химиялық реакция жүретін болса, онда осы систем-аның тепе-теңдік шартын анықтау керек. Мысалы, система-ға қоршаған орта әсер етті делік, ондайда реакциянын, жүру жолын сипаттап, тепе-теңдікке қандай фактордың қалай ықпал еткенін білу керек.
Қайтымды реакциялардың ешқайсысы ешқашан да соңына де-йін жүрмейтінін өмірдегі тәжірибелер көрсетіп келеді. Өйткені олар бірден
3
қатарынан екі бағытта жүреді, осы екі реакцияның жылдамдығы өзара теңелгенде ғана тепе-теңдік орнайды. Сондай-ақ тепе-теңдікке термодинамикалық факторлар, көлем, қысым, концентрация және температура әсер етеді.
Системадағы тепе-теңдіктің қандай бағытта, қалай ығысаты-нын көрсететін тепе-теңдік ережесі және ығысу ережесі бар. Бұл ережелер тепе-теңдіктің ығысуындагы Ле-Шателье принципі делі-неді. Егер тепе-теңдіктегі системаға сыртқы жағдай әсер еткенде қысым, көлем, концентрация, температура өзгсретін болса, реак-ция осы өзгеріске себепкер болған факторларды төмендету бағы-тында журеді, яғни системадағы тепе-теңдік сыртқы жағдайдың әсерін әлсіретуге бағытталады. Сыртқы жағдайдьщ әсерін, мыса-лы, концентрация әсерін қарастырайық.
1. СО (г) +Н20 -С02 (г) +Н2 (г)
Осы заттардың концентрацияларын арттырып көрелік. Бұл кезде оңға қарай жүретін тура реакцияның жылдамдығы артады және бұған сәйкес солға карай жүретін кері реакцияның жылдамдығы азаяды. Егер реагенттердің концентрацияларын көбейтсе, оларға тең не сәйкес үлесте реакция өнімі артады. Мұндайда реакцияньщ тепе-теңдік константасы өзгеріссіз калады, демек реакция өнші артқанмен тепе-теңдік ыгысуы байқалмайды. Бүл болмау үшін ре-акция өнімдерінің біреуін ортадан үнемі алып отыру қажет. Ол үшін реакция өнімінің бірін не шөгінді, не газ, не өзге қосылыс-тармен әрекеттестіру арқылы реакция жүріп жатқан ортадан бас-қа жаққа әкетіп отырады:
СО2 + СаО->СаСОз
немесе
2NaOH+CO2-NaCO3+HO
Бұл келтірілген екі реакцияда да көміртек (IV) оксиді реакция ортасынан
4
толығымен не жартылай кетеді. Әрине, мұның салдарынан екі реакция да оңға қарай жақсы жүріп, солға карай на-шар, кейде мүлдем жүрмейді. Сондықтан мұндағы тепе-теңдік оңға ығысады. Бұл реакция ортасынан кальций карбонаты нашар не тіпті ерімейтін шөгінді түзіліп, шығып қалады. Ал, реакцияға түсетін реагенттердің концентрациясын азайту нәтижесінде химиялық тепе-теңдікті оңнан солға қарай ығыстыруға болады.
2. Енді қысым әсерін көрейік. Ол үшін газ түріндегі біркелкі, яғни гомогенді система қажет. Оған азот пен сутектің әрекеттесіп, аммиак түзілетін реакция (1) мысал болады. Оған қосымша NН4С1 ыдырауын (2) да алайық.
Қысым көбейсе газ сығылып, көлемі кемиді. Мұндайда тепе-теңдік солдан оңға қарай ығысады. Ал қысым кемігенде, химия-лық тепе-теңдік оңнан солға қарай ығысады (1) . Ал ыдырау ре-акциясында (2) тепе-теңдік солдан оңға қарай ығысуы үшін қы-сымды азайту, ал ол кері болу үшін қысымды көбейту қажет.
3. Температураның реакцияға әсері жайлы өте көп айтылған. Экзотермиялық реакциялардың температурасын жоғарылат-қанда қосымша жылу жинақталады, сондықтан да мұндай реак-циялар оңнан солға қарай жүреді. Мұндай реакциядағы тепе-теңдікті, кері, яғни солдан оңға қарай бағыттау үшін бөлінген жылуды әрдайым бөліп әкету керек. Егер системаға жылу берілсе, онда реакциялық қоспаның температурасы жоғарылайды. Мұндайда реакция эндотермиялық болады және химиялық тепе-теңдік солдан оңға қарай ығысады.
Химиялық реакцияның жылдамдығы.
Химиялық реакцияны термодинамикалық тұрғыдан жүргізу мүмкіндігі негізгі тірек болса да ол әлі де жеткіліксіз жағдайдың бірі. Сондықтан химиялық реакциялардың жүру заңдылықтарын зерттеудегі екінші кезең сол, ол химиялық реакцияның жылдамдығы мен механизимін қарастыру, қазіргі теориялық ілім тұрғысынан зерделеу, ал бұлар химиялық кинетиканың негізгі міндеті. Теориялық зерттеу үшін де, іс жүзінде қолданбалық міндетті шешу үшінде химиялық тепе-теңдік пен кинетикалық зерделеудің маңызы үлкен. Әртүрлі температуралар мен қысымдар тұсындағы тепе-теңдіктің жағдайы мен шартын анықтай отырып, соңғы өнімнің ең көп шығатын жағдайы үшін қажетті шартқа жетуге, оны таңдап алуға болады.
Химиялық реакциялардың негізгі мәні әрекеттесуші заттардағы
5
байланыстарды ажырату және реакция өнімдерінде жаңа байланыстарды түзу. Мұндайда реакцияға дейінгі және реакциядан кейінгі әрбір элементтің атом сандары тұрақты қалады. Байланыстардың түзілуі энергияның бөлінуімен, ал байланыстардың үзілуі энергияның жұтылуымен жүретін болғандықтан химиялық реакциялар энергетикалық құбылыстармен қатар жүреді.
Реакциялар гомогенді және гетерогенді бола алады. Химиялық реакциялардың жылдамдығы v бірлік көлеміндегі немесе фаза аралық бірлік бетіндегі бірлік өлшем уақытындағы әрекеттесуші заттар концентрацияларының өзгеруімен анықталады. Реакция жалдамдығы моль\м немесе моль\л өлшем бірлігінде өлшенеді.
Реакциялардың лездік жылдамдығын сызба арқылы да анықтауға болады, ол үшін сәйкесті уақытты көрсететін жылдамдық қисығындағы нүктеге жанама түзу жүргізіп, тангенстік бұрышын пайдаланады.
Реакция жылдамдығы әрекеттесуші заттардың табиғатына, реагенттер концентрациясына, температураға, катализаторға, сыртқы әсерге тәуелді.
Реакция жылдамдығына әрекеттесуші заттар табиғатының әсері сол, ол бір заттың бірдей жағдайда әртүрлі заттармен түрліше әрекеттесуімен өрнектеледі, яғни жылдамдықтары әртүрлі. Мысалы:
-қалыпты температурада өте тез жүріп, кейде қопарылыспен де аяқталады
H+F>2HF
-қалыпты температурада, тіпті қыздырса да баяу жүретін реакциялар
H+Br>2HBr
-жүрмейтін реакцилар
CuO+HO>
Реакция жылдамдығының реагенттер концентрациясына тәуелділігі.
Реакция жүру үшін әрекеттесуші бөлшектердің қақтығысуы керек. Тұрақты бір температура кезінде реагенттердің концентрациясы өскен сайын
6
қақтығысу саны да артады. Ендеше, бұған орай әрекеттесуші заттардың концентрациясы өскенде реакция жылдамдығы да жоғарлайды.
1867 жылы К. Гульдберг және П. Вааге реакция жылдамдығының әрекеттесуші заттар концентрациясын анықтайтын әрекеттесуші массалар заңын тұжырымдады:берілген температурадағы химиялық реакцияның жылдамдығы реакция теңдеуіндегі стехиометриялық коэффициенттерге тең болатын көрсеткіш ережесіндегі әрекеттесуші заттар концентрацияларының көбейтіндісіне тура пропорционалды. Бұл химиялық кинетиканың негізгі заңы.
Берілегн nA+mB>AB реакциясы үшін бұл заң теңдеумен өрнектеледі:
V=k[A] [B]
Мұндағы [A] ; [B] -А мен В заттардың концентрациясы;
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz