Біратомды және көпатомды спирттер: құрылымы, физико-химиялық қасиеттері, реакциялары мен қолданылуы, метанолдың өнеркәсіптік синтезі


Алкогольдар спирттар.
Мазмұны
І Кіріспе
1. 1. Біратомды қаныққан спирттердің құрылысы.
1. 2. Алкогольдардың гомологтық қатары
1. 3. Алкоголдардың химиялық қасиеттері
1. 4. Алкоголдардың қолданылуы
ІІ Спирттер көмірсулардың туындылары
Метанолдың өнеркәсіптік синтезі.
2. 1. Спирттер мен көмірсутектер арасындағы генетикалық байланыс.
2. 2. Метанолдың өнеркәсіптік синтезі.
ІІІ Көпатомды спирттер
3. 1. Көпатомды спирттердің құрылысы және физикалық қасиеттер
3. 2. Көпатомды спирттердің химиялық қасиеттері
3. 3. Көпатомды спирттер алынуы және қолданылуы
ІV Қорытынды
Пайдаланылған әдебиеттер
- Біратомды қаныққан спирттердің құрылысы
Этил спиртінің құрылысы Бұл класс қосылыстарының құрылыс ерекшеліектерін олардың өкілі-этил мысалы бойынша анықтаймыз.
Этил спирті С 2 Н 6 О -өзіне тән иісі бар, түссіз сұйықтық, судан жеңіл 78, 3° С температурада қайнайды, суда жақси ериді және өзі көптеген бейорганикалық және органикалық заттарға еріткіш бола алады.
-Этил спиртінің молекулалық формуласын және оның құрамындағы элементтердің валенттіліктерін біле отырып, спирттің құрылысын бейнелеп көрейік. Оның екі түрлі құрылымдық формуласын жазуға болады:
Н Н Н Н
Н-С-О-С-Н (1) Н-С-С-О-Н (2)
Н Н Н Н
Осы екі формуланың қайсысы этил спирті молекуласының құрылысына сай келеді?
Формуланы салыстыра келіп, егер бұлардың біріншісін дұрыс көміртегі атомдарымен қосылысып, қасиеттері жағынан бірдей болатынын байқаған болар едік. Егер екінші формула дұрыс десек, онда молекуладағы сутегінің бір атомы көміртегі атомына оттегі арқылы қосылып, бұл сутегі атомының қасиеті басқаларынан өзгеше болатынын тәжірибе арқылы тексеруге де болады екен.
Спирт құйылған пробиркаға бір түйір натрии салайық. Газ бөліп шығара жүретін реакция бірден басталады. Бұдан бөлініп шығып жатқан газдың сутегі екенін анықтау қиын емес. Тағы бір қиынырақ тәжірибе жәрдемімен спирттің әр молекуласынан сутегінің неше атомы бөлініп шығатынын анықтауға болады. Ішінде натриидің ұсақ түйірі бар колбаға воронкадан тамшылатып белгілі мөлшерде, мысалы, 0, 1 (4, 6)
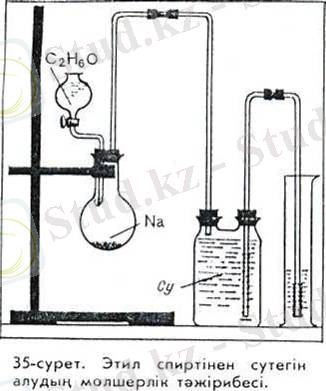
спирт құяйық. Спирттен бөлініп шыққан сутегі екі мойынды шөлмектегі суды цилиндрге ығыстырып шығарады. Цилиндрге ығысып шыққан судың көлеміне сәйкес келеді.
Бұл тәжірибе 0, 1 моль спирттен 1, 12 л (қалыпты жағдайға шағып есептегенде) сутегін алуға болатынын көрсетеді. Олай болса, натрии бір моль спирттен 11, 2 л, яғни, 0, 5 моль сутегін ығыстырып шығарады.
Демек, спирттің әрбір молекуласынан тарий бір атом сутегін ғана ығыстырып шығарады. Бұл фактіні формула түсіндіре алмайды, өйткені бұл формула бойынша молекуладағы сутегі атомдарының жағдайлары бірдей дәрежеде. Ал екінші формула молекуладағы сутегі атомдарының біреуі өзгелерінен басқаша жағдайда екенін сипаттайды: ол көміртегі атомына оттегі арқылы қосылады; бұдан сутегінің осы атомы берік байланыс түзе алмайды деген қорытынды шығады. Оны натрии оңай ығыстырады. Демек жоғарыда келтірілген формуланың екіншісі этил спиртінің құрылым формуласы бола алады.
Спирттің молекуласында көмірсутек радикалымен байланысқан гидроксил тобы-ОН (гидроксотоп) бар екенін нақтылы көрсету үшін этил спиртінің молекулалық формуласын көбінесе былай жазады:
СН 3 -СН 2 -Он немесе С 2 Н 5 ОН
Спирт молекуласындағы оттегі арқылы көмірсутек радикалына жалғасқан сутегі атомының ерекше қасиетті болуы неліктен екен деген сұрақ туады. Сірә, біз мұнда тағы да атомдардың бір-біріне әсер ету құбылысына кездесіп отырсақ керек. Бұл әсердің мәнін түсіну үшін молекуланың электрондық құрылысын қарастырайық.
С-С және С-Н байланыстардың сипаты бізге бұрыннан жақсы таныс-бұлар ковалентті байланыстар. Оттегі атомы сутегі атомымен де, көміртегі радикалымен де осындай байланыстар түзеді, мұнда оттегі атомының сыртқы электрондық қабаты октетке тейін толығады. Мұндай жағдайда спирт формуласын былай бейнелеуге болады:
Н Н
Н:С:С:О:Н
Н Н
Бірақ спирт молекласындағы электрондық тығыздықтың орналасуы көмірсутегідей біркелкі емес. О-Н байланысы полюстенген өйткені терісэлектрлігі басымырақ оттегі атомына қарай ығысады. Сутегі атомы электрондардан босаңқырап молекуламен нашар байланысқан тәрізденеді, сондықтан оны натрии жеңіл ығыстырып шығарады. Электрондық тығыздықтың ығысуын формулада былай көрсетуге болады:
Н Н
Н-С-С-О -б -Н +б
Н Н
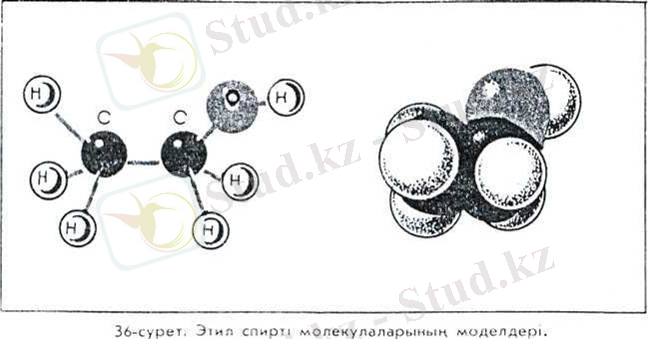
Спирттің молекуласындағы атомдардың кеңістікте орналасу моделі 36 суретте бейнеленген. Бұдан оттегі атомының басқа атомдармен ковалентті байланысы түзу сызық бойымен емес, бір-біріне бұрыш жасап түзілетінін көреміз. Оның себебі, оттегі атомының сыртқы электрондық қабатында жұптасқан тағы екі электрон бар. Осы электрондық бұлттардың осьтері өзара перпендикуляр орналасады. Оттегі атомының басқа атомдармен ковалентті байланыстарын сол осьтердің бағытында түзіледі. Дұрысында тибридтеу және басқа да факторлар әрекеті салдарынан валенттік бұрыш тік қалпынан біраз ауытқиды. ) Су молекуласының да кеңістік құрылысы осындай екенін еске түсіріңдер.
1. 2. Спирттердің гемологтық қатары. Этил спирті гомологтық қатардың бір мүшесі. Қатардағы басқа спирттердің химиялық және электрондық құрылысы ұқсас болып келеді. Қатардағы бірінші мүше -метил спирті.
Этил спиртінің келесі ең жақын гомологы-пропил спирті:
Н
Н-С-О-Н
Н
Этил спиртінің келесі ең жақын гомологы-пропил спирті:
Н Н Н
Н-С-С-С-О-Н
Н Н Н
Спирттердің гомологтық қатары туралы мағлұматтар 3-кестеде берілген.
Гептил (гептанол-1)
және т. б.
Бұл қатарда молекулалар құрамының гомологтық айырмасы СН 2 атомдар тобы екеніне көз жеткізіңдер. Спирт молекуласында біреу ғана емес, екі және одан да көп гидроксил топтары болады.
Молекулада гидроксил топтарының болуы спирттердің химиялық қасиеттерін яғни олардың химиялық қызметін жүзеге асыратынын натрии реакциясы мысалынан көрдік және бұдан былай да көз жеткізетін боламыз. Атомдардың бұл тобы функционалдық топ деп аталады.
Молекулаларында көмірсутек радикалымен байланысқан бір немесе бірнеше фукнционалдық гидроксил топтары бар органикалық заттар спирттер деп аталады .
Сондықтан олар молекулаларында бір немесе бірнеше сутегі атомдарының орнын гидроксил тобы басқан көмірсутектердің туындылары ретінде қарастырылады. Жоғарыда келтірілген қатардағы спирттерді молекулаларындағы сутегінің бір атомының орнын гидроксил тобы басқан қаныққан көмірсутектердің туындылары деп есептеуге болады. Бұл біратомды қаныққан спирттердің гомологтық қатары. Бұл қатардағы заттардың жалпы формуласы
С п Н 2п-1 ОН немесе R-OH
Алдымен біратомды спирттерді оқып үйренуге кірісейік. Жүйелеу номенклатурасы бойынша спирттердің аттары өздеріне сәйкес көмірсутектер аттарынан алынып, көмірсутек атының аяғына -ол деген жұрнақ қосылады; гидроксил тобы жалғасқан көміртегі атомы цифрмен көрсетіледі. Көміртегі атомдары функционалдық топ орналасқан тізбек шетінен бастап нөмірленеді.
Спирттер изметриясы бір жағынан көміртек қаңқаның изомериясына, екінші жағынан молекуладағы гидроксил тобының қалай орналасуына қарай айқындалады. Бұл мәселені бутил спирті мысалымен қарастырайық.
Көміртегі қаңқасының құрылысына байланысты екі спирт изомері-бутан мен изобутанның туындылары болады:
4 3 2 1
СН 3 -СН 2 -СН 2 -СН 2 -ОН
Бутанол -немесе
и бутил спирті
СН 3
3 2 1
СН 3 -СН-СН 2 -ОН
2-Метилипропинал-1
немесе изобутил спирті
Әр көміртектің қаңқада гидроксил тобының орналасуына байланысты, спирттің тағы да изомері болуы мүмкін:
1 2 3 4
СН 3 -СН-СН 2 -СН 3
ОН (бутанол)
1 СН 3
Н 3 С-С-СН 3
ОН
2-Метилипропанил-2
Молекулалар арасындағы сутектік байланыс. Спирттердің физикалық қасиеттері. Қарастырылған қаныққан және қанықпаған көмірсутектерінен бұл гомологтық қатардың айырмасы газ тәрізді заттардың болмай, бірінші мүшесінің өзінде-ақ метил спирті-сұйықтықтың болуы бірден назар аудартады.
Заттардың қайнау температурасының осындай көтерілуін қалай түсіндіруге болады? Әлде молекула құрамында оттегі атомы кіргендіктен заттың молекулалық массасы тым арта ма екен? Бірақ метил спирттің молекулалық массасы 32, пропандікі-44 бола тұра метил спирті-сұйықтық, ал пропан газ Хлореметанның СнСІ молекулалық массасы одан да ауыр 50, 5 дегенмен ол газ тәрізді зат болып келеді.
Ал сонда өздігінен жеп-жеіл метил спиртінің молекулалары неліктен сұйық күйінде қалады?
Спирт молекулаларында көмірсутек радикалы мен сутегі атомы оттегі атомымен бір түзудің бойында жатпай, бір-бірімен бұрыш жасап орналасатын бұрыш айқындаған едік. Оттегі атомында әлі де бос электрон жұбы бар. Сол бос электрон жұбы арқылы оттегі атомы басқа молекула құрамындағы сутегі атомымен өзаракөпті оң зарядталады. Сөйтіп атомдар арасында сутектік байланыс пайда болады, ол формулаларда нүктелермен белгіленеді:
б+ б- б+ б+ б- б+
Н-ОН-ОН-О
СН 3 СН 3 СН 3
Сутектік байланыстың беріктігі әдеттегі ковалентті байланыстан едәуір нашар
Сутектік байланыс салдарынан спирт молекулалары бір-біріне жабыстырылған тәрізді ассоцияланады. Сондықтан осы байланыстарды үзіп, молекулалардың жекеленіп босауы үшін және заттың ұшқыш болуы үшін қосымша энергия жұмсауға тура келеді. Сәйкес көмірсутектермен салыстырғанда спирттердің қайнау температурасының жоғары болуы себебі міне осылай түсіндіріледі.
Молекулалық массасы онша үлкен болмаса да судың өте жоғары температурада қайнау себебін енді түсіну онша қиын емес
Спир пен су молекулалары арасында да сутектік байланыс түзіледі. Спирттер ерігіштігінің атап айтқанда, С-Н байланысында аз полючтенетіндіктен сумен сутектік байланыс түзе алмайтын және суда ерімейтін көмірсутектерден ерекшелігі міне осылай түсіндіріледі.
Алайда спирттер әр түрлі мөлшерде ериді. Стакандардағы көлемдері бірдей суға метил, этил, пропил, бутил және эимл спирттерінен бірдей мөлшерде құйып араластырса, алғашқы үш спирттің нашар ерігендігі байқалады: спирт молекуласында көмірсутек радикалы неғұрлым көп болса, гидроксил тобының мұндай молекуланы ерітіндіде сутектік байланыстың түзілуі есебінен ұстап қалуы соғұрлым қйындай түседі.
- Біратомды қаныққан спирттердің химиялық қасиеттері және оның қолданылуы
Химиялық қасиеттері спирт көміртегіне бай заттар; сондықтан тұтатқанда жылу шығара жанады, мысалы;
СНОН+3О2СО+3НО+1374 кДЖ
Алайда жанған кезде олардан айырмашылықтар байқалады. Кәрден табақшаға әр түрлі спирттерден 1 мл мөлшерінен құйып, сұйықтықты тұтатайық. Біз сонда қатардың бірінші мүшесі-спирттің оңай тұтанып, жарығы әзер байқалатын көгілдір жалынмен, ал молекулалық массасы ауыр спирттердің жарқыраған жалын шығара жанатын, сөйтіп, жанып болған соң табақшада қара дақ қалатынын байқаймыз. Осы құбылыстарды түсіндіріңдер.
Функционалдық ОН топтың болуына байланысты қасиеттердің бір этил спирті мен натрийдің өзара әрекеттесуі екені бізге бұрыннан мәлім:
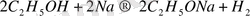
Этил спиртінде сутегінің орнын басуынан алынған өнім натрии этилаты деп а алады, ол реакциядан кейін қатты зат күйінде бөлініп шығады. Басқа ерімтал спирттер де сілтілік металдармен осылай әрекеттесіп, өзіне сай алкоголиттер түзеді. МИысал ретінде натрии пропилатының түзілу рекациясының теңдеуін байланысының иондарға ыдырауы арқылы жүреді:
б- б+ 2е
2С 2 Н 5 -О:/Н+2Na-H 2 -H+2Na+2{C 2 H 5 O:}
Біз спирттер осыған ұқсас реакцияларда протон түрінде сутегін бөлшектеп, қышқылдық қасиеттер көрсетеді дей алмаймыз. Алайда спирттер қышқылдар класына қосылмайды, өйткені олардың диссоциялану дәрежесі болар болмас, тіпті судыкінен де аз спирттердің ерітінділері индикаторлардың түсін өзгерпейді.
Сумен салыстырғанда спирттердің диссоциялану дәрежесінің төмен болуын көмірсутек радикалы әсерінен деп түсіндіруге болады: С-О байланыстағы электрондық тығыздықты оттегі атомына қарай радикалдың ығыстыруынан оттегінің бірен саран теріс заряды артып, соның салдарынан ол сутегі атомын берігірек ұстайтын болады.
Егер молекуласына химиялық байланыс электронын өзіне күштірек тартатын орынбасушы енгізсе, спирттердің диссоциялану дәрежесін арттыруға болады. Мәселен, этанолмен салыстырғанда 2-хлорэтанолдың СІСН 2 -СН 2 диссоциялану дәрежесі бірнеше есе артады. Оны былай түсіндіруге болады:
СІ-СН 2 -СН 2 -О-Н
Хлор атомы СІ-С байанысының электрондық тығыздығын өзіне қарай ығысытрады, ал көміртегі атомы осының салдарынан бірен саран оң зарядқа ие болып, оның есесін қайыру үшін С-С байланысының электрондық тығыздығы өз жағына қарай ығысады. Дәл осындай себептен С-О байланыстың электрондық тығыздығы біраз көміртегінің атомына өарай, ал О-Н байланысынікі сутегі атомынан оттегіне қарай ығысады. Осыдан барып сутегінің протон түрінде бөлініп шығу мүмкіндігі артып, соның салдарынан заттың диссоциялану дәрежесі жоғарылай түседі.
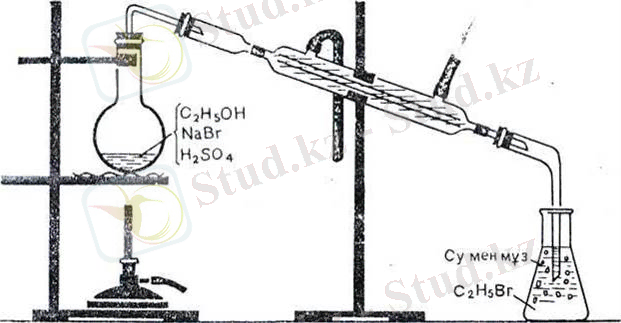
38-сурет Этил спиртінен бромэтан алу.
Спирттерде сутегінің гидроксил атомы ғана емес, барлық гидроксил тобы химиялық реакцияға кірісе алады. Салқындатқыш жалғасқан колбада этил спирті мен галогенсутек қышқылын, мысалы бромсутек қышқылымен қыздырсақ, біраздан соң қабылдағышта су астына жиналған ауыр сұйықтық бромэтанның жиналғанын байқауға болады:
С 2 Н 5 ОН+НBr-C 2 H 5 Br+H 2 O
Бұл реакцияда С-О ковалентті байланысының иондарға ажырауы арқылы жүреді, оны былай жазуға болады:
C 2 H 5 /:ОН+Н/:Br-C 2 H 5 Br+H 2 O
Бұл негіздер реакциясын еске түсіреді. Осыған ұқсас метил спирттен бромэтан түзіледі.
CH 3 OH++HBr-CH 3 Br+H 2 O
Катализатор ретінде концентрациялы күкіртқышқылын қосып қыздырса, спирт оңай дегидраттанады, яғни су бөлініп шығады. Мұнда этил спиртінен этилен түзіледі:
H H
H-C-C-H-CH 2 =CH 2 +H 2 O
H OH
Келесі гомологтардың дегидраттауынан басқа қанықпаған көмірсутектер алынады:
H H H
H-C-C-C-H-CH 3 -CH=CH 2 +H 2 O
H H OH
Пропилен
Жағдай біраз басқаша болғанда спирттердің дегидраттануы спирттің әрбір молекуласынан су молекуласының бөлінуі арқылы емес, екі молекуладан бөлініп шығу арқылы жүреді. Мәселен, этил спирті мен күкірт қышқылын аздап қыздырса диэтил -эфирі түзіледі:
С 2 Н 5 ОН+НОС 2 Н 5 -С 2 Н 5 -О-СН 3 +Н 2 О
Диэтил эфирі-ұшқыш, оңай тұтанатын сұйықтық еріткіш ретінде және медицина наркоз үшін қолданылады. Ол молекуласы бір-бірімен оттегі арқылы қосылған екі көмірсутек радикалдарынан тұратын органикалық заттарға-жай эфирлер класына жатады. Жай эфирлердің жалпы формуласы:R-O-R
Басқа жай эфирлер этил спирті гомологтарының молекулааралық дегидраттауынан алынады:
СН 3 О:Н+НО:СН 3 -СН 3 -О-СН 3 +Н 2 О
Егер осы тәрізді әр түрлі спирттер алынса, құрылысы симметриясыз эфирлер алынады:
СН 3 О:Н+НО:С 2 Н 5 -СН 3 -О-С 2 Н 5 +Н 2 О
Мұнда бұдан басқа да эфирлер түзе алады. Сол эфирлердің аттарын атап, реакция, теңдеулерін жазыңдар.
Біз этил спиртінің құрылысын анықтағанда димэтил эфиріне кездескен болатынбыз. Сонда СНО формуласына сай келетін екі құрылымынң спирттің қасиетін түсіндіре алатын біреуі іріктеліп, алынады. Екіншісі валенттілік дәрежесіне сай келіп, димэтил эфирінің құрылысын бейнелеп тұрса да формула ретінде қабылданбады. Бұл заттардың молекулалық формулалары бірдей, біреу ғана бола отырып, органикалық қосылыстардың әр түрлі кластарына жатса да олар изомерлер болып табылады. Сонымен, біратомды қаныққан спирттерге молекуласында көміртегі атомның дәл сондай саны бар жай эфирлер изомерлі болады дей аламыз. Сендер пропанолга эфирдің қайсысы изомер болады деп ойлайсыңдар?Спирттер организмге зиянды әсер етеді. Әсіресе метил спирті-күшті у. Ол тіпті аз мөлшерде ішкенің өзінде көз нервтері бүлініп, суқараңғы соқыр етеді. Спирттің 5-10 миллилитрінен организм қатты уланады, ал 30 миллиилитрінің өлтіріп те жіберуі мүмкінЭтил спирті-наркотик. Ол ерігіш болғандықтан ішкен кезде қанға тез сіңіп, организмге күшті әсер етеді. Спирттің әсерінен адамның ықыласы кеміп, байқампаздығы тежеледі, қимыл үлесімдігі бұзылып, мінез-құлқында әдепсіздік, желікпелік, дөрекілік пайда болады да соның бәрі оны жұртқа жеккөрінішті етіп көрсетеді. Ал алкогольді пайдалану салдары тіпті қауіпті, ондай адам ішімдікке дағдыланып алады да, мүлде салынып ақыр аяғында асқынып, алкоголизмнен ауырады. Спирт асқазан жолының кілегейлі қабықшасын зақымдап, қарында ұлтабаршында уыты жара, гастрит пайда болады. Бауырда спирт ыдырағанда оған күш түсіп, цирроз ауруына душар етеді. Спирт миға сіңіп, нерв клеткаларын уландырады, одан ақыл-ой, сөз ойлау қабілеті бұзылады да рухани халге ұшырайды, сөйтіп дел-сал болады.
Алкоголь әсіресе жас адамдар үшін өте қауіпті, өйткені өсіп келе жатқан организмде зат алмасу процесі қарқынды жүреді де улы әрекетті дереу сезінеді. Сондықтан ересектерге қараған да жастар арасында алкоголизм ауруы жиі-жиі байқалады. Жастар тіршілігінен спирт атаулының барлық түрлерін толық жою қажет.
1. 4. Спирттердің қолданылуы . Спирттер көптеген өндірістерде еріткіш ретінде қолданылады. Химиялық өнеркәсіпте оларды сан алуан синтездер үшін пайдаланады.
Метил спирті пластмасса, сірке қышқылы және басқа органикалық заттар өндірісінде пайдаланылатын формальдегид алуға өте көп мөлшерде жұмсалады. Қазіргі уақытта метил спиртін бастапқы өнім ретінде пайдалану негізінде көптеген жаңа технологиялық процестер жасалуда, сондықтан халық шаруашылығына қажетті заттар мен материалдардың өндіру өнеркәсібінде оның маңызы барған сайын арта беретін болады.
Метил мпиртін мотор отын ретінде пайдаланудың келешегі зор деп есептеледі, өйткені оны бензинге қосқанда жанғыш қоспаның оқтан саны артып, пайдаланылған газда зиянды заттардың түзілуін кемітеді.
Этил спирті синтетикалық каучук өндірісінде көп мөлшерде жұмсалады.
Спиртті тотықтырып, тағамға қажетті сірке қышқылын алады. Спиртті дегидраттану жолымен диэтил эфирін дайындайды, спиртті хлорсутекпен өзара әрекеттесуі арқылы операция жасалатын жерді жансыздандыруға пайдаланатын хлорэтан алады. Спирт көптеген дәрі дәрмектер жасауға да қолданылады. Ол парфюмерияда әтір және иіс сулар жасауға жұмсалады Оны кейбір елдерде жанармайдағы оқтан санын арттыру үшін мотор отынына қосады.
ІІ Спирттер-көмірсутектердің туындылары метанолдың өнеркәсіптік синтезі
2. 1. Спирттер мен көмірсутектер арасындағы генетикалық байланыс. Спирттерді көмірсутектерді гидроксильді туындылары ретінде қарастыруға болатынын жоғарыда байқадық. Оларды құрамында көміртегі мен сутегінен басқа оттегі де болатындықтан, жарым-жартылай тотыққан көмірсутектер ретінде де қарастыруға болады.
Көмірсутектердің молекуласындағы сутегі атомының орнына гидроксил тобын тікелей қою немесе оның молекула құрамына оттегі атомын тікелей енгізу едәуір қиын. Бұл көмірсутектің галоген туындылары арқылы оңай іске асырылады.
Мысалы, этаннан этил спиртін алу үшін әуелі бромэтан алуға болады:
С 2 Н 6 +Br 2 -C 2 H 5 Br+HBr
Сонан соң сілтілсі бар суды қосып, қыздыру арқылы бромэтанды спиртке айналдыру қажет:
C 2 H 5 Br+HOH-C 2 H 5 OH+HBr
Мұнан сілті осылайша метаннан бромсутегі нейтралдап, оның спиртпен реакцияласуына жол бермеу үшін, яғни химиялық тепе-теңдікті қажетті өнімнің түзілуі бағытына қарай жылжыту үшін керек.
Осы әдіспен метаннан метил спиртін де алуға болады:
CH 4 -CH 3 Br-CH 3 OH
Спирт алудың бұл әдісінің маңызы жоқ, ол тек лаборатория жағдайларында ғана қолданылады. Дегенмен бұл әдіс теориялық жағынан маңызды, өйткені ол көмірсутектердің көмірсутек галоген туындыларының және спирттердің араларында генетикалық тығыз байланыс бар екенін көрсетеді.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz