Титриметриялық анализ: әдістері, стандартты ерітінділер және есептеу қағидалары


ҚАЗАҚСТАН РЕСПУБЛИКАСЫНЫҢ БІЛІМ ЖӘНЕ ҒЫЛЫМ МИНИСТРЛІГІ
 Жәңгір хан атындағы Батыс Қазақстан аграрлық- техникалық университеті
Жәңгір хан атындағы Батыс Қазақстан аграрлық- техникалық университеті
«Химия және химиялық технологиялар» кафедрасы
Реферат
Тақырыбы: Титриметриялық анализ.
Орындаған:Туманова А. М Рх-21 топ студенті
Тексерген:аға оқытушы Алия Фрунзеевна8
Орал-2013
Жоспар
- Титриметриялық анализдің мәні.
- Титриметриялық талдау әдісінің жіктелуі.
- Титрленген ерітінділерді дайындау.
- Титриметриялық анализ нәтижелерін есептеу.
- Қышқылдық-негіздік тирлеудің мәні.
Титриметриялық анализ
Көлемдік анализ химиялық реакцияға кіріскен заттардың көлемдерін тікелей өлшеуге негізделген. Көлемдік анализді басқаша титриметриялық анализ дейді.
Титриметриялық анализде тирленген ерітінділер қолданылады. Концентрациясы өте дәл анықталатын ерітінділерді титрленген (қалыпты) ерітінділер, жұмыс ерітіндісі немесе титранттар деп аталады. Ерітіндінің бір куб сантиметріндегі (бір миллилитріндегі) еріген зат массасын титр дейді. Титрдің өлшемі г/см 3 (г/л) . Мысалы: калий гидроксиді ерітіндісінің титрі 0, 021 болса, ол бұл ерітіндінің әр миллилитрінде 0, 021г КОН бар екенін көрсетеді.
Титрант ерітіндісін анықталатын зат ерітіндісіне біртіндеп қосу процесін титрлеу дейді.
Титрлеу кезінде әрекеттесетін реактивтердің артық мөлшерлері емес, бір-біріне эквивалент мөлшерін анықтайды. Осы кезде әрекеттесу процесі химиялық реакция теңдеуіне сәйкес болады. Сонымен, титрлеу арқылы химиялық реакцияның аяқталған кезені, басқаша айтқанда, эквивалент нүктесін анықтайды. Эквивалент нүктені, әдетте, индикаторлар түсінің өзгеруі, немесе электр өткізгіштік өлшеу және басқа да әдістер көмегімен анықталады. Эквивалент нүктесін тапқан соң титрлеуді тоқтатады. Реакцияға кеткен титранттың көлемі мен концентрациясы бойынша анықталатын заттың мөлшерін есептейді.
Титрленген ерітінділер әр түрлі тәсілдермен даярлануы мүмкін. Осыған орай титрленген ерітінділерді стандартты (даярланған) және стандартталған (анықталған) деп екіге бөледі.
Стандартты ерітінділер. Оларға көтеген тұздар (натрий тетрабораты, натрий оксалаты, натрий хлориді, калий дихроматы), қымыздық қышқылы т. б. жатады. Оны даярлау үшін дәл өлшеніп алынған затты өлшеуіш колбаға салып ерітіп, суды белгіге жеткізеді. Еріген зат массасы (m, г) және өлшеуіш колбаға көлемі (V) бойынша ерітінді титрін Т есептейді:
Т= m/ V
Титрі бойынша ерітінді нормальдылығын табу үшін титрді 1000-ға көбейтіп, эквивалентке (Э) бөледі:
N =
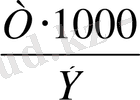 Equation. 3
Equation. 3
Мысалы: 0, 5312 г натрий карбонатын Na 2 CO 3 100мл-ге арналған өлшеуіш колбада ерітсек, түзілген ерітінді титрі:
Т=
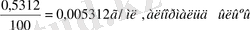
N=
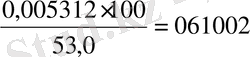 болады.
болады.
Заттың дәл өлшенген мөлшерінен ерітілген титрленген ерітіндіні стандартты (даярлаған) дейді.
Стандартты ерітінді даярлау үшін алынатын заттар химиялық таза, сақтағанда, қатты және сұйық күйде тұрақты, құрамы химиялық формулаларына сәйкес болуы тиіс. Осы талапқа сай қосылыстарды басқа ерітінділердің титрін анықтауға арналған стандартты бастапқы заттар немесе нормальдар деп атайды.
Мысалы: тұз қышқылының титрін анықтау үшін натрий тетрабораты Na 2 B 4 O 7 ·10H 2 O қолданылса, калий перманганаты ерітіндісінің титрін қымыздық қышқылының
Н 2 С 2 О 4 · 2Н 2 О стандарт ерітіндісі арқылы табады.
Стандартталған ерітінділер. Көлемдік анализде, көбінесе, қышқылдар мен сілтілер, калий перманганаты, натрий тиосульфаты сияқты стандарт ерітінділерге қойылатын талапты қанағаттандырмайтын реактив ерітінділері титрант ретінде қолданылады. Олардың дәл концентрациялы ерітінділерін өлшенген мөлшерінен даярлауға болмайды. Өйткені, сақталғанда, ауада ол қосылыстар концентрациясы өзгеріп кетеді. Сондықтан бұл титрант ерітінділерді жуықтап алынған мөлшерінен даярлайды да, олардың дәл концентрациясын басқа стандартты ерітінді бойынша есептеп табады.
Мәселен, тұз қышқылы ерітіндісінің дәл концентрациясы натрий тетрабораты стандартты ерітіндісі бойынша анықталады.
Сонымен, дәл концентрациясы нақты өлшенген мөлшерінен емес, басқа стандартты ерітінді бойынша анықталатын титрант ерітіндісін стандартталған дейді.
Химиялық анализде ерітінділерді фиксаналдардан немесе стандарт-титрден даярлайды. Фиксанал-1л 0, 1н не 0, 01н ерітінді даярлауға арналған шыны ампула. Фиксаналдан ерітінді даярлау оңай. Шыны ампуланы арнаулы тескішпен тесіп, дистилденген сумен шайқап 1л өлшеуіш колбаға салып ерітеді де, дистилденген муды белгіге дейін құяды.
Титриметриялық анализдегі есептеулер.
Стандартталған ерітінділердің концентрациясы басқа стандартты ерітіндімен титрлеу арқылы анықталады. Стандартты ерітіндінің нормальдығы мен көлемі және стандартталған ерітінді көлемі бойынша нормальды ерітінділер қасиеттерін пайдаланып анықталады.
- Нормальдығы өзара тең ерітінділердің әрекеттесетін көлемдері де бірдей болады:
N 1 = N 2 онда V 1 = V 2
- Ерітінділер нормальдығы әр түрлі болса, әрекеттесуші заттар көлемдері мен нормальдықтары қатынасы кері пропорционал болады:
бұдан N 1 · V 1 = N 2 · V 2
Осы формуланы пайдаланып титрант ерітіндісі бойынша басқа ерітіндінің белгісіз концентрациясын анықтайды.
Мысалы, 10мл КОН ерітіндісін бейтараптау үшін 20мл 0, 1н НСІ ерітіндісі жұмсалды. Калий гидроксиді КОН ерітіндісінің нормальдығы
болады.
Титриметрияда тура, кері және жанама (немесе орын басатын) титрлеу деп бөлінеді. Тура титрлеу кезінде анықтайтын компоненттің ерітіндісін тікелей стандартты ерітіндімен титрлейді. Егер тура реакция қандай болса да бір себептен мүмкіндігі болмаса немесе қиындық келтірсе, онда кері немесе жанама жолмен титрлейді. Тура титрлеу үшін сәйкес индикатор іріктеп алуға болмаған жағдайда кері әдіспен титрлейді. Титрлеу барысында екі титрант қолданады. Мұндай жағдайда зерттелетін ерітіндіге бұрыннан белгілі концентрациясы айқын, зерттелетін заттың эквиваленттік мөлшерімен әрекеттесетін үшінші зат ерітіндісінің артық мөлшерін қосады. Үшінші заттың артық мөлшерін стандарт титранттың ерітіндісімен титрлейді.
Титриметриялық анализ әдістерінің жіктелуі.
Титриметриялық анализ кезінде химиялық реакция типіне қарай үш топқа бөлінеді:
- иондар қосылу реакциясына негізделген әдістер;
- Тотығу-тотықсыздану реакциясына негізделген әдістер;
- Комплекс түзу реакциясына негізделген әдістер.
Бірінші топқа қышқыл-негіз және тұндыру арқылы тирлеу әдістері, екінші топқа тотығу-тотықсыздану титрлеуі, үшінші топқа комплексометрия титрлеуі жатады.
1. Қышқыл-негіз титрлеу әдісі (бейтараптау) қышқыл мен негіз әрекеттесуіне, яғни бейтараптау реакциясына негізделген:
NaOH + HCI = NaCI + H 2 O
OH - + H + = H 2 O
Бұл әдіс арқылы ерітіндідегі қышқыл мен негіз мөлшерін ғана емес, суда ерігенде гидролизге ұшырайтын тұздар мөлшерін де анықтауға болады.
Егер анықтау кезінде титрант ретінде қышқыл ерітінділері пайдаланылып, негіздердің не тұздардың мөлшері анықталатын болса ацидиметрия деп аталады. Ал егер анализ кезінде қышқыл не тұз мөлшері анықталып, титрант ретінде сілті қолданылса, алкалиметрия деп аталады.
Қышқыл-негіз титрлеуі кезінде эквивалент нүктесі индикаторлар (лакмус, метил күлгін, метил қызыл, фенолфталеин) көмегімен табылады.
2. Аз еритін қосылыстардың тұндыру реакцияларына негізделген тұндыру әдісі.
Ag
+
+ CI
-
🡪 AgCI

Ba
2+
+ SO
4
2-
🡪 BaSO
4

Тұнбаға түскен қосылыс ерітінді ортасын өзгертеді. Соған орай бұл жағдайда әр түрлі индикаторлар қолдануға болады.
Титрант атына сәйкес тұндыру әдістерін де аргентометрия (титрант күміс нитраты
AgNO 3 ), тиоцианометрия (титрант аммоний тиоцианаты NH 4 SCN) деп атайды.
3. Комплексометриялық титрлеу әдістері анализ кезінде иондарға аз ыдырайтын комплексті қосылыстар түзілуге негізделген.
Са 2+ + ЭДТА → Са-ЭДТА
Бұл әдіспен түрлі катиондарды (Mg 2+ , Ca 2+ , Zn 2+ , Hg 2+ , AI 3+ ) және аниондарды (CN - , F - , CI - ) анықтауға болады. Кейінгі уақытта катиондардың органикалық реактивтермен - комплексондармен комплексті қосылыс түзуіне негізделген анализ әдістері қолданылуда.
4. Тотығу-тотықсыздану титрлеу (оксидиметрия) титрант пен анықталатын зат арасында жүретін тотығу-тотықсыздану реакциясына негізделген. Бұл әдістерді титрант ретінде қолданылатын реактивтердің атымен атайды:
Перманганатометрия. Титрант ретінде өте күшті тотықтырғыш калий перманганаты KMmO 4 ерітіндісі қолданылады.
Иодометрия. Иодтың І 2 оңай иодидке І - және иодидтің І - оңай иодқа І 2 айналу реакциясына негізделген.
Дихроматометрия. Мұнда титрант ретінде күшті тотықтырғыш калий дихроматы K 2 Cr 2 O 7 ерітіндісі пайдаланылады.
Сонымен қатар, басқа да тотығу-тотықсыздану титрлеу әдістері бар. Мысалы: бромометрия (тотықтырғыш Вr 2 ), броматометрия (калий броматы KBrO 3 ), ванадатометрия (аммоний ванадаты NH 4 VO 3 ), титанометрия (титан (ІІІ) тұздары) .
Титриметриялық анализ қай әдіспен жүргізілсе де 1) титрленген ерітінді 2) дәл келетін индикатор; 3) әрекеттесуші заттар көлемін дәл өлшеу қажет.
- Реакцияға қойылатын талаптар.
Анықталатын зат пен титрант құрамындағы зат арасындағы химиялық реакция титриметриялық деп аталады. Бұл реакциялар кейбір шарттарды қанағаттандыру қажет.
- Ол тез өтуі қажет- титранттың қосылған көлеміндегі реагент бірнеше секундта жоғалады.
- Титриметриялық реакция іс жүзінде қайтымсыз болу керек, қосымша реакциялар жүрмеуі қажет.
- Ерітіндідегі қосымша заттар негізгі реакцияға кедергі жасамау керек.
- Титриметриялық реакция кезінде көзбен не құралмен бақыланатын өзгерістер болуы қажет. Бұл эквиваленттік нүктенің басталу мезетін белгілеуге мүмкіндік береді.
Қышқылдық-негіздік тирлеудің мәні
Титрлеу әдісі клиникалық зертханаларда несеп құрамына кіретін аммиак және қышқылдарды, қанды, асқазан шырынының қышқылдылығын, биологиялық сұйықтардың құрамын, сандық анықтау үшін кеңінен қолданылады. Тазалық-гигиеналық зертханаларда бейтараптану әдісін пайдаланып әртүрлі тағамдардың (нан, ұн, ет) қышқылдылығын анықтайды ішуге жарайтын не қалдық сулардың анализін жүргізеді.
Қышқылдық-негіздік титрлеу әдіспен күшті қышқылдар, күшті негіздер мөлшерлермен қатар, суда гидролизденетін тұздар мөлшерін де анықтауға болады.
Қышқыл мен негіз арасындағы реакция кезінде ешбір сырттай байқалатын белгі болмайды. Сондықтан мұндай реакцияның эквивалент нүктесін анықтау үшін арнайы индикаторлар қолданылады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz