Тотығу-тотықсыздану реакциялары мен электролиз: теориялық негіздер және теңестіру әдістері


Жоспар
I. КІРІСПЕ
1. 1. Тотығу-тотықсыздану реакциясы туралы жалпы түсінік.
II. НЕГІЗГІ БӨЛІМ
2. 1. Тотығу реакциясының жүру құбылысы.
2. 2. Электролиздің мәні. Электролиз заңдары.
2. 3. Заттардың тотығу-тотықсыздану қасиеттерін анықтау
III. ПАЙДАЛАНЫЛҒАН ӘДЕБИЕТТЕР
КІРІСПЕ
Тотығу-тотықсыздану реакциялары (ТТР) - реакцияға қатысушы заттардың құрамындағы элементтердің тотығу дәрежелерінің өзгеруімен жүретін реакциялар.
18 ғасырдың аяғында А. Лавуазье жанудың оттекті теориясын ұсынған кезден бастап тотығу заттардың оттекпен қосылуы, ал тотықсыздану оттекті бөліп алу процестері деп қаралған. 1920 - 1930 ж. химияда электрондық түсініктің қалыптасуына байланысты оттек қа-тыспайтын реакциялардың да Тотығу-тотықсыздану реакциялар болатындығы анықталды. Тотығу-тотықсыздану реакциялар процестері көбінесе электрондық теңдеулермен өрнектеледі. Зарядтардың сақталу заңына қайшы келмес үшін Тотығу-тотықсыздану реакциялар кезінде тотықтырғыштың қосып алған электрондар саны тотықсыздандырғыштың берген электрондар санына тең болуы керек деген жалпы ереже сақталады. Тотығу-тотықсыздану реакцияларын коэффиценттер қойып теңестірудің екі әдісі бар: электрондық тепе-теңдік және электрон-ион. Электрондық тепе-теңдік әдісі бойынша берілген және қосып алған электрондар саны элементтердің реакцияға дейінгі және реакциядан кейінгі тотығу дәрежесінің негізінде анықталады.
1+HO+1Cl болатын Тотығу-тотықсыздану реакцияларындағы тепе-теңдік қышқылдық ортада солға, ал негіздік ортада оңға ығысады. Күшті тотықтырғыш−HCl⇔Электрон-ион әдісі бойынша жалпы иондық реакцияларды құру ережесіне сәйкестеп реакция сұлбасын құ-рады. Күшті электролитті ион түрінде, бейэлектролит пен әлсіз электролиттерді, газдарды және тұнбаларды молекула күйінде жазады. Бұл әдіс реакция жүрген ортаның табиғатына байланысты. Себебі реакция бағытына орта күшті әсерін тигізеді. Мыс., +H2O Mn+7 қышқылдық ортада Mn2+-ге дейін, сілтілік ортада Mn+6, бейтарап ортада Mn+4O2 молекуласына дейін тотықсызданады. Тотығу-тотықсыздану реакцияларының стехиометр. коэффицеттерін табудың бұлардан басқа А. Гарсиа, электронды баланс, матем. әдістері де бар. Химияда Тотығу-тотықсыздану реакциялар өте көп таралған. Мысалы, аммиак, азот қышқылы, күкірт қышқылын алу, электролиз (анодта электрхимиялық тотығу, катодта электрхим. тотықсыздану), жану процесі, металдар коррозиясы, фотосинтез, т. б. маңызды биологиялық құбылыстар Тотығу-тотықсыздану реакциялар процесіне жатады. Тотығу-тотықсыздану реакциялар өнеркәсіпте және техникада көміртек (ҚҚ, ҚV) оксидтерін, таза металл, т. б. алуда кеңінен қолданылады.
Тотығу- тотықсыздану реакциялары ең көп тараған реакциялардың бірі. Бұл реакциялардан, электрондар бір атомдардан, молекулалардан немесе иондардан басқаларға ауысады. Тотыққан кезде атомдардың тотығу дәрежелері әрқашанда жоғарлайды, ал тотықсыздаңғанда- төмендейді.
Тотығу- тотықсыздану реакциясын теңістіруге қолайлы екі әдіс бар: электрондық баланс әдіс, бастапқы және соңғы заттардың тотығу дәрежелерін салыстыруға негізделген және жартылау реакция әдісі, тотықсыздандырғышты тотықтыру процесінің және тотықтырғышты тотықсыздандыру процесінің иондық теңдейлерін құрастырып, одан соң оларды бір жалпы теңдеуге біріктіруге негізделген.
Бірдей заттардың арасындағы тотығу- тотықсыздану реакциясының сипаты ортаға байланысты өзгереді. Реакция ортасы атомдардың тотығу дәрежелерінің өзгеруіне әсер етеді.
Электролиздің мәні электр энергиясы арқылы химиялық реакцияны жүзеге асыру- катодта тотықсыздану және анодта тотығу процестерін жүргізу. Мұнда катод катиондарға электрондарын береді, ал анд аниондардан электрондарды қабылдайды. Электролиз балқымада да және электролиттің ерітіндісінде де жүреді.
Металдардың қалыпты электродтық потенциалы белгiлi болса кез келген екi металдан тұратын гальвани элементiнiң электр қозғаушы күшiн (э. қ. к) есептеп шығаруға болады. Мыс;
Э. Қ. К =
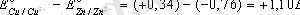
Егер э. қ. к мәнi оң болса реакция осы бағытта жүредi, ал терiс болса жүрмейдi. Гальваникалық элементтiң э. қ. к мен
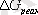 және тепе-теңдiк константасы арасындағы байланыс
және тепе-теңдiк константасы арасындағы байланыс
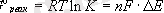 немесе
немесе
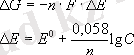
Электролиз.
Электролиттiң балқымасы немесе ерiтiндiсi арқылы электр тогы откенде жеке электродтарда жүретiн тотығу-тотықсызданы реакциясын электролиз деп атайды.
Электр өткiзгiштерi екi ретте бөледi.
- І реттi өткiзгiштер электрондар қозғалысына тәуелдi электролиттер
- ІІ реттi өткiзгiштерге жатады.
Гальваникалық элементте химиялық реакцияның энергиясы электр энергиясына айналатын болса, электролиз жүргенде, керiсiнше, сыртқы ток көзiнiң электр энергиясы химиялық энергияға айналады. Электролиз кезiнде гальваникалық элементтегi сияқты анодта тотығу, катдта тотықсыздану процесi жүредi. Бiрақ, электролиз процесi гальваникалық элементтiң жұмыс iстеу принципiне қарама-қарсы болғандықтан электролиз кезiнде терiс электрод катодының, ал оң электрод анодтың қызметiн атқарады.
Электролиздi iске асыру үшiн ваннаға электролидтiң балқымасын немесе ерiтiндiсiн құяды. Бұдан кейiн екi электродың бiреуiн тұрақты ток көзiнiң терiс полюсiмен жалғайды-оны катод деп атайды, екiншiсiн оң полюспен жалғайды, оны анод деп атайды. Ендi осы электродтарды электролиттiң балқымасына немесе ерiтiндiсiне батырады.
Терiс электродқа - катодқа электролиттiң катиондары тартылып өздерiне керектi электрондарды қосып алып тотықсызданады, ал анодқа аниондар тартылып өздерiнiң артық электрондарын берiп жiберiп тотығады.
Электролиз жүргiзуге көбiне мнталл электродтары және байметалл электродтар да (мыс. Графит) қолданылады. Металдан жасалған анодтар еритiн және ерiмейтiн болып екi топқа бөлiнедi. Мыс., Ni, Cu жасалған анодтар еридi, ал Pt жасалған анод ерiмейдi. Мысал ретiнде мыс дихлоридiнiң судағы ерiтiндiсiнiң электролизденуiн қарастырйық. Тұрақты ток әсерiнен ерiтiндiдегi Cu2+ және Cl- иондары әрқайсысы қарсы заряды бар электродтарға бағытталады да, мыс ионы катодта тотықсызданып, хлор ионы анодта тотығады:
К: Cu2++2e=Cu0
A: 2Cl-2e= Cl

Электролит ерiтiндiлерiнiң электролизiн қарастырғанда ваннада электролит иондарынан басқа су иондары болатынын естен шығармау керек.
Сондықтан катодта электролиттiң немесе сутегiнiң катиондары тотықсыздануы, ал анодта электролит аниондары немесе гидроксид иондары тотығуы мүмкiн.
Мыс., құрамындағы металл катиондының стандартты электродтың потенциалдары - 1, 41 В-тан болатын тұздардың ерiтiндiлерiн электролиздегенде катодта металл катиондары тотықсызданады. Мұндай металдар кернеу қатарында сутегiнiң маңайында және одан кейiн орналасады.
Егер электролиттегi катиондардың электродтық потенциалдары -0, 41 В тең немесе әжептеуiр аз болса, онда катодта сутегi иондары тотықсызданады -0, 41 В жақын шамаларды ерiтiндiнiң конценртациясына және электролиз жүргiзу жағдайына байланысты катода металл катиондары да, сутегi де бөлiнуi мүмкiн.
Қышқыл орта үшiн судың стандарттық потенциалы 0, 00 В болса, нейтрал орта үшiн +0, 41В.
Ерiтiндiде әр түрлi аниондар болған жағдайда ерiмейтiн анодта ең алдымен потенциалы аз, яғни е оңай беретiн анион тотықсызданады.
Ол үшiн нейтрал ортада судың гидроксид аниондарының тотығу потенциалының +0, 82В екенiн еске ұстау керек.
Мыс.,
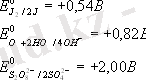
Осы көрсетiлген иондар бар ерiтiндiнi электролиздегенде потенциалы аз болғандықтан (0, 54 В) J- иондары тотығады.
2J-2е=J2
Кейiн
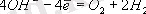
Кейбiр тұздардың электролиздерiне мысал:
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz