Қышқылдар мен негіздердің теориялары және ерітінділер: сольвожүйелер, ерігіштік және электролиттік қасиеттер


Қышқылдар мен негіздер
Р. Бойль химияға қышқылдар мен негіздер жайлы түсінікті енгізген болатын. Ол кездегі қышқылдар мен негіздердің анықтамасы олардың қасиетін тікелей көруге, байқауға оны баяндай айтуға (түсі, түрі, бояуы, дәмі және т. б. ) негізделді. Сулы ерітіндідегі электролиттік диссоцация құбылысының ашылуы келесі анықтаманы (Аррениус бойынша) қабылдау керектігіне әкеледі.
- қышқылдар деп сулы ерітіндідегі диссоцация кезінде оң зарядталған иондардан тек сутек ионын Н + ғана түзетін қосылыстарды айтады (мысалы, H 2 SO 4 , HBr, H 3 PO 4 және т. б. )
- негіздер деп сулы ерітіндідегі диссоцация кезінде теріс зарядталған иондардан тек гидроксид - ионын ОН - ғана түзетін қосылыстарды айтады (мысалы, KOH, Ba (OH) 2 Fe (OH) 3 және т. б. )
Жалпы химия ғылымының дамуы заттардың сусыз ерітіндісінде өтетін процестерді түсіндірудің қажеттілігін талап етті. Мысалы, сулы ерітіндіде өзін тұз ретінде ұстайтын, аммоний хлориді сұйық аммиакта ерігенде қышқыл қасиетін көрсетіп, өзінде металдарды ерітіп, онымен әрекеттесіп, сутекті ығыстыра бөледі. Мұндай құбылыстарды Аррениустың электролиттік диссоцация теориясы негізінде түсіндіруге тмүмкінді болмай қалды. Бұған орай қышқылдар мен негіздер анықтамасы қайтадан қарастыла басталды.
1923ж И. Бренстед қышқылдар мен негіздердің протондық теориясын ұсынды, оған сәйкестік бойынша:
- Қышқыл - берілген реакцияда протондыбөліп шығартын зат;
- негіз - берілген реакцияда протонды қосып алуға қабілетті зат.
Протонды бөлетін кез келген реакция теңдеумен өрнектеледі.
қышқыл→негіз + Н +
Мұндай процестің қышқылы мен негіздері орайластар деп аталады. Қышқылды - негіздік қасиеттер сандық тұрғыдан протондық ынтылықпен немесе энергиямен сипатталады, ал энергия молекулаға не ионға протон қосылғанда бөлінеді.
Бұл ұсыныс түріндегі көзқарас аммактың негізгі қасиеттерін түсіндіреді, ол азот атомындағы бөлінбеген электрондар жұбы есебінен қышқылдар мен әрекеттескенде, протонды қабылдайды да донорлы - акцепторлық механизм бойынша аммони й ионын түзеді:
HNO 3 + NH 3 ↔︎NH 4 + + NO - 3
қыш нег қыш нег
Міне, осылайша қышқылдар мен негіздерден әрқашанда жаңа орайлас қышқылдар мен негіз алынады.
Протолиттік теория бейтараптау реакциясын қышқыл протонының негізге ауысуы ретінде қарастырады.
1924ж Дж. Льюис қышқылдар мен негіздердің электрондық теориясын ұсынды.
- Бір немесе бірнеше электрондар жұбын қабылдауға қабілетті катиондарды, аниондарды немесе молекулаларды Льюис қышқылы деп аталады. Мысалы, алюминий фториді
AlF 3 + : NH 3 ↔︎ [AlF 3 ] : [NH 3 ]
- Электрондық жұбын беруге қабілетті катиондарды, аниондарды немесе бейтарапты молекулаларды Льюис негіздері деп атайды. Льюистің анықтамасы бұрындары ұсынылған, қарастырылған теориялардағы барлық қышқылдарды - негіздік процестерді қамтиды.
Жоғарыда қарастырылған теориялар бойынша қышқылдар мен негіздердің анықтамалары 2-ші кестеде көрсетілген.
Қышқылдар мен негіздердің анықтамасын салыстыру.
Ерітінділер түрлері.
Табиғат пен техникадағы ерітінділердің өнеркәсіптік және өмірлік процестер үшін үлкен мәні бар.
Ерітінділер - ол еріген зат пен ерігіштіктен және олардың әрекеттесу өнімдерінен тұратын гомогенді физика - химиялық жүйелер. Ерітінділерде басқалардан көп болатын құрамдасты еріткіш деп атайды. Мысал, судағы күкірт қышқылының ерітіндісі - ол жүйе және сол жүйе еріген заттан (H 2 SO 4 ), еріткіштен (H 2 O) және еріткіш пен еріген заттың әрекеттескен өнімдерінен тұрады: иондар H + , HSO 4 - , SO 2- 4 гидраттар H 2 SO 4 ∙H 2 O, H 2 SO 4 ∙2H 2 O, H 2 SO 4 ∙ 4H 2 O.
Ерітінділерді былай жіктейді:
- Бөлшектер өлшемі бойынша (жүзгіндер, каллоидты ерітінділер, нағыз ерітінділер) .
- Еріген зат пен еріткіштің агрегаттық күйі бойынша:
а) газ - газ (мысалы, ауа)
б) газ - сұйықтық (аммиак хлорсутек, судағы СО 2 )
в) газ - қатты дене (платинада хемосорбцияланған сутек) ;
г) сұйықтық - сұйықтық (судағы спирт, ацетон, күкірт қышқылы) ;
д) сұйықтық - қатты дене (судағы тұздар, сілтілер, қант)
е) қатты - қаттыда (алтындағы күмістің ерітіндісі) жән т. б.
Белгілі химиялық қосылыстардың құрамымен салыстырғанда ерітінділер құрылымының ерекшелігі сол, олар өте кең ауқымда өзгере алады. Мұндай тұрғыдан алғанда жылу пәрменінің болуы, бояудың туынауы ерітінділер химиялық қосылыстарға ұқсайды. Демек, ерітінділер химиялық қосылыстар мен қоспалардың арасындағы аралық жағдайда болады.
Ерітіндінің түзілу процесі қалай жүретіндігін қарастырайық. Ол үшін әуелі қатты заттың еруін алайық, мысалы ас тұзының сұйықта (суда) еруін. Еріткіш әсері мен тұздың беттік қабатынан жекеленген бөлшектер (Na + және Cl - ионары) бөлінеді де олар диффузия салдарынан еріткіштің көлеміне тарайды. Тоқтаусыз қозғалыста болатын бөлшектердің концентрациясы көбейген сайын, әлі ерімеген затпен соқтығысып, сонда тоқталып қалуы да мүмкін.
Әрқашанда кері құбылыспен - кристалданумен қатар жүреді. Ерітіндіге ауысатын немесе ерітіндіден кететін, бөлшек санының қатынастары бойынша қаныққан, қанықпаған және аса қаныққан ерітінділерді ажыратады.
Қаныққан ерітінді - берілген температурада зат онан әрі ерімейтін ерітінді еритін зат пен тепе - теңдікте болады. Қанық еітінді дайынау үшін берілген температурада ерімей қалғанша қоса беру керек. Мұндай жағдайда ерітінді мен еритін заттың артық мөлшері арсында динамикалық тепе - теңдік орнайды: заттың қанша бөлігі рітіндіге ауысса, ерітіндіден сонша олар бөлінеді (кристалды) . Қанықпаған ерітінді - берілген температурада ондағы еритін заттың мөлшері оның қанық ерітіндісінен аз ериді.
Аса қаныққан ерітінді - бірдей жағдайда қанық ерітіндіде еріген затпен салыстырғанда, еріген заты артық болатын ерітінді. Мұндай ерітінді тұрақсыз және жағдайы өзгерсе (мысалы, ыдысты болмашы ғана сілкілесе немесе тұздың кіші бір түйірін салса - кристалдану үшін ұйытқы) қаныққан ерітіндіге және артық тұз кристалдарына айналады.
Сондай - ақ тағы да еріген зат пен еріткіштің салыстырмалы саны бойынша ерітінді сұйық және қою (концентрленген) деп бөледі. Сұйық ерітіндіге еріткіштің мөлшерімен салыстырғанда еріген заттың мөлшері аз болатын ерітінділер жатады, ал қоюға (концентрленген) - еріген зат мөлшері артық болатындар. Сұйық және қою ерітінді түсінігіндегі салыстырмалы ұғым олар тек ерітіндідегі еріген зат пен еріткіштің иондық қатынасын нақтылай емес, шамалап қана нұсқайды. Сондықтан химиялық әдебиеттерде бұл екеуін «күшті» және «әлсіз» дегендей сөздермен де алмастыра береді.
Ерітіндіге және онда ерітілген заттардың ерітіндісіне қышқылдық - негіздік қасиеттер тән. Қышқыл - негіз ұғымдарын қарастыру барысында әртүрлі көзқарастар ұшырасады. Енді оларға қысқаша тоқталалық.
Өзімізге таныс суды ерігенде сутек катиондарын түзетін қосылыстар негіздер деп аталатындығы классикалық Аррениус ілімінен белгілі.
HCl ↔︎ H + + Cl - қышқыл
KOH↔︎K + + OH - сілті
Демек, келтірілген бойынша заттардың қышқыл немесе сілті болып аталуы олардың еріткіш бойына берген ион түрімен анықталады деп тұжырымдалады. Түптеп келгенде судың өзі де жоғарыдағыдай ион түрлеріне ыдырай алады, яғни:
H 2 O↔︎H + + OH -
Осы себепті ғалымдар Бренстед және Лаури қышқылдар және негіздер ұғымына өз теорияларын ұсынды.
Бұл пікір бойынша қышқылдарға протонды беріп жібере алатын, ал негіздерге осы протонды қосып алатын заттар (молекула, ион) жатады.
Өзгеріс барысында протон қосылып не алынатын болғандықтан бұл ілім протонды немесе қышқыл - негіздердің протолитті теориясы деген атпен көпшілікке танымал болады. Мысалы:
H 2 O + H 2 O ↔︎ H 3 O + + OH -
қыш нег
NH 3 + NH 3 ↔︎ NH + 4 + NH - 2
Ерітінділерде протон беріп не қосып алып жүретін өзгерістер, тек иондар қатысында жүретін реакциялардың бір түрі ғана. Сондықтан протолиттік теориядағы «қышқыл - негіз» ұғымдарын одан әрі дамытқан Гутман мен Линдквис және Эберт және Конопиктің - сольво жүйелер теориясы . Бұл көзқарас бойынша ион қатысында жүретін реакциялардың бәрін де «ионотропия» деген ұғым біріктіруі тиіс.
Ионотроптық сольвожүйелер түсінігі бойынша қышқылдар дегеніміз - еріткіште қышқылдық қасиетке ие аниондар концентрациясын арттыратын қосылыстар.
Протолиттік теория бойынша еріткіш молекулаларымен әрекеттесіп түзілген иондар лионий және лиат деп атайды. Мысалы, су және аммиак бойынша төмендегідей өзгерістер орын алады:
2H 2 O ↔︎ H 3 O + + OH -
2NH 3 ↔︎ NH + 4 + NH - 2
лионий лиат
ионы ионы
Дәл осындай еріткіш молекулаларымен қосылып сольваттанған иондар түзілуі сольважүйелер ілімінде де орын алады. Мысалы,
N 2 O 4 ↔︎ NO - 3
2SO 2 ↔︎ SO 2+ + SO 2- 3
Жоғарыдағы түзілген H 3 O + , NH 4 + - катиондарына катион - қышқылдар NO + , SO + 2 , ал OH - , NH - 2 - аниондарына - анион негіздер NO - 3 , SO 2- 3 сәйкес келеді.
Сонымен, протолиттік теорияны негізге ала отырып, еріткіштің бойында оның катион мөлшерін (H 3 O + , NH + 4 , H 3 SO + 4 т. б. ) арттыратын заттар қышқылдар, ал еріткіштің анион мөлшерін (OH - , NH - 2 , HSO - 4 ) арттыратын заттарды негіздер деп қарастыратын көзқарас сольвожүйелер теориясы деп атайды. Бұл көзқарастың бір артықшылығы - судан өзге еріткіш бойында орын алатын тепе - теңдікті сипаттайтын сандық көрсеткіштердің есептелінуі дәл еріткіш су болған кездегімен бірдей.
Мысалы, су үшін:
H 2 O + H 2 O ↔︎ H 3 O + + OH -
K w = [H 3 O + ] ∙ [OH - ]
Өзге кез келген еріткіш үшін мысалы NH 3 болса:
NH 3 + NH 3 ↔︎ NH + 4 + NH - 2
K s = [NH + 4 ] [NH - 2 ]
мұнда S - еріткіш деген мағынаны білдіреді;
K w және K s - судың және еріткіштің иондық көбейтіндісі.
Льюис көзқарас бойынша бөлінбеген бос жұп электрондары бар заттар жұп электронды қосып алу мүмкіндігіне ие заттар қышқыл болып есептелінеді.
Мысалы:
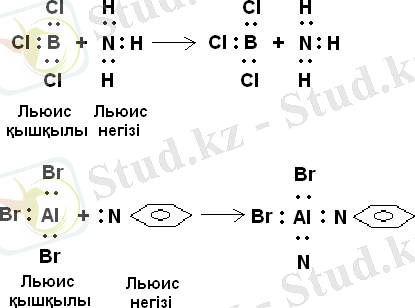
Льюис көзқарасы бойынша комплекс түзілу реакцияның бәрі де донорлы - акцепторлы байланыс түзетін қышқылды - негіздік әрекеттесу тобына жатады. Алайда, бұл тұрғыда, құрамында протоны бар қышқылдың қышқылдық қасиет көрсетуін түсіндіру тұғырыққа тіреледі.
Қышқылды - негіздік теориялар ішінде жалпы жағдайды ескерген ілім қазақстандық ғылым М. Усановичтің қышқыл - негіздер теориясы. Бұл теория бойынша қышқыл - негізге төмендегідей анықтама береді.
Құрамынан катион бөліп жібере алатын және анион, электрон жұбын қосып ала - алатын заттар қышқылдар деп атайды.
Негіздер дегеніміз құрамынан анионды немесе электрон жібере алатын және катиондарды қосып ала алатын заттар.
Мысалы: N (CH 3 ) 3 + CH 3 I → [N(CH 3 ) 4 ] + + I - .
мұндағы метилиодид - қышқыл өйткені СН + 3 катионын беріп жібереді, ал триметиламин - негіз, катионды қосып алады. Аталған реакция түрі Бренстед - Лаури бойынша қышқылды - негізді реакциялар түріне жатпайды, өйткені протон беру - алу процессі орын алған жоқ.
Льюис теорияның негізінде туындаған қышқылдар ұғымының да ғылымды дамытуда өзіндік орыны бар екендігі естен шығаруымыз керек.
Пирсон көзқарасы бойынша электрон жұбын қосып алатын қышқыл (А) және оны беріп жіберетін АВ - комплексті қосылысы түзіледі деп қарастырылады, яғни:
А + :В ↔︎ А-В
Қатты заттардың ерігіштігі.
Қатты күйде ұшырасатын заттар да ерігіштерде әр түрлі дәрежеде ериді. Мысалы, суда еритін BaSO 4 тұнбасы органикалық еріткіш трилон - Б да өте жақсы ериді.
Күміс нитратының бөлме температурасында бір литрде 2567 граммы еритін болса, ал сынап сульфидінің дәл осы ағдайы 2, 33∙10 -19 г ғана ериді, яғни мүлдем ерімейді деген сөз.
Сондықтан шартты түрде төмендегідей ерігіштікті сипаттайтын шамалар енгізіледі:
- ерімейтін заттар - бір литрде 0, 001 мольінен артық ерімейді;
- нашар еритін заттар - бір литрде 0, 1- 0, 001 мольі шамасында ериді;
- еритін заттар - литрде 0, 1 мольінен артығы ериді.
Жалпы жағдайда ерігіштікті санды тұрғыда нақты температурада 100г еріткіштегі немесе 1л ерітіндідегі еріген зат массасымен (мөлшерімен) сипаттайды.
Еріген заттың 100г еріткішке шаққанағы шамасы оның ерігіштік коэффициенті немесе ерігіштігі деп аталады.
Мысалы, 20 0 С температурасында иодты калийдің ерігіштігі 145г, ал өзіміз көп пайдаланатын ас тұзының ерігіштігі 36г жуық.
Егер осы температурада жоғарыда алынған ерітінділерге тұздардың артық түйірлерін салғанымызбен ерімейді, яғни қаныққан ерітінді түзілгендігін айғақтайды.
Қарастырылып отырған температурада қанығуға жетпеген ерітінділер қанықпаан ерітінділер деп аталады.
Еру мүмкіндігі бола тұра, ерітілген массасы ерітіндіде өте аз мөлшерде болса, онда мұндай ерітінділер сұйытылған ерітінділер деп аталады.
Қатты заттар, тұздардың ерігіштігі температура жоғаылауымен артады. Мысалы, бөлме температурасында калий нитратының ерігіштігі 34г - дай болса, температураны 70 0 С - ға көтерген кезде оның ерігіштігі 136г дейін жоғарылайды.
Егер, жоғары температурада ерітінді даярлап, мұнан соң оны салқындататын болса, онда ерігіштіктің кемуіне сәкес еріген тұз біртіндеп бөліне бастайды, яғни кристалдану құбылысы орын алады. Осы қасиет заттарды тазартуда жел пайдаланылады.
Кейбір жағдайда температураны төмендеткенмен ерігіштік мәніне сәкес келмесе де тұздардың ерітіндіден кристалдануы, яғни бөлінуіорын алмайды.
Мұндай ерітінділер асқын қаныққан ерітінділер (пересыщение) деп аталады және тұрақсыз болып келеді. Жүйеге шамалы сырттан әсер ету (шайқау, сол тұздың кішкене түйірін қосу) ерітіндіден тұздың бөлініп кисталдануына әкеліп соқтырады.
меңгеру үшін, ерігіштік тақыыбына мысалдар қарастыралық.
Электролит ерітінділері.
Рауль, Вант - Гофф заңдылықтары, бейэлектролит ерітінділері үшін, яғни ерігенде еріілген зат бөлшектері молекула күйіне жүретін заттар үшін орынды болды. Тәжірибе жүзінде байалған ауытқулар изотондық коэффициент ұғымын кіргізе отырып, ғалымдарды жаңа көзқарасқа итермеледі. Соның бірі швед ғалымы С. Аррениус ұсынған заттардың электролиттік диссоциациялану теориясы болды.
Ерітіндіде, еріген заттар еріткіш молекулаларме әеетесіп иондарға ыдырайды. Осының нәтижесінде бөлшектер саны артады. Зттардың ионға ыдырауына әрбір еріткішке тән диэлектрлік тұрақтылық щамасы мен оның полюстілігі үлкен ықпал етеді.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz