Жалпы және бейорганикалық химия: масса, атом құрылысы, химиялық байланыстар және реакциялар


- ЖАЛПЫ ЖӘНЕ БЕЙОРГАНИКАЛЫҚ ХИМИЯ ПӘНІМасса - бөлшектiң күйi өзгерген кездегi оның гравитациялық тартылуын немесе инерттiлiгiн сипаттайтын қасиетi.
Массаның атомдық бiрлiгi (м. а. б. ) немесе көмiртектiк бiрлiк - 1/12 көмiртегiнiң - 12 изотопының массасы: 1 м. а. б. = 1, 6605710 -24 г. Тәжрибелiк есептеулер жүргiзгенде химияда массаның абсолюттiк мәнiн емес көмiртектiк бiрлiкпен өлшенетiн атомдық массаның бiрлiгi - салыстырмалы масса қолданылады.
Салыстырмалы атомдық масса - белгiлi бiр элемент атомының массасы көмiртектiк бiрлiк массасынан неше есе артыо екенiн көрсетедi. Элементтер изотоптардың қоспасын құрайды, сондықтан Д. И. Менделевтiң кестесiнде көрсетiлген элемент атомының массасы элементтiң табиғаттағы изотоптарының атомдық массаларының орташа мәнi.
Салыстырмалы молекулалық масса - молекула массасы көмiртектiк бiрлiктен неше есе үлкен екендiгiн көрсететiн сан. Молекулалық масса сол молекуланың құрамына кiретiн барлық элемент атомдарының массаларының қосындысына тең.
Моль - 12 г. көмiртегi - 12 изотопында қанша құрылымдық бiрлiктер болса, сонша бiрлiктi құрайтын зат мөлшерi.
Заттың құрылымдық бiрлiгi - химиялық бөлшек (атом, молекула, ион), сонымен қатар формуламен берiлетiн бөлшектер жиынтығы.
Зат массасының сақталу заңы - (М. В. Ломоносов, 1748, А. Л. Лавуазье, 1789) : әрекеттесушi, яғни реакцияларға қатысатын заттардың массасы реакция нәтижесiнде түзiлетiн зат массасына тең болады.
Зат құрамының тұрақтылық заңы - (Ж. Л. Пруст, 1799) : алыну әдiсiне қарамастан әрбiр заттың құрамы ( қасиетi) тұрақты болады.
Авогадро заңы - (А. Авогадро, 1811, С. Канницаро, 1858) : бiрдей жағдайдағы (температура және қысымда) әртүрлi газдардың тең көлемдерiндегi молекула сандары бiрдей болады.
- Молекулалық және атомдық массаны анықтау тәсiлдерi
1 . Газдардың молекулалық массасын берiлген көлем арқылы анықтау:
Авогадро заңынан шығатын салдар:
а) бiрдей жағдайда әртүрлi газдардың бiрдей мөлшерi бiрдей көлем алады;
б) қалыпты жағдайда (қ. ж. ) температура Т=273, 15 K (0 O C), қысым P=1, 01325 10 -24 Па (P=1 атм, P=760 мм с. б. ) кез келген газдың 1 молi 22, 4 л. көлем алады.
2. Газдардың молекулалық массаларын салыстырмалы тығыздық арқылы анықтау
Авогадро заңы. Бiрдей жағдайда әртүрлi газдардың бiрдей көлемдерiндегi молекулалар саны бiрдей болады. n
H
 =n
O
=n
O
 ; V
H
; V
H
 = V
O
= V
O


;
Тең көлемдегi бiрдей жағдайда алынған газдардың массаларының қатынасы бiрiншi газдың екiншi газ бойынша салыстырмалы тығыздығы деп аталады.
3. Газдардың молекулалық массасын Менделеев-Клайперон теңдеуi арқылы анықтау
PV=

мұндағы - m -газ массасы, г
М - газдың молекулалық массасы, г/моль
Р - қысым, Па
Т - температура, К
R - универсал газ тұрақтысының мәнi P мен V өлшем бiрлiктерiне байланысты болады.
Егер P= атм
V=1л, онда R=0. 082

Егер P=мм. с. б.
V=мл, R=62400

Егер P=Па
V=м 3 , R=8. 31

Эквивалент заңы (В. Рихтер, 1792) : реакцияға қатысатын заттардың салмақ мөлшерi олардың эквиваленттерiне пропорционал болады.
Элементтiң химиялың эквивалентi - сутегi массасының бiр бiрлiгiмен немесе оттегi массасының сегiз бiрлiгiмен қосылатын немесе осы мөлшерiн қосылыстан ығыстыратын массаны айтады.
Атом құрылысы. Радиоактивтiлiк
Атом ядросы - атомның негiзгi массасы шоғырланған оң зарядталған, атомның бөлшегi . Ядро нуклондардан (протондар мен нейтрондардан) тұрады. Протондар Z мен нейтрондар N санының қосындысы массалық сан А деп аталады: А = Z + N.
Протондар - массасы 1, 00728 м. а. б және заряды шартты түрде +1 деп алынған оң зарядталған бөлшектер. Элементтiң реттiк нөмерi атомдағы протондар санына тең және ядроның жалпы оң зарядын, сонымен қатар периодтық жүйедегi элементтiң орнын анықтайды.
Нейтрондар - массасы 1, 200866 м. а. б. электiрлiк бейтарап бөлшектер. Бiр химиялық элементтiң ядросындағы нейтрондар саны әртүрлi болуы мүмкiн.
Изотоптар - ядро заядтарының саны бiрдей, бiрақ массалары әртүрлi элементтер.
Изобарлар - ядро зарядтары әртүрлi, ал массалық сандары бiрдей болатын химиялық элементтер.
Атом оң зарядталған ядродан және оны айналып жүретiн электрондардан тұрады. Атомдағы электронның күйi төрт квант санымен сипатталады.
Квант сандары
n-бас квант саны электронның ядродан арақашықтығын, яғни e-бұлтының орташа көлемiн, e - дардың энергиясын, қабат санын анықтайды. n=1-ден + дейiн мән қабылдайды.
l - орбиталь квант саны (қосымша) қабаттағы деңгейше санын көрсетедi, электрон бұлттарының пiшiндерiн, деңгейшедегi электронның энергиясын көрсетедi.
l - 0-ден (n-1) дейiн мән қабылдайды.
m - магнит квант саны, орбиталüдардың кеңестiкте орналасу бағытын көрсетедi.
m=- l …0…+ l мән қабылдайды.
S-спиндiк квант саны электронның өз осiнде айналу бағытын көрсетедi.
S=+1/2; -1/2 мәндерiн қабылдайды.
Паули принципi: атомда 4 квант сандары бiрдей болатын екi электрон болмайды.
Гунд ережесi: энергетикалық деңгейдегi электрондардың максимал саны N = 2n 2 ; атомның тұрақты күйiне, спин сандарының қосындысы максимал болатындай энергетикалық деңгейшеде электрондардың орналасуы сәйкес келедi.
Клечковский ережесi: негiзгi күйiнде электрон (n+ l ) қосындысының мәнi кiшi болатын деңгейшеге орналасады; егер 2 деңгейше үшiн (n+ l ) қосындылары тең болса, онда алдымен “n”-» мәнi кiшi деңгейше толтырылады. Атомдардың электрондық конфигурацияларын екi (а) немесе төрт (б) квант сандарының терминдерiнде жазады:
а) 7 N а) 1s 2 2s 2 2p 3 ; б)
Химиялық байланыс
Молекулада атомдардың немесе молекулалардың өзара әрекеттесуi химиялық байланыс арқылы жүзеге асады. Молекулаiшiндiк (коваленттi, полярлы, ионды, донорлы-акцепторлық, металдық) және молекулаараралық сутектiк, ван-дер-ваальс болып бөлiнедi. Байланыс түзуге қатысатын сыртқы электрондық қабаттағы электрондарды валенттi деп атайды. Валенттi электрондар жұптаспаған электрондар немесе электрон жұптары болуы мүмкiн.
Валенттiлiк - бұл молекулада химиялық элемент атомының түзетiн байланыстар саны. Көп жағдайда металл атомдарында сыртқы электрондық қабатта бiрден үшке дейiн электрондар болады. Металл неғұрлым электрондарды оңай берсе, солғұрлым ол активтi. Металдың реакцияға бейiмдiлiгiн сипаттайтын шамаларының бiрi - иондану энергиясы - атоммен ең әлсiз байланысқан электронды жұлып алуға жұмсалатын энергия. Бейметалдар атомдарының сыртқы деңгейiнде 4-тен 8 дейiн электрондар болады. Бейметалдың қасиеттердi сипаттайтын шама электронтартқыштық - электрон атомына қосылғанда бөлiнетiн энергия (эВ/атом) .
Байланыс энергиясы - байланыс түзiлгенде немесе үзiлгенде бөлiнетiн не сiңiрiлетiн энергия (кДж/моль) .
Байланыс ұзындығы - атом ядроларының арақашықтығы, бұл кезде атомдардың арасындағы тарту және тебу күштерi тепе-теңдiкте болады.
Диполь моментi - молекула полярлығының өлшемi, ол заряд мәнiн молекуладағы оң немесе терiс заряд центрлерiнiң арақашықтығына көбейткенге тең:
= q r (Дебай, D) .
Металдық байланыс - байланыста әр атомның электрондары металда орналасқан барлық атомдарға қатысты. Молекулааралық арақатынас, полярлы молекулалардың әртүрлi полюстерiнiң электростатикалық әрекеттесуiне байланысты.
Сутектiк байланыс - бiр молекуланың оң зарядталған сутегi атомымен басқа молекуланың электротерiс атомының арасындағы байланыс. Сутектi байланыстың энергиясы (2-10 ккал/моль) коваленттi байланыстың энергиясынан (сутегiмен оттегiнiң коваленттi байланысының энергиясы 110 ккал/моль тең) аз. Сутектiк байланыс энергиясы аз мөлшерiне қарамастан молекулалардың ассоциациясына (бiрiгуiне) мүмкiндiк бередi. Мысалы: спиртте ROH, суда H 2 O көрiнедi.
16 17 18 54 56 ядроның массалық саны
О, О, О, Cr, Fe
8 8 8 24 26 атомның реттiк номерi
Ядролық реакциялар - атомдардың ядроларындағы протондар мен нейтрондардың жаңа элемент түзе отырып ыдырау процесi .
Радиоактивтiлiк - атом ядроларының ыдырауы нәтижесiнде бiр элементтiң өздiгiнен бөлшектер немесе толқындар бөлiп шығаруы .
Изотоптар тұрақты және тұрақсыз болып бөлiнедi. Тұрақты изотоптар радиоактивтiк ыдырауға ұшырамайды. Тұрақсыз изотоптар радиоактивтi. Радиоактивтi заттар үш түрлi сәуле шығарады:
(альфа) , - ыдырау - массасы 4 және заряды +2-ге тең гелий ядросының ағыны, қалыңдығы 0, 01 мм металдан өтiп кетедi.
(бета) - электрондардың ағыны бөлшектерi қалыңдығы 0, 01 м металдан өтiп кетедi.
(гамма) - ыдырау - энергиясы өте жоғары электромагниттiк сәуле шығару.
Тұрақсыз изотоптың жартылай ыдырау периоды T 1/2 - радиоактивтiк бастапқымен салыстырғандағы екi есе азаю уақыты: t 1/2 =0, 693/, мұнда - ыдыраудың тұрақтысы.
- Химиялық процесстердiң энергетикасы
Гесс заңы (1840) реакцияның жылу эффектiсi реагенттердiң және өнiмдердiң агрегаттық күйлерiне тәуелдi, бiрақ жүру жолына тәуелдi емес.
Гесс заңын кез-келген энергиясы өзгере жүретiн химиялық реакцияларға қолдануға болады, ол арқылы химиялық байланыстың кристалл торларының энергияларын, еру жылуын т. б. есептеуге болады.
Түзiлу жылуы Н түз - стандартты жағдайлардағы жай заттардан күрделi заттың 1 молi түзiлгенде бөлiнетiн немесе сiңiрiлетiн жылу. Жай заттардың түзiлу жылуы 0-ге тең болады.
Стандартты жағдайлардағы - қысым 1 атм. немесе 1, 01310 5 Па. Кестелерде 298 К үшiн термодинамикалық өлшемдердiң мәндерi берiлген.
Жану жылуы Н жану - стандартты жағдайлардағы оттегiде заттың 1 молi жанғанда бөлiнетiн жылу.
Гесс заңынан шығатын салдар.
Реакцияның жылу эффектiсi реакцияның өнiмдерiнiң түзiлу жылуларының қосындысынан реагенттердiң түзiлу жылуларының қосындысын алып тастағандағы айырымға тең:
Н реак = Н өнiм. түз. жылу. - Н реаг. түз. жылуы
Реакцияның жылу эффектiсi реакцияның өнiмдерiнiң жану жылуларының қосындысынан реагенттердiң жану жылуларының қосындысын алып тастағандағы айырымға тең:
Н реак = Н жану. өнiм - Н жану. реаг
Ерiтiндiлер концентрациясы
Ерiтiндiлердi сапалық жағынан сипаттайтын ұғымдар: концентрлi ерiтiндi - ерiген заттың көп мөлшерi; сұйытылған ерiтiндi - заттың аз мөлшерi.
Ерiтiндiлердi сандық жағынан сипаттайтын ұғымдар: молярлық, проценттiк (немесе массалық үлес), концентрация, моляльдық.
Молярлық концентрация (молярлық) - ерiген заттың 1л ерiтiңдiдегi моль (М) саны. Ерiтiндiлердiң молярлығы ерiген заттың молярлық концентрациясының сандық мәнiмен, өлшем бiрлiгi моль/л М немесе "молярлы" сөзiмен жазылады. 1М - бiр молярлы ерiтiндi, 0, 1М - децимолярлы ерiтiндi.
Моляльдық - 1000 г ерiткiштегi ерiген заттың моль саны.
Проценттiк концентрация( % ) - 100 г ерiтiндiде ерiген заттың граммен берiлген массасы.
Заттың массалық үлесi - ерiген заттың массасының ерiтiндi массасына (процентпен немесе бiрлiк бөлiгiмен берiледi) қатынасы.
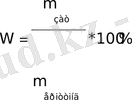
Химиялық реакциялардың жылдамдығы
Химиялық реакцияның жылдамдығы деп көлемi өзгермейтiн жүйеде әрекеттесушi заттардың концентрациясының уақыт бiрлiгiнде өзгеруiн айтады.
аА+вВ
сС+дД
V=
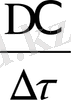
Реакция жылдамдығына әсер ететiн факторлар:
1) әрекеттесушi заттардың концентрациясы
Химиялық кинетиканың негiзгi заңы: әсер етушi массалар заңы:
“Химиялық реакцияның жылдамдығы әрекеттесушi заттардың концентрациясының көбейтiндiсiне тура пропорционал болады”.
=k[A] a [B] b немесе =kC A a C B b
Реакцияның жылдамдығы қатты заттардың концентарциясына тәуелдi болмайды.
2) температураның әсерi. Вант-Гофф ережесi бойынша: “температураны әрбiр 10 0 С жоғарылатса, реакция жылдамдығы 2-4 есе артады”
- реакция жылдамдығының температуралық коэффицентi, =2-4
3) катализатордың әсерi. Катализатордың әсерiн оның әрекеттесушi заттың бiреуiмен аралас қосылыс түзушi арқылы түсiндiруге болады
А+В
АВ
а) А+К= АК
б) АК+В=АВ+К, АК - аралас қосылыс.
Электролит ерiтiндiлерi
1. ¦лсiз электролиттер. Диссоциациялану константасы және дәрежесi.
Суда ерiгенде электролиттердiң оң және терiс зарядталған иондарға диссоциациялануы (ыдырауы) электролиттiк диссоциация деп атайды.
Суда немесе басқа ерiткiштерде ерiткенде полярлы молекулалардан тұратын электролиттер электролиттк диссоциацияға ұшырайды, яғни оң және терiс зарядталған иондарға - катион және аниондарға ыдырайды.
Электролит дегенiмiз электр тогын өткiзетiн зат.
Ерiтiндiде иондарға толық диссоциацияланбайтын электролиттер әлсiз электролиттер деп аталады. Олардың ерiтiндiсiнде диссоциацияланбаған молекулалар мен ионға диссоциацияланған өнiмнiң арасында тепе-теңдiк орнайды.
Мысалы: CH 3 COOH
H + +CH 3 COO -
; K - диссоциациялану константасы
Диссоциациялану дәрежесi дегенiмiз ерiтiндiдегi иондарға ыдыраған молекулалар санының электролит ерiтiндiсiндегi жалпы молекулалар санына қатынасы.
Диссоциациялану константасы мен дәрежесiнiң арасындағы байланысты Освальдтың сұйытылу заңы қарастырады:
 егер диссоциациялану дәрежесi 1-ден кем болса, егер 1-1 болғанда Освальдтың сұйытылу заңы K=
2
C
м
, осыдан
егер диссоциациялану дәрежесi 1-ден кем болса, егер 1-1 болғанда Освальдтың сұйытылу заңы K=
2
C
м
, осыдан
 .
.
Ерiтiндiнi сұйытқан сайын (яғни электролиттiң концентрациясын С м азайтқан сайын) диссоциациялану дәрежесi артады.
Тотығу-тотықсыздану реакциялары
Әрекеттесушi заттардың құрамына кiретiн элементтердiң тотығу дәрежесi өзгере жүретiн реакцияларды тотығу-тотықсыздану реакциялары деп атайды.
Атом, молекула, ионның электрон беру процесiн тотығу процесi (тотығу дәрежесi жоғарылайды), электрон қосып алу процесiн тотықсыздану процесi (тотығу дәрежесi төмендейдi) деп атайды. Тотықтырғыш - электрон қосып алушы бөлшек, тотықсыздандырғыш - электрон берушi бөлшек.
Тотығу-тотықсыздану реакцияларын теңестiрудiң екi әдiсi бар: электрондық баланс және электронды - иондық теңдеу (жартылай реакция) әдiсi.
Тотығу-тотықсыздану реакциялары үш түрге бөлiнедi:
1. Молекулааралық тотығу-тотықсыздану реакциясында тотықтырғыш пен тотықсыздандырғыш әртүрлi заттар болады:
2HNO 2 +2HI=2NO+I 2 +2H 2 O
2. Молекулаiшiндiк тотықтырғыш пен тотықсыздандырғыш бiр заттың құрамына кiредi:
(NH 4 ) 2 Cr 2 O 7 =N 2 +Cr 2 O 3 +H 2 O
3. Диспропорциялану тотықтырғышта, тотықсыздандырғышта бiр элемент атомы болады.
3HNO 2 =HNO 3 +2NO+H 2 O
Тотығу-тотыңсыздану реакцияларының теңдеуiн құру әдiстерi
а) электрондың баланс:
Na + Cl 2 NaCl
Na 0 -e Na + -
Cl 2 + 2e 2Cl -
2Na+Cl 2 2NaCl
2
1
Fe 3 O 4 + Al Al 2 O 3 + Fe
Fe +2 + 2eFe
2Fe +3 + 6e2Fe
Al-3e Al +3
+8e
-3e
3
8
3Fe 3 O 4 + 8Al 4Al 2 O 3 +9Fe
10NH 4 ClO 4 + 8P = 5N 2 + 5Cl 2 + 8H 3 PO 4 + 8H 2 O.
2N 3- -6e N 2
2Cl +7 + 14e Cl 2
P - 5e P +5
+8e
-5e
5
8
б) электронды- иондық баланс әдiсi:
1
2Br - - 2e - Br 2
1
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz