Кендітермиялық электропештерде титан қождарын балқыту технологиясы мен құрамдық-қасиеттік ерекшеліктері


МАЗМҰНЫ
КІРІСПЕ
1 ТЕОРИЯЛЫҚ БӨЛІМ 1. 1 Кендітермиялық пештрде титан қождарын қорыту
1. 2 Титан қождарының құрамы мен қасиеттері
1. 3 Титан қождарының өндірісі
1. 4 Кендітермиялық пеш
1. 5 Флюс қоспасымен балқыту
2 ЕСЕПТЕУ БӨЛІМІ
2. 1
ҚОРЫТЫНДЫ
ҚОЛДАНЫЛҒАН ӘДЕБИЕТТЕР ТІЗІМІ
КІРІСПЕ
Титанның латынша аты - Titanium, ол - периодтық системаның 4 тобының элементі, оның реттік нөмірі - 22, салыстырмалы атомдық массасы - 47, 90; табиғи титанның тұрақты бес изотопы бар. Бұдан басқа бірнеше жасанды радиоктивті изотоптары да белгілі. Титан - жер қыртысында кең таралған элемент, оның жер қыртысындағы массалық үлесі - 0, 61 пайызды құрайды. Табиғатта 170-тен астам минералдар құрамынан титан кездеседі. Ол алюминий, темір және магний элементтерінен кейінгі ең кең таралған металдарға жатады. Құрамында титан бар көптеген минералдардың ішінен өндірістік мағынасы бар тек екі минерал: рутил TiO 2 және ильменит FeTiO 3 . Титанды негізінен ильменит, рутил, ропарит, титаномагнетит сияқты минералдар құрамынан алады. Сонымен қатар жануарлар мен өсімдіктер организмінде де титан кездеседі.
Титан - күміс түсті, ақ метал, оның тығыздығы - 4505 кг/м 3 , балқу температурасы - 1668, +5 0 С. Титан екі түрлі полиморфтық модификацияда кездеседі: α-титан формасы - 882 0 С-ге дейін, ал β-титан - одан жоғары температурада болатын металл түрі. Оның екі түрлі болуының негізгі себебі ішкі атомдық құрылыс торына байланысты.
Титан қосылыстарында негізінен +5 валентті, кейде +3, +2 валентті. Қалыпты температурада титан өте тұрақты, қыздырғанда оттегінде жанып, оксидке TiO 2 айналады, ол - ақ түсті ұнтақ зат, химиялық инертті, сұйық қышқылдар мен сілтілерде ерімейді. Титан қыздырғанда сутегімен әрекеттесіп - гидрид TiH 2 , азотпен әрекеттесіп - нитрид TiN, көміртегімен әрекеттесіп - TiC түзеді. Титан (4) оксиді - амфотерлі, оның гидроксиді Ti(OH) 2 , титан тұздары титанаттар деп аталады. Титан жоғары температурада қыздырғанда кремниймен әрекеттесіп, силицидтер, бормен әрекеттесіп, боридтер түзеді. Титан сілтілерде және азот қышқылында ерімейді, қалыпты жағдайда балқытқыш қышқылда, тұз, фосфор және органикалық қышқылдарда ериді.
Титан өндірісі әр түрлі темір-титанды концентраттарды байытылған титан диоксидінің кендітермиялық электропештерінде өңдеуге негізделген. Кенді-қалпына келтіру балқытылуының нәтижесінде титан қожы мен шойынға жуық темір түзіледі.
1 Кендітермиялық пештрде титан қождарын қорыту
Металды титанды өндіру әр түрлі темір-титанды концентраттары байытылған титан диоксидінің қождарын ашық немесе жабық типті кендітермиялық пештерінде өңдеуге негізделген.
Балқыманың кейбір қасиеттеріне байланысты (кеуектілігі мен балқу температурасының жоғарылығы, тұрақты температурада кеуектіліктің тез өзгеруі және т. б. ) жоғарытитанды қождарды қорытуды электродоғалы пештерде жүргізген жөн.
Титан мен темірдің толық ыдырауынан екі тауарлы өнім - титан қожы мен легірленген шойынды алу шикізатты комплексті қолданудан болады.
Титан қожы мен шойынды периодты түрде пештен құймақалыпқа құяды. Қож құймаметалы баяу суыту кезінде интенсивті түрде бүліне бастап, ірі дәнді ұнтаққа айнала бастайды. Бұл процесс төменгі титан оксидтің оттегі ауасымен қышқылдануымен және қождағы кристалды торларының ауысумен байланысты. Осының нәтижесінде қожда титанның болуы төмендейді.
Тотықсыздандыру реакциясының жеңілдетілген түрін келесідегідей көрсетуге болады:
Ильменит: 3(FeO*TiO 2 ) +4С═ 3 Fe+ Ti 3 O 5 +4СО (1)
Аризонит: 3(Fe 2 O 3 *nTiO 2 ) +10С═ 6Fe+ nTi 3 O 5 +10СО (2)
Шынына келгенде концентрат, аралық және соңғы өнімдердердің құрамы MgO, MnOжәне басқа да тотығу қоспаларының болуынан күрделі және де бұл қосылыстардың арасында қатты ерітінділердің түзілуіне байланысты.
Ильмениттен жасалған темірдің тотықсыздану жылдамдығына көміртекті реакциялық қабілеттілігі айтарлықтай әсерін тигізеді (Кесте 1) .
Кесте 1- ильменитті концентраттан жасалған темірдің тотықсыздану дәрежесі
Ильмениттің тотықсыздандыру процесінің қосындысын келесі сұлбалармен көрсетуге болады:
nFe 2 O 3 · nFeO·TiO 2 ═ FeО·TiO 2 · Ti 2 O 3 + nFeO·2TiO 2 · (nFe 3 Ti) 2 О 3
+ TiO 2 + Fe (3)
Тотықсыздану процесі интенсивті түрде 1100 0 С температурасында жүреді.
Аризониттік концетратының қалпына келуі кезінде ильменит аралық өнім болып табылады. Титанның екілік тотығының қалпына келуі бірқатар аралық қосылыстар арқылы жүреді:
TiO 2 → Ti 3 O 5 → Ti 2 O 3 → TiO→ TiC (4)
Балқыту ұзақтығын өсірген сайын екілік титан тотығының құрамы 90℅-ке дейін жетеді және темір шалатотығының құрамы төмендейді (сурет 3 және 4) .
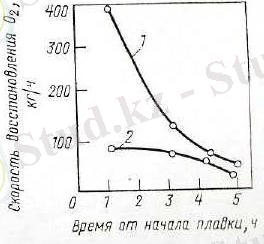
Сурет 3- темір тотығы (1) және титан (2) балқу кезіндегі тотықсыздану жылдамдығының өзгерісі
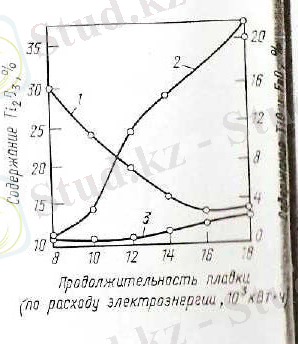
Сурет 4- балқу процесіндегі титан қожының химиялық құрамының өзгеруі:
1- Ti 2 O 3 2- TiO 3- FeО
Темірдің активтілігі мен жылдамдығы оның қалпына келуі FeО концентрациясының азаюына байланысты төмендейді. Титанның төменгі тотықтары концентратта болатын темірдің шалатотығымен бөлшекті түрде тотығады. Осыған байланысты балқымадан екілік титанның қалпына келуі екілік титанның молекулярлық қатынасы темір шалатотығына жақындағанда басталады (Сурет 5) .
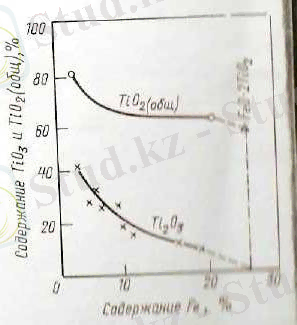
Сурет 5- FeО және Ti 2 O 3 -тің қалпына келу процесіндегі қожының құрамдық қатынасы.
Балқыған күйіндегі темір - титан концентратының 1500 0 С температурадағы электроөткізгіштігі 20-25 Ом -1 ·см -1 ; 1800 0 С температурадағы электроөткізгіштігі 59, 2 Ом -1 ·см -1 . FeО құрамы азайған сайын қождардың электроөткізгіштігі төмендейді. Мысалы, FeО-ның құрамы 3, 77 ℅-ке тең, балқу температурасы 1800 0 С болса электроөткізгіштігі 171, 5 Ом -1 ·см -1 -ге тең (Сурет 6) .
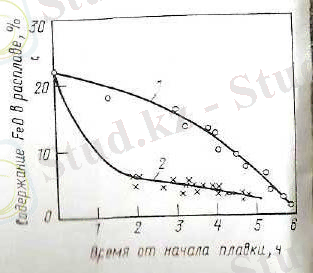
Сурет 6- титан қождарының температураға байланысты өзгеруі.
1- FeО 3, 77 ℅ соңғы қож
2- FeО-ның құрамы 10, 67 ℅ тең қож
3- концентрат.
2 Титан қождарының құрамы мен қасиеттері
Титан концентраттарындағы қождың құрамы Кесте 2-де көрсетілген. Бұл мәліметтер қождамасыз балқытуға жатады.
Кесте 2- титан қождарының әр түрлі шикізатта қождамасыз балқытылатын қарапайым құрамы
Темір қождарында шалақождардың болуы, қождамасыз балқыту кезінде төмен құрамды қожды алуға болатынын көрсетеді. Бірақ рутилденген ильменитті концентратта балқытылған қож бұлардан өзгешеленеді. Өнеркәсіптік шартта алынатын жоғары титанды қождардың ішінде кристалл түріндегі тұрақтырағы аносовит болып келеді. Аносовит құрамына титанның барлық валенттіліктегі иондары кіреді, ал екі және үш валентті иондарын басқа металдармен (мысалы, Mg 2+ , Fe 3+ және басқалар) ауыстыруға болады. Кальций мен кремний иондары аносовиттегі титан иондарын ауыстыра алмайды, себебі олардың иондарының радиусы титандікінен анағұрлым жоғары.
Егер Ti 3 O 5 торында аносовит түзілсе, онда қалпына келудің келесі сатысында ромбэдрикалық тор негізінде жаңа минерал - Ti 2 O 3 тагировит түзіледі, оның формуласы келесідегідей:
m{(Mg, Fe, TiO ) О· TiO 2 }·n(Fe, Al, Ti) 2 О 3 (5)
Ол қатты ерітінді. Тагировитте титан өзіне тән үш валентілікті және тагировит торларына титанға жуық металдардың екі, үш валенттілерінің радиустары кіреді. Тагировитті қалпына келтірген кезде Ti(О, С) типті қатты ерітінділері қалыптасады.
Байытылған титан қождарның сипаттамалы қасиеті- олардың ауада суытқанда өздігінен ыдырауы.
3 Титан қождарының өндірісі
Ильменитті концентраттарды ТіСl 4 алу үшін тікелей өндіру экономикалық тұрғысынан шамамен тиімсіз. Оның себебі хлоридті металл мен көптеген басқа металлдар қоспасының пайда болуына қымбат бағаланатын хлордың шығыны мен хлорлы қалдықтардың өндірісін кәдеге асыру қиыншылықтары мен бірге хлор регенерациясы. Ильменитті концентраттарды байыту үшін кендітермиялық қалпына келтіретін электрлік балқытуды қолданады. Бұның нәтижесінде шойын құрамына жақын құрамында ТіО 2 >80% және металл болатындай титан қожын алады.
Ильменитті концентраттың тотықсыздану типінің жүру механизмі келесі теңдеулермен көрсетіледі:
Fe 2 O 3 ·3ТіО 2 +3C=2Fe+3ТіО 2 +3CO (6)
2(Fe 2 O 3 ·3ТіО 2 ) +9C=4Fe+3ТіО 2 +9CO (7)
Fe 2 O 3 ·3ТіО 2 +4C=2Fe+3Ті 3 О 5 +4CO (8)
Fe 2 O 3 ·3ТіО 2 +3CO=2Fe+3ТіО 2 +3CO 2 (9)
Ал ильменитті концентраттардың тотықсыздандырғыш типіндегі теңдеулер:
FeO·ТіО 2 +C=Fe+ТіО 2 +CO (10)
2(FeO·ТіО 2 ) +3C=2Fe+Ті 2 О 3 +3CO (11)
3(FeO·ТіО 2 ) +4C=3Fe+Ті 3 О 5 +4CO (12)
FeO·ТіО 2 +CO=Fe+ТіО 2 +CO 2 (13)
Тотығу реакциясы барысында титан қожына титан оксидтері мен бірге концентрат құрамында СаО, МgO, Al 2 O 3 , Cr 2 O 3 , MnO және SiO 2 біртіндеп кездесетін басқа металдардың оксидтері өтеді.
Тотықсыздандыру кезіндегі балқуды үшфазалы электрлік доға пештерінде жүргізеді. Пештегі жылу көзі ток жүргендегі металл мен электрод арасындағы пайда болған электрлік доға болып табылады.
Титан қожының кендітермиялық балқуының ерекшеліктері келесідей:
- Титан қожының балқу температурасы (1600-1800ºC) концентраттың балқу температурасынан айтарлықтай жоғары болады, сондықтан да тотықсыздандыру процесін қамтамасыз ету үшін және жоғары температуралы балқыманы сұйық күйінде ұстап тұру үшін көп мөлшердегі жылу энергия қажет.
- Балқымадағы төменгі тотығу дәрежесін көрсететін титан оксидтерінің балқу температурасы, тұтқырлық және балқыманың электрлік өткізгіштігі көтеріледі; пеш біртіндеп доғалы режимге өтеді.
- Балқытылған титан қождары химиялық агрессивтілікпен сипатталады. Ол ТіО2және оның төменгі тотығу дәрежесі көрсететін оксидтерінің жоғарлаған концентрация мен келісілген; пеш шегендеуін тез арадағы бұзылудан сақтап қалу үшін былаудың қабырғаларына қайта тотықсыздандырылған қождан гарнисаж өсіреді.
- Шикіқұрамның ажыратылуы кезінде пеш колошнигінің жоғарғы учаскелерінде қождың қайнауы жүргізіледі. Шикіқұрам жоғары температуралық қождың балқымасына түсіп, тез арада қыздырылады және тотықсыздандырылады; осыдан көп мөлшерде бөлінетін реакционды газдар көпіршіктенеді де, көлемде ұлғая және пеш колошнигіне көтеріле қайнайды, ал кейде оны құя жүреді; қождың қайнауы қождың қалпына келер алдындағы пеш былау антрацитына бергендегі периодта байқалады.
Балқыту процесі периодты, сонымен қатар пеш жабық және жартылай жабық режимдерде жұмыс істей алады.
Жетілдіре түскен жабық режим тотықсыздандыратын балқыманың ағуы болып табылады. Бұл балқу тотықсыздандыру рөлін атқаратын ауаны сормай жүруі және колошникті құрамында газдардың жоғарғы (80-90%) СО түзеді.
2(Fe 2 O 3 ·3ТіО 2 ) +6CО=4Fe+6ТіО 2 +6CO 2 (14)
FeO·ТіО 2 +CO=Fe+ТіО 2 +9CO (15)
Осы тәсілмен алынған титан қожы құрамы мен ірілені бойынша келесі талаптарды қанағаттандыруы керек:
ТіО 2 , 80 % кемінде,
FeO, 5 % артық емес,
Металдық кірмелер 4 % артық емес,
Ылғалдылық 8 % артық емес,
Ірі бөлшектер 200 мм артық емес.
Кесте 4 - титан қождарының компоненттерінің құрамының шегі әртүрлі типті концентрациялармен алынған көрсеткіштер
Көрсетілген компоненттерден басқа титан қождарында міндетті түрде сирек жер металдар, цирконий, тантал, ниобий және т. б. әртүрлі оксидтерінің саны болады.
4 Кендітермиялық пеш
Ферробалқыту кезінде қолданылатын пештермен салыстырғанда, бұл пештердің қабырғаларын шегендеу кезінде көмірлі блок қолданылмайды. Бұл титанды- қожды балқыту барысында көміртекті төменгі құрамды шойынды алуымен түсіндіріледі.
Шойынның химиялық активациясы, карбид түрінде кездесетін титанның біраз болуымен анықталады. Ол шегендеу тотығымен қатынасқа түсіп, оларды қалпына келтіреді. Сондықтан тәжірибе жүзінде ысытылған шойын мен пештің шегендеуін бір-біріне тигізбеуге тырысады. Табаншаның қорғанысы үшін шойынның төмендетілген былауын сақтайды.
Пеш шахтасының өлшемдері - диаметрі 4 м, ұзындығы 1, 6 м және де қабырғалары кертпешігі жоғары болып істелген.
Шығарылым ағынөзегі табанның төменгі нүктесінен 310 мм-ге жоғары орналасқан. Қалыңдығы 700 мм -лі пеш, қабырғаларының ұзындығы 1, 4 м табаншаға тиенеді.
Пеш колошнигінің астында жүктемелі құрылғылар орналасқан. Бұл жүктемелі құрылғылар үш бункерден тұрады, олар газдарды тартылым қалпақшаларына шығарады.
Шегендендірілген пеште қожды қайтадан балқыту үшін, оны дұрыстап кептіру керек.
Табаншада отынды жағу кезінде, қалауды 4-5 кундей кептіреді. Пеште жылуды сақтап қалу үшін пеш шахтасын жоғары жағынан жабады.
Кептіру процесінен кейін қалауды графитирленген электрод арқылы ток берумен түйрелейді. Кейін пешке 0, 5 м-ден аз емес қалыңдықты коксты салады, одан әрі арнаулы график бойынша жүктемені ақырындап үлкейтіп, электродтарға тоқ береді. Тоқты бүкіл қалаудағы температураны қалпына келтіру үшін периодты түрде өшіріп отырады.
Пешті электр тогымен қоректендіру үшін ЭТЦП 7500/6 м типті трансформатор қолданылады. Ол бес сатылы кернеуден тұрады. : 133, 5; 118; 106; 96, 5; 89 в және 500-600 мм диаметрлі графитирленген электродтар қолданылады. Электродтардың электр кедергісі 8-14 ом. мм 2 . м -1 , тығыздығы 1, 6-1, 8 г/см 3 , ал жіберілім тығыздығы 12-30 а/см 2 .
Кендітермиялық пештерде өздігінен күю электродтары қолданыста. Қарастырылып отырған пештің құрылымында графитирленген электрод бірнеше бөліктен тұрады.
Кендітермиялық пештер үшін ілгіш типті электроұстатқыштарды қолданады, сонымен қатар консольді электроұстатқыштар да кездеседі. Берілген электроұстатақыштың негізгі жауапты желісі - электродты қысқыш. Оның жақсы магнитті изоляциясы болуы керек. Егер жақсы магнитті изоляциясы болса, электр жоғалулары төмендейді.
Пешке пеш трансформаторынан шығатын электр тогы қысқа желі арқылы жіберіледі, ол 3 бөліктен тұрады. Трансформатордан тоқ шинды пакет арқылы, ары қарай иілім бөлігі арқылы, иілім бөлігінен электроұстатқыштың беттеріне беріледі.
Кендітермиялық пеші тіктөртбұрышты және іргетастан, табаннан, қабырғаларынан, күмбезден, сыртқы қабаттан, қаңқадан, электродтар жүйесінен, электродтарды қысу және түсіру механизмдерінен, пеш трансформаторынан, колошник құрылғысынан, тетіктерден тұрады.
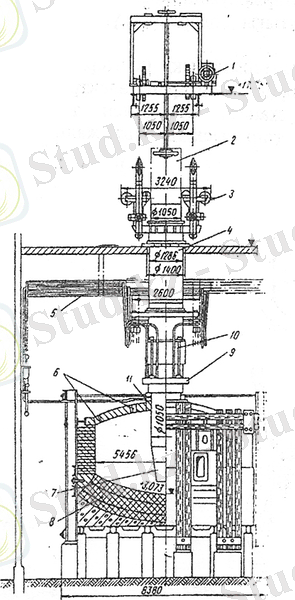
Сурет 7- Кенді-термиялық пеш:
1- лебедка; 2- электродтардың сыртқы қабаты; 3- тежегіш; 4- мантель; 5- электр сымдары; 6-шихта салуға арналған тесіктер; 7- электрод; 8- пештің табаны; 9- электр қысқыш; 10- су құбырлары.
Пештің іргетасының бас жағы жеке тіреулер түрінде жасалған. Тіреуге болат арқалықтар мен болаттан құйылып жасалған тақтайшалар төселіп, оның үстіне пештің 8 табаны жиналады.
Шихта салуға арналған 6 тесіктер күмбездің екі жанында бір немесе екі қатарға орналастырылған. Тесіктерге орнатылған құбырлардың диаметрі 250-300 мм. Шихта пештің үстіңгі жағында орналасқан шанақтардан, таспалы және тырнағыш конвейерлер арқылы күмбездің екі жанында орналасқан құбырларға салынады.
Пештегі шихтаның балқуы электродтар мен шихта арасындағы электр доғасының жылуы нәтижесінде жүреді. Үш немесе бір фазалы ток электродтарға арнайы пеш трансформаторынан келеді. Пештердің қуаты 45 мың КВА шамасына дейін болуы мүмкін.
Электрод ұстағыштар кенді-термиялық пештердің ең маңызды торабының бірі болып саналады. Серіппелі гидравликалық электродтарды қысатын 4 сақина суытылатын құбырлы салпыншақтар арқылы көтергіш 1 цилиндрдің астыңғы сақинасына бекітіледі. Көтергіш циллиндр қалыңдығы 10-16 мм жапырақты металдан иіліп жасалады және электродтар осы цилиндр ішімен өтеді. Цилиндрдің диаметрі электродтардың диаметрінен 150-200 мм артық, себебі екеуінің арасынан ауа өту қажет.

Сурет 8- Электр ұстағыштың құрылысы
Траверса 8 қозғалмайтын 6 плунжер бойымен қозғалатын гидроцилиндрге бекітілген. Көтергіш 3 цилиндрдің және 1 электродтың тік қозғалысын төрт роликтері бар бағыттаушы 4 цилиндр қамтамасыз етеді. Гидроцилиндрлерге май берген уақытта 8 траверсамен бірге электрод ұстағыш пен электродтарды түсіру механизмі де қозғалады.
Пеште пайда болған газ күмбездің төрт бұрышына орнатылған құбырлар арқылы шығарылып, тазалауға жіберіледі.
Шлак пештің шлак жағындағы тесіктен, ал оған қарама-қарсы жанындағы шнурлы тесіктен штейн шығарылады.
6 Флюс қоспасымен балқыту
Кендітермиялық электропештерінде байытылған титанды қожды балқыту кезіндегі қождың негізгі ерекшелігі - оның электроөткізгіштігі. Титанды қождардың балқытылуының жоғарғы температурасы (1700 0 С-ден жоғары ) және де оның тез қатуы балқыту процесін қиындатады. Қождың жоғарғы электрөткізгіштігімен бұл процестер одан әрі ұлғаяды.
Титанның төменгі тотығы силикатты қожбен салыстырғанда 100 есе үлкен электрөткізгіштік қасиетке ие.
Жұмыстар берілгендері бойынша, құрамында 15℅ FeO бар және 85℅ TiO 2 бар қождың 1700 0 С температурасындағы электрөткізгіштігі 110 ом -1 . см -1 , ал 5℅ FeO бар және 85℅ TiO 2 кезінде 130 ом -1 . см -1 .
Электрөткізгіштігі мен температурасының жоғарымдылығы қожды балқытудың тиімді жолдарын іздеуге әкеліп соғады. Аз мөлшерде әкті қосу, балқыту температурасымен қождың электрөткізгіштігін төмендетеді.
4-5℅-ке дейін кальций тотығын қосқанда, титан құрамды қождың электрөткізгіштері төмендейді.
TiO 3 құрамының кальций тотығының әр түрлі құрамында өсуі, балқыту температурасымен бұл жүйенің созылмалылығын өсіреді. Бірақта кальций тотығын қосқанда бұл параметрлер төмендейді.
Егер де магний тотығын қоссақ та, электрөткізгіштік төмендейді.
Флюс ретінде әктің қосылуы өндірістік пештердегі балқытуларда тексерілген.
Флюс ретінде әк пен соданың қоспасын алған. 2-3 ℅соданы қосқанда титанның толық құрамы шығады, ал әкті қосқанда қождың балқу температурасы төмендейді. Флюс ретінде доломит қосылса, созылмалылық пен қождың балқыту температурасы өседі.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz