Титан қожын хлорлау: теориялық негіздер, кинетика және технологиялық жобалау


Жоспар
2 Титан қожын хлорлау
2. 1 Хлорлау процесінің теориялық негіздері
2. 2 Хлорлау процессiнiң негiзi
2. 3 Қайта тотықсыздандырусыз хлорлау
2. 4 Хлорлаудың микрокинетикасы
2. 5 Хлорлаудың макрокинетикасы
2. 6 Хлорлау процессінің техналогиясының жобасы
3 Есептеу бөлімі
Қорытынды
Қолданылған әдебиет тізімі
1 Кіріспе
Қазiргi уақытта титан - ең негiзгi құрылымдық материалдардың бiрi. 1791 жылы ағылшын химигi және минеролог Вильям Грегор минералдағы жаңа элемент менакканиттi ашып, оған «менаккин» деген атау бердi. Немiс химигi Мартин Клапрот 1795 жылы екiншi рет рутилла минералында жаңа элементтi ашып, оны әдемi «титан» деген атаумен атады. Бұл атау ежелгi грек аңызынан алынған. Екi жыл өткеннен кейiн Грегор және Клапроттың ашқан элементтерi бiрдей екенi анықталып, содан берi ол титан деп аталды. Көптеген ғалымдар титанды таза күйiнде алуға тырысты, тек 1875 жылы орыс ғалымы Д. К. Кириллов бiрiншi рет титанды азғана % қоспалармен алды. 1910 американ химигi Хантер бiрнеше грамм таза титанды, азғана қоспа құрамымен алды және де бұл құрам ары қарай өңдеуге келмейтiнiн көрсеттi. Дегенмен титан тұздары ендiгi қолданыс аясында болды. Тек 1925 жылы голланд ғалымы Ван Аркелем и де Буре жоғарғы құрамды титанды алып, оның керемет қасиеттерiн: жоғарғы пластикалылығын, берiктiлiгiн, қаттылығын, тоттықсыздану тұрақтылығын көрсеттi.
Титан - баяу еритiн металл, бiрақ көптеген металл және бейметаллдармен өзара байланыста болады. Титанның көп элементтерiмен байланыста болуы, бiр жағынан таза титанды алуға кедергi болса, басқа жағынан құрамы бойынша көптеген қоспалар алуға болады.
Титан жоғары пластикалық құрамалы материал. Жоғары технологиялық пластикасына қарай, әртүрлi әдiспен өңдеуiне байланысты, жартылай фабрикаттарды және өнiмдердi дайындауға болады. Олар плиталар, сымдар, құбырлар т. б.
Таулы қыраттарда, жер қабаттарында көптеп кездесетiн, кеңiнен тараған химиялық элементтердiң бiрi титан. Жер қабатының көп бөлiгiнде титан құрамының 80 түрiнен астам минералдары белгiлi. Титан минералының маңыздылары негiзгi құрамды 5 топқа жатады - рутилла, ильменит, перовскит, ниоботанталотитан, сфен. Осылардың iшiнде рутилла және ильменит топтары маңызды орын алады. Титанды минералдар - ильменит, рутил, сфен - шашыраңқы күйiнде барлық тип түрлерiнде кездеседi. Магматикалық және эффузиялық, метаморфиялық кешен түрлерiнде (гнейс, амфиболит, слюд), сонымен қатар тұнбалы түрлерiнде, әсiресе, сары топырақ, боксит, құм және құм қиыршықтар құрамында болады. Титан минералының бiрқатары магматогендi процесстер байланысымен қалыптасып, қортындысында бұл металлдың минералдары темiр мен оттегi және аз мөлшерде кальций және кремниймен түзеледi.
2 Титан қожын хлорлау
Титан қожын хлорлау шахталы хлораторлардап, қайнау қабаты пештерінде немесе хлор еріткіш пештерде жүргізілуі мүмкін.
Шахталы хлораторлар шартты түрде мынандай 3 зонадан тұрады:
- төменгі зона
- орталық зона
- жоғарғы зона
Төменгі зонада температура шамамен 700°С. Бұл зонада хлорланбаған кесекшелер және оның қалдықтары болады. Хлорлаудың қалдықтары кокс, кремниземнің аз шамасы жене алюминий тотығы, сонымен қатар титан қожы болады. Титан қожын көп мөлшерде магнимен хлорлауда төменгі зонада кальций мен марганец түзіледі. Еріткіштерді сұйық күйде сақтап тұру үшін шахталы хлораторлардың төменгі бөлігін электр тоғымен қыздырады. Титан қожы аз ғана мөлшерде болса, электр тоғымен қыздырудың қажеті жоқ.
Жоғарғы зонада хлорланбаған қалдық негізгі хлорлауыштаорналасады. Бұл зонада температура 900-1200° қа деін жетеді. Әдетте жоғары температурада бұл зона шахталы хоратордың өндіру процесін дәлелдейді.
Орталық зонада хлорлау процесі титанның екі тотығымен және аз тотығымен түзіледі. Олар аносовиттің құроамында болады. Хлорлаудың биіктік зонасы температурадан, хлор беру жылдамдығынан және кесекшелердің хлорлау жылдамдығына тәуелді. Жоғарғы зонаның биіктігі хлорлау кезінде көбейеді, ал жылдамдығы жоғарылаған сайын хлор беру сонымен қатар кесекшелердің өлшемдері т. б өзгеіске ұшырайды.
Негізгі хлорлау зонасының үстіңгі жағында қыздыру зонасы орналасқан. Бұл зонада кесекшклердің хлорлауға түсу температурасы 700-800°-қа дейін. Осы зонада титан қожына кіретін тотықтар активті жүреді. Нәтижемінде FeO, MnO, CaO, MgO, Cr 2 O 3 , TiCl 4 - тің әсерінен титанның екі тотығы түзіледі. Бұл зонаның төменгі бөлігінде әр түрлі қосылыстармен (оксид) байланысуы мүмкін.
Қайнау қабатында титан қожын хлорлау қазіргі кезде көптеген қызығушылықтар туғызуда. Бұл әдіспен хлорлау тиімді және шикіқұрам дайындау жоғары өнімділігі артады. Қайнау қабатында хлорлаудың кемшіліктері де бар. Ол - прорцесс кезінде шаңның көп шығуы, сонымен қатар титан қожын өндіруде қиыншылықтар туындауы мүмкін. Оның себебі, Mg мен Ca - дың көп мөлшерде болып келуі.
Мачкасов және оның тобы титан қожын қайнау қабатында хлорлауды түйіршікті әдісін пайдаланған. Титан қожының мұндай қосылысының түйіршіктері тарелка тәріздес. Алынған түйіршіктер өлшемі 5-10 мм, ал кокстау және кептіру температурасы 800°С. Авторлар мынаны көрсетеді, түйіршікті титан қожы қайнау қабаты үлдкен реакторларда қанағаттанарлықтай хлорланады. Осындай әдіспен қожды хлорлауға болады, егер де құрамындағы көміртегін 5-43% -ке дейін арттырса.
Озық әдіспен титан қожын хлорлау хлорды балқытуда жүргізіледі. Бұл әдіс кеңес үкіметі кезінде С. П. Слояковтың жетекшілігімен ашылады. Хлориттерді балқытуда интнсивті титанның тотығуы жүреді, сонымен қатар қож құрамындағы басқа металдың да тотығуы жүреді. Балқыту температурасы 800°С иемпературасында тұрады,
Бұл әдістің негізгі артықшылығы - кесекшелеу және кокстау. Кекмшілігі - шығатын газдың TiО 2 үлкен шығынға ұшырап, сонымен бірге хлориттердің көп мөлшердегі қалдығының шығуы.
2. 1 Хлорлау процесінің теориялық негіздері
Ме + СІ 2 МеСІ 2 (1. 1)
Ме х О У + у СІ 2 хМеСІ 2у/х + у/2О 2 (1. 2)
Бірінші реакция - хлорлау, ал екіншісі - ауыстыру реакциясы. Оксид аз болып хлорланған кезде хлордың үлкен валенттігіне дейін байланысады.
1. 1 және 1. 2 реакция қайтымды. Олардың бағыты химиялық шығымның беріктігіне және өнім реакцияларына және температураға байланысты. Оларды тепе-теңдік константасының К р ықтималдығы Гиббс энергиясының өзгерісімен байланысты:
ΔG° T = ΔΗ° T - S° T = - RTInKp,
мұндағы ΔΗ° T және S° T - энтальпия мен энтропия өзгеру процессі;
Т - процесстегі абсолют температура.
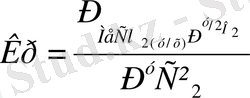 (1. 2) реакция үшін
(1. 2) реакция үшін
мұндағы р - шығымға ұшыраған заттың және реакциядан шыққан өнімнің парциал қысымы.
Ме х О у + уСІ 2 + (у/2) С х МеСІ 2(у/х) + (у/2) СО 2 (1. 3)
Ме х О у + уСІ 2 + уСО 2 х МеСІ 2(у/х) + уСО 2 (1. 4)
(1. 3) - (1. 4) реакцияларының энергетикасы оттегі мен көміртегінің өзара байланысына қарай және температураға байланысты анықталады. Өнеркәсіптік хлорлауыштарда хлорлау процессі 800°С - та жүреді және СО 2 түзіледі. Термодинамикалық ықтималдық реакцияларынан титан шикізатының компоненттерін активтігіне қарай келесі қатарларға бөлуге болады:
СаО > МnO > FeO > V 2 O 3 > MgO c > Al 2 O 3 > TiO 2 > ZnO 2 > Cr 2 O 3 > SiO 2 .
Процесс максималды хлорлану болғандықтан, титан диоксиді, TiO 2 - ге дейінгі оксидтер толығымен хлорланады. Цирконий оксиді, хром және кремний аз мөлшерде ғана хлорланады. Бұл заңдылық хлорлауда да және қалпына келтіру процессінде де дәл заңдылық.
Хлорлау реакциясының интенсивтігі хлорланатын оксидтердің және хлор малекуласының химиялық активтілігімен анықталады. Хлорлау реакциясында хлордың диссосацияланған молекуласы қатыса алады. Хлор молекуласын диссосациялау энергияның белгілі бір бөлігін жоғалтумен жүзеге асырылады.
2. 2 Хлорлау процессiнiң негiзi
Титан шикiзатын хлорлау үшiн негiзгi химиялық элементтiң бiрi - хлор.
Хлор(Cl) - Менделеев периодтық жүйелiк элемент кестесiнде 7 топтың химиялық элементi, кезектi номерi 17, атомдық массасы 35, 453. Қалыпты жағдайда бұл өткiр ерекше иiсi бар жасыл - сары екi атомды газ (Cl 2 ) . Газ тәрiздес хлордың тығыздығы р=3, 214г/см 3 (ауадан 2, 5 есе ауыр) ; жылу өткiзгiштiгi һ =7, 8*10 -5 Дж/(см*с* 0 С) 0 0 С-та; t қай = 34, 1 0 С.
Хлорлы қышқыл оттегi мен тұз қышқылында жеңiл еридi. Сумен бiрге хлор құрамының дезинфекциялау және ағарту қасиеттерi осы негiзде құралған.
Газ тәрiздес хлор бейорганикалық суы жоқ ерiткiштермен: CCI 4 , TiCI 4 , SiCI 4 , SCI 4 салыстырмалы жақсы еридi. Хлор химиялы белсендi болғандықтан, көптеген металл және металл еместермен байланысып, хлоридтер түзейдi.
Азот, оттегi, көмiртек, көмiртек диоксидiмен тiкелей байланыса алмайды. Қалыпты жағдайға сәйкес суы болмаған кезде темiрмен де байланыспайды, сондықтан да хлорды болат баллондарында тасымалдайды.
Хлор сiлтiлермен суықта өзара әрекеттесiп, хлоридтер, гипохлоридтер түзейдi, ал жылыту барысында - хлоридтер және хлоратор түзейдi. Аммиак және сутегi (4%Н) қоспаларымен хлор өзара әрекеттессе, жарылу қаупiн төндiру мүмкiн. Аммиакпен хлор NCI 3 қалыптастырып, байланысады. 0, 2 % NCI 3 құрамды сұйық хлор жарылғыш қасиетiн құрайды.
Сұйытылған күйiнде болат цистерналарында, бөшкелерде немесе баллондарда тұтынушыларға әкелiнедi. Титан шикiзатын хлорлау барысында бiрнеше қоспалар қалыптасады, олар екiншi хлорлау агенттерi болып табылады және хлорлау процессiне белсене араласады: хлорид сутегi, фосген, күкiрт дихлориды, көмiртек тетрохлориды.
Хлорлау - жеке зат түрiнде хлороксидтер немесе хлоридтермен қосылуы, элементтермен хлордың еркiн немесе байламды iс-әрекетi.
Титан өндiрiсiнде хлорлауды қолдану сәттi технологиялық шешiм болып табылады. Хлорлау реакциясының белсендiлiгi хлорланатын оксид және хлор молекуласының химиялық белсендiлiгiмен анықталады. Хлорлау реакциясына диссоцияланған хлор молекуласы қатысады.
Хлорлы қышқыл оттегі және тұз қышқылында жеңіл ериді. Сумен бірге хлор құрамының дезинфекциялау және ағарту қасиеттері осы негізде құралған. Газ тәрізді хлор бейорганикалық суы жоқ еріткіштермен жақсы ериді:CCl 4 TiCl 4 SiCl 4 , SCL 4 .
Хлор химиялық белшенді, көптеген металдар мен және металл еместерден байланысып, хлоридтер түзейді. Оттегі, азот, көміртек, көміртек диоксидімен тікелей байланыса алмайды. Қалыпты жағдайға сәйкес суы болмаған кезде темірмен де байланыспайды, сондықтан да хлорды болат балондарында тасымалдайды.
Хлор сілтілермен суықта байланыста болып хлоридтер, гипрохлоридтер түзеді, ал жылыту барысында - хлоридтер және хлоратор түзеді. Аммиак және сутегі (> 4% H) қоспаларымен хлор байланысқа түссе, жарылу қаупін төндіру мүмкін. Аммиакпен хлор NCL 3 қалыптастырып, байланысады. >2% NCL 3 құрамды сұйық хлор жарылғыш қасиетін құрайды.
2. 3 Қайта тотықсыздандырусыз хлорлау
Өндірісте титан қожын хлорлау көміртегінің қатысымен жүреді. Бұл титанның екі тотығы өте аз мөлшерде жүруімен түсініріледі.
TiO 2 + 2Cl 2 => TiCl 4
Серяков деген ғалымның мәліметтері бойынша TiCl 4 концентрациясы берілген реакция үшін TiO 2 құрамы 0, 05% температура 727ºС және 0, 5% болғанда температура 1000 ºС.
Екі тотықты титанның аз тотығы қалпына келтірусіз тиімді хлорланады:
2TiO 2 + 2Cl 2 => TiCl 4 + TiO 2 (1)
2Ti 2 O 3 + 2Cl => TiCl 4 + 3TiO 2 (2)
Бұл реакциялар изобаралық процестердің қасиетін көрсетеді және хлорды толығымен әрекеттестіреді. Зеликман өзінің тобымен хлорлау процесін аз тотығының политермиялық шарттарын зертей келе, ТіО 215±5ºС -та, ал Ті 2 О 3 225±5ºС - та хлорлана бастауын анықтады. Титанның екі түрлі тотығында да хлорлау баспалдақ (сурет 1) тәріздес жүреді: (1) және(2) реакция бойынша, қисық хлорлауда ауданы анық белгіленген. 800ºС шамасында ТіО 2 - нің хлорлануы басталады, ал (1) және (2) реакцияға сәйкес. Бұндай шарттарда титан қожын қисықпен хлорлау Ті 2 О 3 - ті қисық хлорлаумен өте жақын болып келеді. Берілген жұмыстың авторлары изотермиялық хлорлауда (550ºС), ТіО мен салыстырғанда (1) реакциядан көрінеді. Ті 2 О 3 тотығы бірдей уақытта осы температурада (2) реакция және мына реакциямен
Ti 2 O 3 + 4Cl 2 => 2TiCl 4 + 3/2O 2
байланысады.
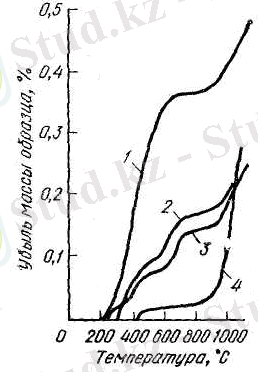
Сурет 1- Титан тотығы мен қожын политермиялық шартта хлорлау: 1- ТіО; 2- Ті 2 О 3 ; 3- титан қожы; 4- ТіО 2 .
Васютинский және Брежко титан қожын көміртегенсіз хлорлау процесін анықтайды. Зерттеу үшін титан қожының өндірістегі аносовитті түрін алған. Оның құрамы 49% ТіО 2 , 1, 1% ТіО, 35, 7% Ті 2 О 3 және 3, 4% ҒеО. Қожды хлорлау массаның өзгеруіне байланысты деп алынған. Тотықпаған титан қожын хлорлау процесі 200 ºС - қа жуық басталады және баспалдақ тәріздес қасиет көрсетеді (сурет 2) . Төмен температурадағы аймақтарда (200-700 ºС) аносовитті титан қожын хлорлау қоспаларының жартысына жуығының жойылуына (темір, магний т. б) әкеп соқтырады.
Титан қожын хлорлау жылдамдығы және қоспалардан бөлу кезеңі титанның аз тотығында жүреді. Хлорлау жылдамдығына фазалық өзгерістер де әсерін тигізеді. Мысалы: аносовит анатазаға және анатаз рутилға айналады.
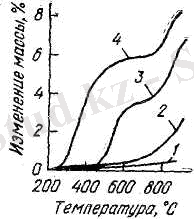
Сурет 2- Хлормен әрекеттесу салдарынан титан қожы мен қос тотығының массаларының өзгеруі: 1- Титан қос тотығы; 2- рутилға дейін тотыққан қож; 3- анатазға дейін тотыққан қож; 4- тотықпаған қож.
2. 4 Хлорлаудың микрокинетикасы
Титан қожын хлорлау кинетикасының зерттелуі аз. Көптеген зерттеушілер хлорлау кинетикасына титанның екі тотығын алуды ұсынады. Бұдан титан қожы өте күрделі және тұрақсыз, сонымен қатар, титан қожын хлорлауда белгілі кезеңдерде титанның тотығына айналуын байқауға болады.
Титанның екі тотығын көміртегінсіз хлормен хлорлау процесі 400 ºС - қа жуық температурада басталады. 500-600 ºС - қа дейінгі температурада реакция кинетикалық аймаққа өте бастайды. Температураның өсуіне байланысты реакция жылдамдығы жылдамдай бастайды. Кинетикалық аймақта энергияның белсенділігі 37, 5 ккал/моль.
Шамамен 500-700 ºС темепратурада хлорлу процесі өткізгіш ортаға өтеді. Температураның жоғарылауына орай, энергияның белсенділігі он бірлікке (ккал/моль) азаяды.
Морозов және Стефанюк (1 - сурет) хлорлаудың кинетикасын титанның қос тотығымен, көміртегі қоспасымен, газ тәріздес хлормен, парциал қысымды хлормен т. б факторларға, жылдамдықтың өзгерісіне байланысты деп қабылдаған. Бұл шарттарда температура біртіндеп көтеріледі және хлорлу жылдамдығы лезде көтеріледі, температура шамамен 550 ºС (сурет 3а), сонан соң біртіндеп төмендей бастайды. Авторлар 550 ºС хлорлау реакциясы кинетикалық аймақтан диффузилық аймаққа өтеді деп санайды. 600 ºС - та хлорлану жылдамдығы газ фазасына тура пропорционал (сурет 3б ) . Хлорлау реакциясы ТіО 2 локальді зонаға өтіп, біртіндеп қабаттың ішіне қарай енеді.

а б
Сурет 3- Температураның (а) және 600°C-тағы хлордың (б) титан қос тотығын хлорлау жылдамдығына әсері
2. 5 Хлорлаудың макрокинетикасы
Бұл титанды алудың ең көп тараған түрлерінің бірі. Ол - шахталы хлораторларда жүреді. Шахталы хлораторларда өндірісте қожды кесекшелер түрінде салады. Қожды хлорлау жылдамдығы макрокинетикамен анықтлады. Кесекшелерді хлорлау күрделі процестерге жатады. Олар келесі кезеңдерден тұрады:
- кесекшелердің үстіңгі қабатында хлордың диффузиялануы
- кесекшелердің тереңдігінде хлордың диффузиялануы
- газ тәріздес өнімдердің диффузиялануы хлордың титан тотығымен және көміртегінсіз басқа металлдармен байланысы
Титан қожының құрамындағы кесекшелерге титанның екі тотығынан басқа темір, марганец, магний, кальций, кремний тотықтары да кіреді. Шарт бойынша тотықтырғыштар бірінен соң бірі термодинамикалық потенциалға байланысты жүруі қажет
МеО + С+СІ 2 = МеСІ 2 + СО.
Зерттеу нәтижесі көрсетілген заңдылық титан қожының кесекшелерін хлорлауға арналған. Кесекшелерді хлорлау біртіндеп жүреді. Бірінші оңай хлрланатын титанның аз тотықтары хлорланады. Сонан соң титанның екі тотығы, ең соңынан кремнизе хлорланады.
Хлорлану зонаның тереңдігі кесекшелердің кеуектілігіне, титан қожының бөлшектерінің жылдамдығына, хлорлану температурасына байланысты. Жақсы кеуектерде хлорлану кесекшелері көбейеді, және кішігірім өлшемді кесекшклерде хлорлану лезде барлық көлемінде жүреді.
Серяков өз қызметкерлеімен кеекшелердің кинетикасын зерттеді. Кесекшелер қос тотықты титаннан, ыстан және қант шәрбәтынан дайындалды. Бұл тәжірибелер 350-500 ºС - та хлорлау теңесіп бүкіл кесекшелер көлемінде өтеді.
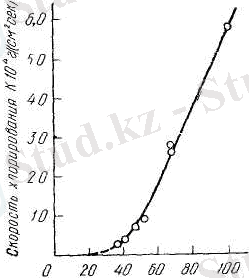
Хлорлау зонасының ені температура өскен сайын азаяды. Стефнюк, Зеликман және Левин 43 % көміртегінен тұратын кесекшені хлорлаған. 500 ºС - та хлолрлану зонасының көлемі шамамен 10 мм - ге артса, 960 ºС - та 2 мм - ге дейін азайған (Сурет 4) .
Хлорлау зонасының ені сонымен қатар престеуді күрделендірген сайын да қысқарып отырған. Тәжірибеден келесі теңдікті алуға болады
Х= Кτ m
Мысалы, көміртегі 43 % К=1, 23*10 -2 ; m=0. 58, ал көміртегі 22% К=0, 64*10 -2 ; m=0. 52.
Алдыңғы формула титанды хлорлау кинетикасына дәл келеді.
Титанның екі тотығынан, ыстан және қант шәрбәтінан дайындалған кесекшелерді хлорлау Серняков және қызметтестерімен анықталған болатын. 350-500ºС интервалында хлорлау кинетикалық аймақтрды өтеді және келесі теңдікпен анықталады
ln(1 - x t / x ∞ ) =- k’’t.
мұндағы: Х t - хлорлануға дейінгі ТіО 2 - нің саны
Х ∞ - процестің толығымен тоқтауына дейінгі ТіО 2 - нің саны
k’’ - хлорлау жылдамдығының константасы.
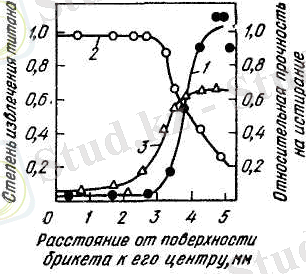
Сурет 4- Кесекшенің 850°C-да хлорлаудан кейінгі қасиеті мен құрамының өзгеруі:
1- Ұнтақтауға біршама төзімділігі; 2- титанды алу дәрежесі; 3- күл қалдығындағы ТіО 2 -нің мөлшері.
2. 6 Хлорлау процессінің техналогиясының жобасы
Құрамында титаны бар шикізатты хлорлаудың негізгі үш әдісі бар:
1) хлорлы тұздар ертіндісінде ұсақталған шихта (ерітетін хлораторларда) . 2) шихтаның қозғалмалы қабатындағы брикетті шихта(шахта типті хлораторларда) ;
3) Қайнаған қабаттағы ұсақталған немесе гранулданған шихта (қайнап тұрған қабаттағы хлораторда) .
Негізгі шикізаттың құрамына сезімтал келетін аппарат ерітпелі (тұзды) хлоратор. Хлорлау процесінде жеңіл еритін хлоридтер кальций және магний тұзды ертіндіде қалыптасады. Қалыпты қайнау шихтадағы кокс көлемін көбейту қажет. Дегенмен ерітетін хлораторда кремний диоксид құрамын, қиын хлорланатын формадағы мөлшерде өңдеуге болмайды, мысалы кварц.
Хлорлау барысында балқымада кварц жиналып, хлорлы тұздардың жүктелуін жоғарылатады және осыған сәйкес балқу мөлшері көбейеді. Көп қалдықты құрайды және қайта өңдеу кезінде көп шығын жұмсайды.
Жоғарғы кремний құрамымен шикізат, мысалға титанокремний концентраты, азғана сілтілер оксиді бар, сондықтан оны қайнау қабатына реакторында қолданады, әсіресе титан диоксидін хлорлау режимінде қолданады. Шикізаттың өте ұсақталуы қайнау қабатында жоғарғы күлдену салдарынан титанды жоғартуға әкеп соғады.
Жұқа дисперлі шикізат үшін қайнату қабатына грануляция қажет. Шахта типті хлараторларға брикетті шихта қолданады. Ерітетін хлораторларда хлорлау өзгелерден ерекше орын алады: хлор және темір мен кремний хлоридтерін жоғалту азаяды, хлорлау өнімі өте сапалы- техникалық, титан, тетлохлорнды, оның құрамында фоеген мүлдем болмайды.
Ерітетін хлораторларда хлорлау барысында көміртен диоксиді құралады, оның құрамында шығатын газдың мөлшері 40-50%
Қозғалмалы қабат реакторында көміртек мооксиді [40-50% мөлшер] құралады. Хлорды салу кезінде және хлорсыз қозғалмалы қабат реакторында ерітпелі хлораторлармен салыстырғанда шығатын газ мөлшерінің құрамында фосген көп мөлшерде түзіледі.
FeCL 3 реакциясы бойынша термиялық өндеуде шақ камераларында фосген қалыптаса алады. Бұл жағдайда каныққан хлор көмір мооксидпен әрекеттеніп, фосгенді құрайды.
Қазіргі уақытта барлық типтегі хлораторлардың өнімділігі бірдей. Қандайда бір аппаратты таңдап алу қиын. Дегенмен қозғалмалы және қайнау қабаты реакторында өнімділікті жоғарлату 100 т тетрахлорид күйіне өндіру техникалық қиыншылықтармен байланысты. Бұл реакторларда 3м диаметрлік шихтаға біркелкі хлор қабатымен қамтамасыз ету қиын. Еріту хлораторларында өнімділікті ұзарту арқылы болады (хлорлау бөлімінің көлемін өзгертпей) .
Экологиялық тұрғыдан алсақ, қайнау қабаты хлораторлар тиімді. Шахта типті хлораторларда хлорлы қалдықтар көптеп түзіледі, ал еріту хлораторында 1 тонна титан тетрахлоридтен 200килограм қалдық ертіндігі бөлінеді. Бұл хлорлау қалдықтары әзірше ешқайда пайдйнылмайды.
Хлорлау үшін шихтаны дайындау және өзіндік хлорлау. Хлорлау әдістеріне және хлоратар типіне байланысты шихта дайындалады.
-Ұнтақ тәрізді құрғақ шихта- ерітпелі хлоратарлар немесе қайнау қабаты үшін.
- Брикеттелген шихта- қозғалмалы қабатты реактор үшін:
Титан қожын әдеттеекі дережеде бөлу типтеріндебөледі, сосын жінішкелеп ұсақталады. Ұсақтағанан кейін қождан шойын ұнтақтайтын магнит сепараторымен бөледі.
Қалпына келтіруші ретінде нефть және лек көпесі қолданылады, ол да екі рет бөлінеді және ұсақталынады. Құрғақ шихтаны ұсату үшін, тоқпен ыстық ауа жүргізеді немесе бөлу алдында қожды және косты -500 0 С та қыздырады. Бұл судың көмірсутекгі булануына әсер етеді.
Балқыма үшін натрий хлрдің немесе магний электролизер электролиттерін қолдануға болады. Калий, магний, натрий хлоридтерді хлорлауға электролит ерітілген немесе құрғақ күйінде түсіруге болады. Құрғақ күйінде хлоратарға жүктеу алдында бөлінді керек.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz