Тотығу-тотықсыздану титрлеу әдістері мен индикаторлары: әдеби шолу және калий перманганатының қымыздық қышқылы бойынша титрін анықтау


Аннотация
Курстық жұмыстың әдеби шолуында тотығу-тотықсыздану титрлеу әдісіне, осы әдістің жіктелуіне, соның ішінде перманганатометрия, иодометрия және хроматометрия әдістері, титрлеу қисықтарының іс жүзінде қолданылуы қарастырылды.
Эксперименттік бөлімде:калий перманганатының ерітіндісін әзірлеп, оның титрін қымыздық қышқылы бойынша анықтап, есептеулер жүргізілді.
Курстық жұмыс 2-кестені, 1-суретті, 4- пайдаланған әдебиеттер тізімін қамтитын 27 баспалық беттен тұрады.
Мазмұны
Кіріспе . . . 5
1 Әдеби шолу . . . 7
1. 1 Редоксипотенциал және оның әр түрлі факторларға тәуелділігі . . . 7
1. 2 Редокс-реакциялар бағыты . . . 9
1. 3 Редокс-реакциялар жылдамдығы . . . 11
1. 4 Редокс-реакциялар индикаторлары . . . 15
1. 5 Титрлеу қисықтары . . . 17
1. 6 Тотығу-тотықсыздану титрлеу әдістері . . . 20
1. 6. 1 Перманганатометрия . . . 20
1. 6. 2 Иодометрия . . . 22
1. 6. 3 Хроматометрия . . . 23
2 Эксперименттік бөлім . . . 24
2. 1 Калий перманганатының ерітіндісін әзірлеу және оның титрін қымыздық қышқылы бойынша белгілеу әдістемесі . . . 24
Қорытынды . . . 25
Пайдаланған әдебиеттер тізімі . . . 26
Қосымша . . . 27
Кіріспе
Тотығу-тотықсыздану титрлеу әдістері әрекеттесуші заттардың тотығу дәрежесінің өзгеруімен байланысты реакцияларға немесе тотығу-тотықсыздану реакцияларына - редоксиметрия, оксидиметрияға негізделген.
Қазіргі уақытта тотығу-тотықсыздану титрлеу әдістері көптеп жасалған, олардың тиісті титрантты қолдануға негізделген. Ең кең тараған тотықтырғыштар перманганат, хромат (бихромат), ванадат, церий, бромат, иодат, иод, темір (ІІІ) және т. б. болып табылады. Тотықсыздандырғыштан жиі иод, тиосульфат, иодид, сутек пероксиді, темір (ІІ), аскорбин қышқылы және сирегірек басқа тотықсыздандырғыштар қолданылады. Тотықтырғыш және тотықсыздандырғыш тіке және кері титрлеу арқылы, сондай-ақ ауыспалы валенттіліктері болмайтын иондарды жанама анықтау үшін редоксиметрия әдісі қолданылады. Сондай-ақ орынбасу титрлеуі де қолданылады.
Оксидиметрияда стандартты ерітінді қолданылады, оларды даярлау аналитикалық химияның арнайы әдебиеттерінде және анықтамаларында егжей-тегжейлі жазылған.
Жүз мыңнан астам тотығу-тотықсыздану реакциялары белгілі, бірақ оның ішінде төмендегі талапқа жауап беретін реакциялар ғана пайдаланылады:
- олар соңына дейін тез және стехиометриялық түрде өтуі керек;
- белгілі химиялық құрамдағы (формулалар) өнімдер түзуі қажет;
- титрлеудің соңғы нүктесін дәл белгілеуге мүмкіндік болуы қажет;
- зерттелетін ерітіндідегі қосымша өнімдермен және басқа заттармен титранттар реакцияға түспеуі керек.
Бұл әдісте ерітіндідегі зат мөлшерін анықтау тотығу-тотықсыздану реакциялары нәтижесінде туындайтын тотығу-тотықсыздану потенциалдарының өзгерісіне негізделген.
Жүйеде туындаған тотығу-тотықсыздану потенциалының титрлеуші ерітінді көлеміне байланысты тұрғызылған тәуелділігі - титрлеу сызығын береді.
Эквиваленттік нүкте - титрлеу сызығының күрт өзгерісі - титрлеу секірмесі арқылы, индикатор қатысында анықталады.
Титрлеу барысында екі түрлі индикаторлар қолданылады:
- индикатордың бірінші түрі анықталатын зат немесе титрлеуші ерітінділермен түсті боялған қосылыс береді;
- индикатордың екінші түрі «редокс индикаторлар»-деп аталады және жүйедегі ЭҚК шамасы күрт өзгергенде өздерінің бояулы реңін басқа түске ауыстырады [1] .
1-кесте
Тотығу-тотықсыздану титрлеу әдісінің жіктелуі
Тотықсыздан
дырғыштар
(Red)
CrCl 3
TiCl 3
Редуктометрия
Хромометрия
Титанометрия
Тотықтырғыш
тар
Тотықтыр
ғыштар
(Ox)
KMnO 4
Br 2
KBrO 3
K 2 Cr 2 O 7
Ce(SO 4 ) 2
Оксидиметрия
Перманганатометрия
Бромометрия
Броматометрия
Дихроматометрия
Цериметрия
Тотықсыздан
дырғыштар
Курстық жұмыс тақырыбының өзектілігі: ерітіндідегі зат мөлшерін анықтау тотығу-тотықсыздану реакциялары нәтижесінде туындайтын тотығу-тотықсыздану потенциалдарының өзгерісіне негізделген тотығу-тотықсыздану титрлеу әдісін тереңірек қарастырудан тұрады.
Курстық жұмыстың мақсаты: тотығу-тотықсыздану титрлеу әдісі және жіктелуі жайлы, осы әдістегі реакцияларға қойылатын талаптар, индикаторлар жайлы ұғындыру.
Курстық жұмыстың міндеттері:
- аналитикалық химиядағы тотығу-тотықсыздану титрлеу әдісіне әдебиеттік шолу жасау;
- эксперименттік бөлімді орындау барысында тотығу-тотықсыздану титрлеу әдісін меңгеру;
- алынған нәтижелерді талдау.
1 Әдеби шолу
1. 1 Редоксипотенциал және оның әр түрлі факторларға тәуелділігі
Потенциал заттың тотығу-тотықсыздану қабілетінің өлшемі болып табылады.
Бір редоксожұптың потенциалын өлшеу мүмкін емес, сондықтан екі электрод потенциалдарының айырымын өлшейді. Негізгі салыстыру электроды ретінде стандартты (қалыпты) сутек электродын қолданады. Ол ұсақ дисперсті платина (қарайтылған платина) қабатымен қапталған платина пластинкасы болып табылады. Сутекті 1 атм қысым астында электродқа береді, онда ол адсорбцияланып атомдыққа айналады. Электрод активтіктері 1-ге тең сутек иондары ерітіндісімен жанасып тұрады. Стандартты электродтың потенциалын 0, 00 В (еркін шама) деп қабылдаған.
Стокгольм съезінде қабылданған таза және қолданбалы химия бойынша Халықаралық Одақтың (ИЮПАК) тиісті нұсқауларымен потенциалдың белгісі және электродтың реакциялардың жазылуы анықталады.
Егер заттың тотыққан түрі сутек ионына қарағанда күштірек тотықтырғыш болса, редоксожұптың потенциалы «+» белгісімен, ал тотықсызданған түрі сутекке қарағанда күштірек тотықсыздандырғыш болса «-» белгісімен жазылады.
Стандартты электродтық потенциалы Е 0 деп, берілген тотығу-тотықсыздану жүйесі стандартты жағдайға ие болатын потенциалды санайды: компоненттер активтігі 1-ге тең. Кестелерде, әдетте, стандартты электродтық потенциалдар мәнін келтіреді.
Жартылай реакция потенциалының оң шамасы қанша жоғары болса, редокс жұптың тотыққан түрі сонша күштірек тотықтырғыш болып табылады.
Мынадай ереже бар: редокс жұптың тотыққан түрі аз потенциалымен сипатталатын жұптың тотықсызданған түрімен әрекеттеседі (яғни, стандартты потенциалдар кестесінде төмен орналасқан түрі), бірақ потенциалы үлкен редокс жұптың тотықсызданған түрімен әрекеттеспейді.
Жүйедегі ерімтал компоненттердің концентрациясы өзгерген сайын потенциал шамасы стандартты потенциал шамасынан ерекшеленеді. Эксперимент жүзінде потенциалдың концентрацияға тәуелділігін, индикаторлық электродтан және потенциалы белгілі салыстыру электродынан тұратын ұяшықтың электр қозғаушы күшін өлшеп анықтайды. Редокс-жүйенің компоненттердің әр түрлі концентрацияларындағы электродтық потенциалының теориялық мәні Нернст теңдеуі бойынша есептеледі:
Нернст теңдеуі бөлме температурасында (25 0 ) қысқарады:
Кейбір жартылай реакциялар сутек иондарының қатысуында өтеді. Бұл жағдайда сутек иондарының концентрациясы Нернст теңдеуіне кіреді және жартылай реакция потенциалына әсер етеді. Егер сутек иондары реакия процесінде қолданылса, онда оның концентрациясы логарифм белгісінің астындағы бөлшектің алымына, ал Н + -иондары реакция нәтижесінде түзілетін болса, олардың концентрациясы сол бөлшектің бөліміне кіреді.
СІ 4+ +е - =СІ 3+ жартылай реакциясына сутек иондары тікелей қатыспайтынына қарамастан, бұл жүйенің қышқыл концентрациясы өскенде потенциалы артады, себебі мұнда күшті гидроизденетін төрт валентті церийдің гидролиздену дәрежесі кемиді де Се(ІV) бос иондарының концентрациясы артады [3] .
1. 2 Редокс-реакциялар бағыты
Тотығу-тотықсыздану реакциясын тіке бағытта өткізу мүмкіндігі туралы кестеден алынған тиісті редоксожұптың стандартты потенциалы бойынша жуықтап бағалауға болады. Редокс жұбының стандартты потенциалы үлкен зат тотықтырғыш, ал стандартты потенциалы кіші зат сәйкес тотықсыздандырғыш бола алатындығы туралы жалпы ереже бар.
Кез-келген реакцияның бағыты термодинамикалық шамадан келіп шығады. Егер Гиббс энергиясының өзгеруі 0-ден кіші болса ∆G<0, онда реакция өтуі мүмкін. Гиббс энергиясының өзгеруі редоксожұптың потенциалдар айырмашылығымен байланысты:
Демек, тотығу-тотықсыздану реакциясы жүру үшін ∆G теріс, ал ∆Е -оң болуы қажет, яғни тотықтырғыштық потенциалы, қарағанда оңырақ болуы керек. ∆G шамасы сәйкес ∆Е шамасы қанша үлкен болса, тепе-теңдік орнағанша реакция толық жүреді, тепе-теңдік екі редоксожұптың реальды потенциалдары тең болғанда орнайды:
2KMnO 4 +10FeSO 4 +8H 2 SO 4 =5Fe 2 (SO 4 ) 3 +2MnSO 4 +K 2 SO 4 +8H 2 O
бұл үшін
Осының негізінде реакцияның тепе-теңдік константасын бағалаймыз:
Демек, реакция тіке бағытта тепе-теңдік константасы 10 62, 7 -ге тең тең болғанша жүреді, тәжірибеде реакция толық солдан оңға қарай жүретінін осы үлкен шама көрсетеді. Үш валентті темір екі валентті марганецті тотықтыра алмайды.
Басқа мысал қарастырайық:
2HNO 2 +2J - +2H + =J 2 +2NO+2H 2 O
Бұл реакция үшін:
К шамасы жеткілікті үлкен болғандықтан, бұл реакция да толық солдан оңға қарай жүруі қажет. Бірақ, калий иодидінің және азотты қышқылдың бейтарап ерітінділерін араластырғанда, шамалы өзгерістер болады. Бұл реакцияның термодинамикасы мен кинетимкасы арасында байланыс жоқтығын дәлелдейді. Аталған реакция қоспаға тіпті шамалы ғана қышқыл қосқаннан кейін жүргені байқала бастайды, (NО) газ бөлініп шығады да, ерітінді қоңыр түске боялады (йод түзілуіне байланысты) .
Ескеретін жағдай екі реакцияда да термодинамикалық қайтымды реакцияларға жатпайды, олардың өту механизмі стехиометриялық теңдеуден көрінгеннен кейін әлде қайда күрделі. Келтірілген есептеулер жуықтап алынған мәліметтер.
Титриметриялық реакцияларға қойылатын талаптардың бірі - олардың қанағаттанарлық жылдамдығы болып табылады. Көбірек дәрежеде бұл тотығу-тотықсыздану реакциясына жатады. Сондықтан, қолданылатын реакциялардың кинетикасын және механизмін білу, оларды оптимальды режимде өткізу үшін жағдайлар талдауға көмектеседі [1] .
1. 3 Редокс-реакциялар жылдамдығы
Тотығу-тотықсыздану реакциясының жылдамдығы оларды өткізу жағдайына байланысты. Ол реакцияласушы заттардың концентрациясына, температурасына, рН-ына, катализатордың болу, болмауына тәуелді. Кебйір тез жүретін реакциялар өте сұйытылған ерітінділерде (<0, 0001 М) жай өтеді. Әрекеттесуші заттардың концентрациясы өскен сайын реакциясының жылдамдығы тиісті дәрежеде артады.
Вант-Гофф ережесі бойынша кез-келген химиялық реакцияның жылдамдығы температураны әрбір 10 0 -қа өсіргенде 2-4 есе артады. Бірақ бұл ережеден кейбір ауытқулар бар.
Ерітіндінің қышқылдығы мен иондық күші әртүрлі және олар бір-біріне тәуелсіз реакция жылдамдығына әсер етеді.
Бір жағдайда олар реакцияны жылдамдатады, екіншісінде тежейді, ал үшіншісінде-реакция жылдамдығына әсер етеді.
Тотығу-тотықсыздану әдісімен анализді нақты жағдай үшін оптимальды дәрежеде өткізуге ұмтылады.
Сондай-ақ, кейбір титранттардың белгілі жағдайларда тұрақсыздығын ескеру қажет. Қолданылатын реакциялардың жылдамдығын тіпті бірнеше ретке арттыруға мүмкіндік жасайтын катализатор кеңінен қолданылады. Егер катализатор реакцияның аралық немесе соңғы өнімдері болса, онда мұндай процесс автокатализ деп аталады.
Ерітінділердегі реакция жылдамдығына қысым тәжірибеде әсерін тигізбейді, бірақ жылдамдық пен тепе-теңдікті газ молекулаларының қатысуымен өзгертеді.
Жай өтетін реакциялардың жылдамдығын жоғарылату және калатизаторды таңдап алу үшін химик-аналитик процестің механизмін білуі қажет. Әдетте, бір электронның өтуімен қарапайым иондар арасында реакциялар тез және бір сатыда жүреді, мысалы:
Fe 2+ +Ce 4+ = Fe 3+ +Ce 3+
Егер бұл иондардың беретін және алатын электрондар саны әр түрлі және 1-ден көп болса, металдардың қарапайым иондарының арасындағы реакциялар жай және қиындау жүреді.
Иондардың құрылымдық өзгеріске ұшырайтын реакциялары бұдан да жай және күрделірек өтеді, мысалы:
Cr 2 O 7 2- +6Fe 2+ +14H + = 2Cr 3+ + 7H 2 O +6Fe 3+
Бұл реакцияның механизмі өте күрделі, бірнеше аралық сатыдан тұрады.
Ең мүмкін болатында моно- және бимолеулалық реакциялар. Үшмолекулалық реакциялар аздау, ал төртмолекулалық, оның үстіне үлкен қатарлы реакциялардың болу мүмкіндігі 0-ге жақын. Әрине жоғарыдағы теңдеулердің иондық реакцияның сол жағында стехиометриялық коэффициент саны 21 болғандықтан реакция бір сатылы болуы мүмкін емес. Шындығында, реакция бір және екі электрондық тасымалдау арқылы бірнеше сатыда тұрақыта және тұрақсыз иондар түзеді, мысалы хром (V) және (ІV) . Кинетикада реакцияның жалпы жылдамдығы, ең жай жүретін сатымен анықталады деген ереже бар.
Реакция механизмін, яғни оның барлық сатыларын, әсересе, жай жүретінін білу жеке реакциялар жылдамдығындағы айырмашылықты түсіндіруге, қажетті катализаторды таңдауға және осындай жолмен реакцияны тездету үшін жүру жағдайын өзгертуге, сондай-ақ реакцияның термодинамикалық қайтымдылығын орнатуға, сонымен қатар Нернст теңдеуін оған қолдануға мүмкіндік туғызады.
Өзара байланысқан екі немесе одан да көп қарапайым реакциялардан тұратын күрделі реакциялардың кинетикасы осы реакциялар арасындағы байланыстың түріне және олардың жылдамдықтарының арақатынасына тәуелді. Мұндай байланыс түрінің өкілдері параллель, жүйелі, іліктес және қайтымды реакциялар кинетикасы теңдеулері қолданылғанда, реакциялардың барлық класстарының теориясы осы ережеге сүйенеді.
B
A
C түріндегі реакциялар параллель деп аталады. Берілген бастапқы зат бір мезгілде әр түрлі бағытта әрекеттесуі мүмкін, мысалы:
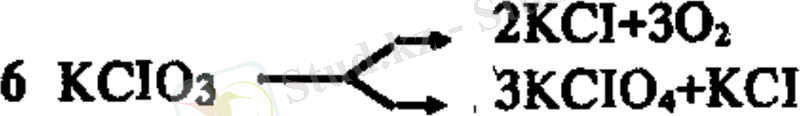
Кейбір радиоактивтік элементтер параллель екі бағытта ыдырайды. Параллель реакциялар органикалық химияда өте жиі кездеседі, мысалы, орто және пара туындылар түзілгенде.
Егер реакциялар жылдамдығының айырмашылықтары болса, онда әдетте, жылдамдығы үлкен реакцияны негізгі деп, ал қалғандарын қосымша деп атайды. Жылдамдықтары онша ерекшеленбегенде жылдамдығы аздау болса да, керекті негізгі өлшем алуға алып келетін реакцияны негізгі деп атайды.
Осы типтегі реакциялар кезектес реакциялар деп аталады, мұндағы В, С затты алу процесіндегі аралық өнім: к 1 және к 2 - өзгерудің екі сатысының жылдамдық константалары.
Жүйелі реакцияларда жалпы жағдайда сатылар саны екіден көп болуы да мүмкін және әрбір сатысы моно-, би- немесе сирегірек үшмолекулалық болады.
Жүйелі реакциялар кинетикасын есептеу жалпы түрде жеткілікте дәрежеде болса, онда реакцияның жалпы жылдамдығы осы сатының жылдамдығымен анықталады (анықтайтын саты-жылдамдығы) :
А+В→М(1) ; A+C→N(2)
Осы түрдегі реакциялар іліктес реакциялар деп аталады, бұлардан біреуі екіншісімен біргелікте өтеді, яғни ол соңғысымен индукцияланады. Бұл жағдайда С заты бірінші реакцияның индикаторы болады. Мысал ретінде темір (ІІ) сульфаты және НІ-иод сутек пероксидімен тотығуы бола алады. Ғе (ІІ) тотығуы Н болу-болмауына байланысты емес, ал металл иондары болмаса сутек пероксидімен тотықпайды. Темір (ІІ) болғанда сонымен бірге тотығады. Индиго ерітіндісі өзінен-өзі оттекпен әсер еткенде түссізденбейді, бірақ ерітіндіге бензальдегид қоссақ, онда соңғы оттекпен бензой қышқылына дейін, ал индиго изатинге дейін тотығады.
Индукциялық (химиялық) деп аталатын құбылысты Н. А. Шилов (1905) жан-жақты зерттеген. Екі реакцияға да ортақ А заты (келтірілген мысалдарды бұл сутек пероксиді және оттек) актор-деп, В заты-акцептор, ал С заты-индуктор деп аталады. Актордың индуктор мен акцептор арасында бөлінуі қатынасын оқып үйрену, берілген реакциялардың іліктестік сипатын анықтауға, тиісті жағдайларда аралық қосылыстардың түзілуі және олардың процестегі ролін айқындауға мүмкіндік береді.
Шилов іліктес реакциялар туралы бір ортада жүретін екі реакцияның өзара әсеріндей жалпы түрдегі ұғымды түжырымдады, олардың ерекшеліктерін де көрсетті, индуктордың концентрациясы уақытта байланыстылығына қарап, оларды үш топқа бөлді:
-индуктордың концентрациясы реакция кезінде кемиді;
-индуктордың концентрациясы өзгермейді (катализдік реакциялар) ;
-индуктордың концентрациясы өседі өздігінен тездейтігн, -автокатализдік реакциялар) .
Аралық қосылыстар түзілу фактін орнату және олардың химиялық реакциялар кинетикасындазғы мәні химиялық әрекеттесу механизмі мен реакцияның реттілігі туралы қазіргі ілімнің дамуында үлкен роль атқарады.
Кез-келген қайтымды реакцияның жылдамдығы тіке және кері реакциялар жылдамдығының арасындағы айырымға тең. Жалпы түрде мұндай реакциялар мына теңдеумен жазылады:
A+B+C→D+E+F
А затының концентрациясы жылдамдығының кемуі тіке реакция жүргенде (V 1 ), мына теңдеумен анықталады:
d CA /dt=k 1 [A] [B] [C]
Ал кері реакция (V 2 ) жүргенде А концентрациясының өсу жылдамдығы:
d CA /dt=k 2 [D] [E] [F]
Реакцияның жалпы жылдамдығы тіке және кері реакциялардың жылдамдықтарының айырымымен жазылады:
d CA /dt=k 1 [A] [B] [C] - k 2 [D] [E] [F]
Нәтижесінде және тең болатындай күйге жетуге болады, яғни:
k 1 [A] [B] [C] = k 2 [D] [E] [F]
немесе
Сонымен, химиялық реакциялар кинетикасы, әсіресе, тотығу-тотықсыздану реакциялары, зерттелетін әрекеттесулердің механизмін бағалайға, барлығына бірге титриметриялық анықтаулар жүргізу үшін тиімді жағдайды таңдап алуға мүмкіндік береді [1] .
1. 4 Редокс-реакциялар индикаторлары
Редоксометриялық анықтауларда эквиваленттік нүктесін әрекеттесетін компоненттің бояуының жоғалуынан немесе пайда болуынан индикаторлар көмегімен не физика-химиялық әдістермен анықтауға болады. Индикатор ретінде ерітіндінің бояуын өзгертетін тотықтырғыш немесе тотықсыздандырғышпен реакцияға түсетін заттардың ерітіндісін пайдаланады. Мысалы, крахмал иодтың шамалы мөлшері болғанда сорбциялық немесе комплекстік қосылыс түзе көк түске боялады. Тиоцианат иондары үш валентті темір иондарының артық мөлшерімен қызыл күлгін түсті комплексті қосылыстар түзеді.
Мұндай индикатордан басқа оксидиметриялық әдістерде жүйенің тотығу-тотықсыздану потенциалының шамасына байланысты өздерінің бояуын өзгертетін индикаторлар қолданылады [Қосымша А] .
Индикатор жүйенің редокс-потенциалына байланысты, яғни тотықтырғыш немесе әсерінен бір түрден екінші түрге өте алады, демек хромотроптық топтар пайда болатын немесе жойылатын құрылымы осыған байланысты түсінің өзгеруіне алып келеді. Редокс-индикатор ерітіндісінде тотыққан және тотықсызданған түрлері арасында тепе-теңдік пайда болады.
Ind ox +ne - = Ind Red
Индикаторлық жүйе потенциалын Нернст теңдеуі бойынша есептейміз:
... жалғасы
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz