Дәрілік препараттарды анықтаудағы тотығу-тотықсыздану реакциялары: перманганатометрия мен иодометрия және клиникалық метаболизмдегі қолданылуы


Қазақстан Республикасы Денсаулық Сақтау Министірлігі
Оңтүстік Қазақстан Мемлекеттік Фармацевтика Академиясы
ФГЗ және химия кафедрасы
СӨЖ
Тақырыбы:Дәрілік препараттарды анықтауда тотығу-тотықсыздану реакцияларының маңызы, клиникалық зерттеудегі дәрі-дәрмек заттардың метаболизмінде қолдану
Орындаған: Тазабек Қ
Тобы: 206 «А» ФК
Қабылдаған: Дильдабекова Л. А
2012-2013 оқу жылы
Жоспар:
І. Кіріспе
ІІ. Негізгі бөлімі
1 ) Тотығу-тотықсыздану реакциялары
2) Перманганатометрия және иодометрия.
3) Метаболизм барысында жанды ағзаларда пайда болатын кейбір уытты заттар
4) Нернст-Петерс теңдеуі
III Қорытынды
IV Пайдаланылған әдебиеттер
Кіріспе
ТОТЫҒУ-ТОТЫҚСЫЗДАНУ РЕАКЦИЯЛАРЫ
Заттардың құрамындағы атомдардың тотығу дәрежелері өзгере жүретін реакциялар тотығу-тотықсыздану реакциялары (ТТР) деп аталады. Мұндай реакциялар, міндетті түрде, тотығу мен тотықсыздану процестерінен құралады және тотықтырғыш пен тотықсыздандырғыштың қатысуымен орындалады.
Тотығу-тотықсыздану реакциялары туралы алғашқы түсініктерді орыс ғалымы Л. В. Писаржевский (1914ж) енгізген.
Реакция барысында электрондарын беретін атомдар, иондар және молекулалар тотықсыздандырғыш, ал электрондарды қосып алатын бөлшектер тотықтырғыш болып есептеледі. Реакция барысында электрондардың берілуі тотығуға, ал электрондардың қосып алынуы тотықсыздануға жатады. Сол себепті тотығу-тотықсыздану реакцияларының нәтижесінде тотықсыздандырғыш электрондарын беріп, тотығады, ал тотықтырғыш электрондарды қосып алып, тотықсызданады.
Тотықсыздандырғыш Тотықтырғыш
тотығады. - nе ↔︎ тотықсызданады.
Электрондардың тотықсыздандырғыштан тотықтырғышқа тасымалдануы барысында белгілі бір атомның, молекуланың немесе ионның тотығу дәрежесі өзгереді және тотығатын заттың тотығу дәрежесі жоғарылайды, ал тотықсызданатын заттікі - төмендейді.
Тотығу-тотықсыздану реакциялары үшке бөлінеді: молекулааралық, молекулаішілік, диспропорция.
Тотығу-тотықсыздану реакцияларын құрастыру және
теңестіру
Тотығу-тотықсыздану реакцияларын теңестңрудің екі тәсілі бар, электронды баланс жене ионды-электронды тәсілдері. Екі тәсілдің де негізі бірдей: ол - тотығу-тотықсыздану процесінде тотықсыздандырғыш берген электрон-дардың саны тотықтырғыш қосып алған электрондар санына тең болуы шарт. Ең әуелі электронды баланс тәсілі бойынша мынадай реакцияны теңестіріп көрейік.
Na 2 SО 3 +KMnО 4 +H 2 SО 4 → Na 2 SО 4 + MnSО 4 + K 2 SО 4 + H 2 О
Реакция кезінде тотығу дәрежсі өзгеретін элементтерді тауып, олардың үстіне жазамыз:
+4 +7 +6 +2
Na 2 SО 3 + KMnО 4 +H 2 SО 4 → Na 2 SО 4 + MnSО 4 + K 2 SО 4 + H 2 О
тотықсыздан- тотықтырғыш
дырғыш
S +4 - 2е = S +6
Мn +7 + 5е = Мn +2
Тотығу және тотықсыздану процесіне қатысушы заттардың коэффициенттері электрондык баланс тәсілінің шарты бойынша тотықсыздандырғыш берген, тотықтырғыш қосып алған электрондар санына тең болады:
5 S +4 - 2е = S +6
2 Мn +7 + 5е = Мn +2
Қысқартылған теңдеуден соң, реакцияның молекулярлық теңдеуін жазамыз.
5Na 2 SО 3 + 2KMnО 4 + 3H 2 SО 4 → 5Na 2 SО 4 + 2MnSО 4 + K 2 SО 4 + 3H 2 О
Осы келтірілген реакцияның теңдеуін енді ионды-электронды тәсіл бойынша қайта теңестіріп көрейік. Ол үшін реакцияға қатысатын, яғни тотығып, тотықсызданатын не байланысатын бөлшектерді ғана қалдырып, реакцияның иондык теңдеуін жазайық:
SО 3 2- + MnО 4 - + Н + → SО 4 2- +Мn 2+ + Н 2 О
Тотығу және тотықсыздану реакцияларының жартылай иондық теңдеулері түрінде жазамыз:
5 SО 3 2- + Н 2 О -2е = SО 4 2- + 2Н +
2 MnО 4 - + 8Н + + 5е = Mn 2+ + 4Н 2 О
Соңғы теңдеуде MnО 4 - анионындағы 4 оттек атомын байланыстыру үшін 8Н + керектігін бірдей ecкерiп жазамыз. Табылған коэффиценттерге теңдеулердің оң жағы мен сол жағын көбейтіп қоссақ, иондық теңдеудің теңескен түpi шығады:
5Na 2 SО 3 + 2KMnО 4 + 3H 2 SО 4 → 5Na 2 SО 4 + 2MnSО 4 + K 2 SО 4 + 3H 2 О
Перманганатометрия және иодометрия
Клиникалық, санитарлы-гигиеналық және соттық сараптау тәжірибелерінде, сол сияқты фармпрепараттарды тексеру істерінде мынадай әдістер жиі қолданылады.
Перманганатометрия әдісі
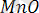 ионымен тотығуына негізделген. Тотығу процесін қышқылдық және сілтілік (немесе бейтарап) ортада жүргізуге болады.
ионымен тотығуына негізделген. Тотығу процесін қышқылдық және сілтілік (немесе бейтарап) ортада жүргізуге болады.
Қышқылдық ортада
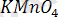
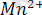 -ионына дейін тотықсызданады. Мысалы,
-ионына дейін тотықсызданады. Мысалы,
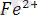 - иондарымен әрекеттесу реакциясы мына теңдеу бойынша жүреді:
- иондарымен әрекеттесу реакциясы мына теңдеу бойынша жүреді:
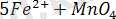 +
+
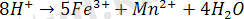
Сол себепті
М(
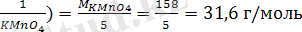
Сілтілік немесе бейтарап ортада Mn(VII) тотықсызданғанда, түзіледі:
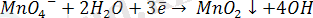
Сондықтан:
М
(
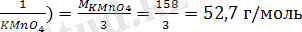
Калий перманганатымен титрлегенде, әсіресе қышқылдық ортада индикатор қолданылмайды.
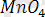 ионының қызғылт-күлгін бояуы оның түссіз
ионының қызғылт-күлгін бояуы оның түссіз
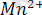 - ионына дейін тотықсыздануы нәтижесінде жойылмайтындығы белгілі. Тотықсыздандырғыш толығымен тотыққан, перманганаттың артық бір тамшысынан ерітінді ашық күрең түске боялады.
- ионына дейін тотықсыздануы нәтижесінде жойылмайтындығы белгілі. Тотықсыздандырғыш толығымен тотыққан, перманганаттың артық бір тамшысынан ерітінді ашық күрең түске боялады.
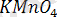 тің титрлегенде ерітіндісін дайындау мүмкін емес, сол себепті оның титрі басқа стандартты ерітінді (
тің титрлегенде ерітіндісін дайындау мүмкін емес, сол себепті оның титрі басқа стандартты ерітінді (
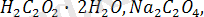 т. б. ) бойынша анықталады. Олардың арасында жүретін реакцияны былай көрсетуге болады:
т. б. ) бойынша анықталады. Олардың арасында жүретін реакцияны былай көрсетуге болады:
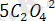 +
+
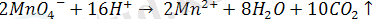
C(
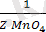 ) =
) =
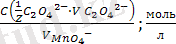
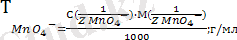
Перманганотометрия әдісі кальцийді, марганецті (II), темірді (II), сутегі пероксидін және нитриттерді анытау үшін, ал медициналық анализдерде сутегі пероксиді мен магнийдің, лактат пен кальций глюконатының және басқа фармпрепараттардың сапасын бақылау үшін қолданылады.
Иодометриялық әдіс
 пен
пен
 иондарының арасында жүретін тотығу-тотықсыздану процестеріне негізделген:
иондарының арасында жүретін тотығу-тотықсыздану процестеріне негізделген:

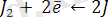
Иодометрия әдісін
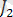 ерітіндісімен тотықтыру және
ерітіндісімен тотықтыру және
 иондарымен тотықсыздандыру үшін қолдануға болады.
иондарымен тотықсыздандыру үшін қолдануға болады.
- анықтауға, мысалы, тиосульфат-иондарды титрлеу жатады.


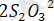 -2
-2
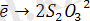 1
1
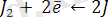 1
1
Көптеген реакциялар осыедай мысалдарға жатады:
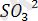 +
+
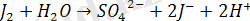
 +
+
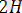 …. . т. б.
…. . т. б.
Иодометриялық анықтауларды да индикаторсыз жүргізуге болар еді, бірақ титрлеу соңында иодтың бояуы өте солғын болатын болғандықтан, эквиваленттік нүктені анытау қиын, сол себепті иодқа сезімтал ерітінді ретінде крахмалды қолданған өте қолайлы.
Тотықтырғыштарды анықтаудың өзіндік ерекшеліктері бар, себебі
 иондарының ерітіндісімен титрлегенде, эквиваленттік нүктені анықтау мүмкін емесғ сондықтан жанама әдіс - орын басу әдісі қолданылады. Бұл әдістің жалпы жобасын былай көрсетуге болады:
иондарының ерітіндісімен титрлегенде, эквиваленттік нүктені анықтау мүмкін емесғ сондықтан жанама әдіс - орын басу әдісі қолданылады. Бұл әдістің жалпы жобасын былай көрсетуге болады:
- Қышқыл +KJ (артық мөлшерде) +анықталатын тотықтырғыш
- (иодты натрий тиосульфатымен титрлеу. )
Мысал ретінде мынадай теңдеулерді келтіруге болады:
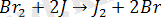
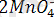 +
+
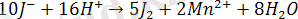

Иодометриялық әдісті сол сияқты қышқылды анықтау үшін де пайдалануға болады:
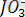 +
+

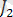 ерітіндісінің титрі натрий тиосульфаты, ал оның титрі калий бихроматы бойынша анықталады.
ерітіндісінің титрі натрий тиосульфаты, ал оның титрі калий бихроматы бойынша анықталады.
Иодометрия әдісін пайдаланып, әктегі белсенді хлорды, мысты, натрий арсенитіндегі мышьякты, сульфиттерді анықтауға болады.
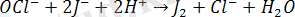

As
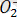 +
+
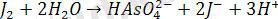
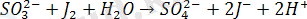
Иодометрия әдісі медициналық тәжірибеде несептегі, қан плазмасындағы, он екі елі ішек сұйығындағы диастаза ферментін анықтау үшін, сол сияқты көптеген фармпрепараттарға (сульфаниламидті, мышьякты, антипирин, анальгин, витаминдер, пенициллин және т. б. ) анализ жасау үшін қолданылады.
Перманганометрияны келесі мақсаттарда қолданады.
1. Тотықтырғыштарды және анықтауға;2. Тотығу-тотықсыздану қасиеттері жоқ заттарды анықтауға;
3. Органикалық қосылыстарды анықтауға.
Стандартты тотықтырғыш потенциалдарды өлшеу. Нернст-Петерс теңдеуі
Әртүрлі жұптардың тотықтырғыш потенциалдары тәжірибе жүзінде анықталғанда, олардың шамасы тотықтырғыш пен тотықсыздандырғыштың күшіне ғана емес, сол сияқты олардың концентрацияларының қатынасына да тәуелді болады.
Салыстырмалы нәтижелер алу үшін олардың концентрацияларын бірдей қылу керек немесе бірге теңестіру қажет. Алынған тотықтырғыш потенциалдар стандартты (қалыпты) тотығу-тотықсыздану потенциалдары деп аталады және Еº деп белгіленеді. Дәлірек айтатын болсақ, тотығу-тотықсыздану жүйесінің барлық компоненттерінің белсенділігі (концентрациясы) 1моль/л болған жағдайда өлшенген потенциал стандартпен тотығу-тотықсыздану потенциалы болып есептелінеді.
Стандартты потенциалдарды анықтау үшін әртүрлі тотығу-тотықсыздану жұптары стандартты жұппен жалғастырылып, гальваникалық элемент жасалады. Стандартты жұптың ролін сутектік электрод атқарады. Сутектік электрод
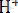 -иондарының концентрациясы 1моль/л, сутегінің қысымы 1атм. болып келген
-иондарының концентрациясы 1моль/л, сутегінің қысымы 1атм. болып келген
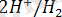 жұбынан тұрады. Бұл үшін ыдысқа
жұбынан тұрады. Бұл үшін ыдысқа
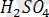 ерітіндісі құйылып, ұсақ дисперстелген платинамен көмкерілген платина электроды салынады. Ерітіндіге түтіктің бойымен сутегі жіберіліп, ол ұсақ дисперстелген пластинаның беткейінде адсорбцияланады.
ерітіндісі құйылып, ұсақ дисперстелген платинамен көмкерілген платина электроды салынады. Ерітіндіге түтіктің бойымен сутегі жіберіліп, ол ұсақ дисперстелген пластинаның беткейінде адсорбцияланады.
Стандартты сутектік электродтың потенциалы шартты түрде нольге тең болып есептелінеді. Осындай гальваникалық элементтің 25ºC температурада өлшенген ЭҚК стандартты тотығу-тотықсыздану потенциалы деп аталады. Оны пайдаланып, кез келген жүйенің тотығу-тотықсыздану потенциалын Нернст-Петерс теңдеуң бойынша есептеуге болады:
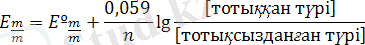
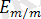 -
тотығу-тотықсыздану потенциалы;
-
тотығу-тотықсыздану потенциалы;
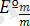 -стандартты тотығу-тотықсыздану потенциалы;
-стандартты тотығу-тотықсыздану потенциалы;
n -тасымалданған электрондардың саны;
[тотыққан түрі] - тотыққан түрінің концентрациясы;
[тотықсызданған түрі] - тотықсызданған түрінің концентрациясы;
Медицинадағы маңызы
Дәрілер дайындауда жеке компоненттердің тотығу-тотықсыздану қабілеттілігін білу қажет. Мысалы майда еритін витаминдерді дайындау кезінде оның ауадағы оттегімен жеңіл тотығуын ескеру керек. К-витамині тотығу кезінде белсенділігі өзгермейді, ал өнімдері тотығу кезінде улы. В-дәрумені сілтілі және бейтарап ерітінділерде, қатты дәрілік түрде де жеңіл тотығады, яғни әсіресе сілті ортада тотықтырғыш немесе тотықсыздандырғыш әсерінен ол белсенсіз күйге өтеді. Тотығу-тотығсыздану реакциялары тiрi организмдерде журетiн демалу және зат алмасу процестерiнiң, шiру және ашу, сол сиякты жасыл өсiмдiктердегi фотосинтез реакцияларының, адам мен жануарлардың жүйке кызметтерiнiң негiзiн калайды. Тотығу-тотығсыздану реакцияларын шикiзаттар жанғанда, металдардың коррозиясы және электролиз процестерi кезiнде де байкауға болады. Тотығу-тотығсыздану реакцияларының аркасында гальваникалық элементтер мен аккумуляторларда химиялық энергия электр энергиясына айналады.
Тотығу-тотықсыздану процестері табиғат пен ағзаларда мынадай қызметтер атқарады:
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz