Конденсирленген бензол сақиналары бар көп ядролы қосылыстар (нафталин): жіктелуі, құрылымы, физико-химиялық қасиеттері және химиялық реакциялары


КОНДЕНСИРЛЕНГЕН БЕНЗОЛ САҚИНАЛАРЫ БАР
КӨП ЯДРОЛЫ ҚОСЫЛЫСТАР (НАФТАЛИН)
Жіктелуі
Конденсирленген бензол сақиналары бар қосылыстарда әдетте көршілес сақиналардың екі көміртек атомдары ортақ. Мұндай қосылыстар сызықты ацендер (нафталин, антрацен, нафтацен) және бензол сақиналары бұрыш жасап байланысқан ангулярлы фендер деп бөлінеді. Егер бензол сақиналары үш ортақ көміртек атомдарымен байланысса, оларды пери-конденсирленген жүйелер (пирен) деп атайды.
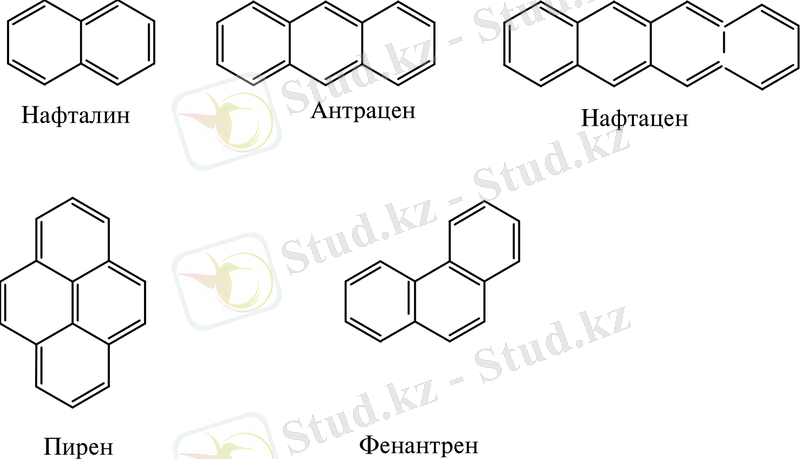
Конденсирленген бензол сақиналары бар көп орталықты қосылыстар азобояғыштар, антрохинонды бояғыштар және сцинтиляциялық есептегіштер үшін монокристалдар үшін қолданылатын аралық өнімдер алуда көп қолданыс табады.
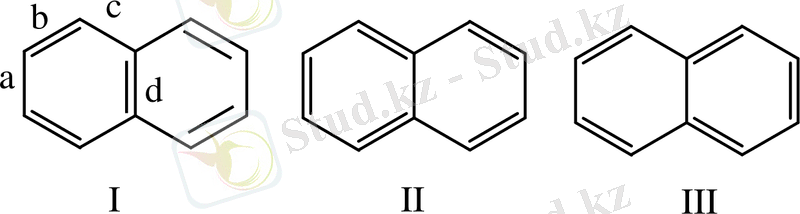
Нафталин. Нафталиннің құрылысы
Нафталиннің негізгі көзі - тас көмір нымын қайта айдау кезінде бөлінетін нафталинді май. Нафталинді майдың құрамында 10% -ке дейін нафталин болады. Нафталинді бензолдан бұрын 1819 жылы Гарден ашқан.
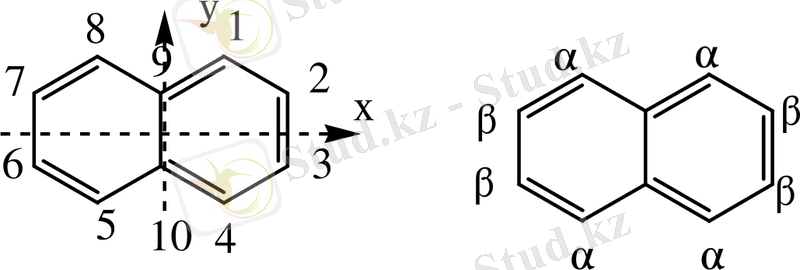
1866 жылы Эрленмейер мен Гребе тәжірибе жүзінде келісілген, жоғарыда келтілген структуралық формуласын ұсынды. Нафталиннің құрылымдық формуласы С 10 Н 14 және екі конденсирленген бензол сақиналарынан түрады.
Жоғары симметрия есебінен 1, 4, 5, 8 орындары‚ 2, 3, 6, 7 орындары сияқты бірдей тең.
1, 4, 5, 8 орындары - α, ал 2, 3, 6, 7 орындары - β деп аталады. Орынбасқан сутек атомы жоқ 9, 10 - орындарының аты жоқ.
α- және β- орындар тең дәрежеде емес, осыдан бензолға қарағанда нафталиннің орынбасарларының изомериясы күрделілек. Тіпті, бір орынбасарларына құрылымдық изомерия тән (α- немесе β-) .
Нафталиннің екі орынбасарларының изомериясы онан да күрделірек, себебі ондағы орынбасарлар бір немесе әр түрлі сақиналарда α - және β - жағдайларда орналасулары мүмкін.
Бірдей екі орынбасарлары бар төменде орналасқан топтардың он изомері бар:
1, 2-, 1, 3-, 1, 4-, 1, 5-, 1, 6-, 1, 7-, 1, 8- және 2, 3-, 2, 6-, 2, 7-.
Кейбір екі орынбасарлылардың атаулары бар.
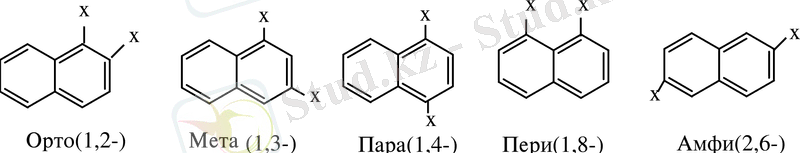
Әр түрлі екі орынбасарлары бар нафталиннің 14 изомері бар.
Нафталиндегі екі бензол сақиналарының тең дәрежелілігі химиялық жолмен дәлелденген, Нафталинді нитрлеу арқылы α-нитронафталин, ал оны тотықсыздандырып α- нафтиламин алған.
Бұл қосылыстарда бензол сақиналарының екеуі тең емес және тотығу реакциялары да әр түрлі жүреді. Өйткені тотығу электрон жоғалтумен жүретін болғандықтан, бірінші электрон тығыздығы жоғары сақина тотығады, яғни нитронафталинде - орынбаспаған, ал нафтиламинде аминтобы бар сақина.
Нафталин (нитрлеу)
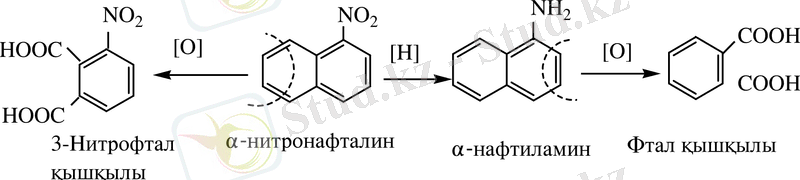
Тотығудың соңғы екі өнімінде де бензол сақинасы бар (3-нитрофтал және фтал қышқылы) түзіледі. Осыдан нафталиннің екі консирленген бензол сақиналары және о- жағдайдағы жалпы С атомдары бар формуласы шығады.
Газдық электронография және рентген сәулелерінің дифракциясы әдістері арқылы нафталин молекуласындағы С-С байланыстың тең емес планарлылығын шығарды.
Алынған нәтижелердің негізінде нафталинде жай және қос байланыстар жоқ және байланыстың екі типі бар екендігі туралы қорытынды жасауға болады: қос байланысқа жақын байланыстар 0, 136-0, 137 нм (1-2, 3-4, 5-6, 7-8) және қос байланыстың аз дәрежелі байланысы 0, 1415-0, 142 нм (сақинаның барлық қалған байланыстары)
Қызығы орталық байланыстың С 9 -С 10 ұзындығының (0, 142 нм) қос байланыс деп жазылған Эрленмейер - Гербтің құрылымдық формуласына сәйкес келмеуінде.
9-10 байланыстардың соншалықты төменгі реттілігі оны екі сақина арасындағы изолятор етеді.
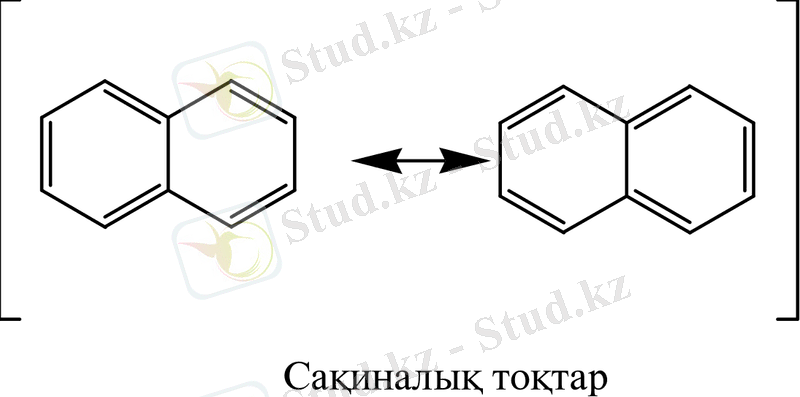
Егер, нафталин құрылысын резонанс теориясын қолдана отырып қарастырса да осындай қорытындыға келуге болады. Нафталиннің нақты құрылысы барлық көміртек атомдар sp - гибридтелген күйде болатын бірдей мөлшердегі үш қаныққан құрылыстың арақатынасы болып табылады.
Байланыстар π - сипаттама
а
с ⅓
d
в ⅔
Нафталин: ∆Еπ=255, 4 кДж/моль;
Екі бензол сақиналары: ∆Еπ=255, 4 кДж/моль
Нафталинде байланыстың тек екі типі бар; ⅔ π - және ⅓ π - сипаттама тән. Хюккель ережесі бойынша электрон саны 4n +2 болатын моноциклді, жазықты, толық түйіскен жүйелер ароматтыларға жатады. Электрон саны бойынша (10 π-) нафталин Хюккельдің ароматты жүйесі, бірақ моно- емес бициклды. Делокализациялану энергиясының (255, 4 кДж/моль) жоғарылылығы ароматтылық дәрежесін көрсетеді. Бензолдан айырмашылығы нафталинде байланыстардың толық теңестірілуі жоқ. Нафталинді «квазиароматты жүйе» деп атайды. Ароматтылық деп атайтын себебі, нафталин молекуласы тұрақты және ароматтылық қасиет көрсетіп, электрофильді орынбасу реакциясына түседі. «Квазиметриялы» (ароматтыға ұқсас) деп қосып алу реакцияларында диенді жүйе сияқты қабілетке ие болуына байланысты. Нафталинде екі диенді жүйе (С 1 - С 4 және С 5 - С 8 ) бар.
Нафталиннің физико-химиялық қасиеттеріНафталин - ақ түсті кристалды зат, балқу температурасы 80 о С, суда ерімейді, эфирде және басқа органикалық еріткіштерде жақсы ериді. Оңай айдалады.
ПМК-спектрлері нафталинде сақиналық токтың барлығын және оның ароматтылығын дәлелдейді. Протон сигналдары ароматты аймақта орналасқан: 7, 81м. д. (α =Н) және 7, 46 нм (β=Н) сақиналарын алыстатады, нәтижесінде моноциклді жүйе [10] - аннулен түзіледі және парамагнитті дезэкрандану байқалады.
Нафталиннің электронды спектрі үш сіңіру сызықтарымен сипатталады.
Нафталин сақанисына орынбасарларды енгізу үш сіңіру сызықтарының батохромды жылжуына әкеледі. α-орынбасарларды енгізген орнында көбінесе р-жолақ жылжиды, β - орнында α- және β- жолақтар. Бұл қысқа немесе ұзын өсі бағытындағы түйіскен жүйенің ұзындығының өсуімен анықталады.
Нафталинді алу:
Нафталиндегі барлық қажеттілік таскөмір нымын қайта өңдеумен қанағаттандырылады.
Нафталинді алуда оның құрылысын дәлелдейтін бірнеше әдістер қатары бар.
- Бензол гомологтарының дегидроциклденуі.
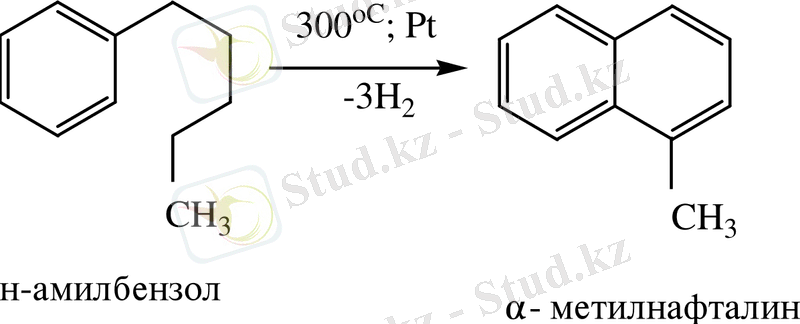
- 4-фенилбутен-1-дің дегидроциклденуі.
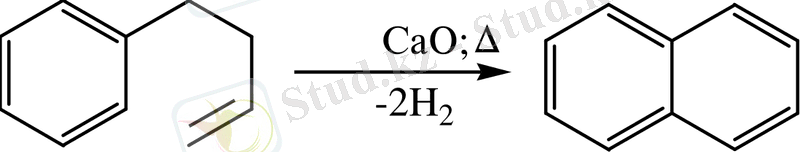
Бензолдың жағдайындағыдай нафталинге тән реакциялардың үш типі қарастырылады: қосып алу, тотығу және орынбасу. Негізгі мақсат ұқсастықтар мен айырмашылықтарды және реакция барысындағы нафталиннің ерекшеліктерін түсіндіру.
Қосылу реакциялары:
Қосып алу реакциясы бензолға қарағанда неғұрлым оңай жүреді, сонымен қатар қосып алудың аралық өнімдерінің бөлінуі де мүмкін. Оған Хюккельдің МО әдісімен есептелген радикалды қосып алу қабілетін сипаттайтын бос валенттілік индекстері дәлел бола алады:
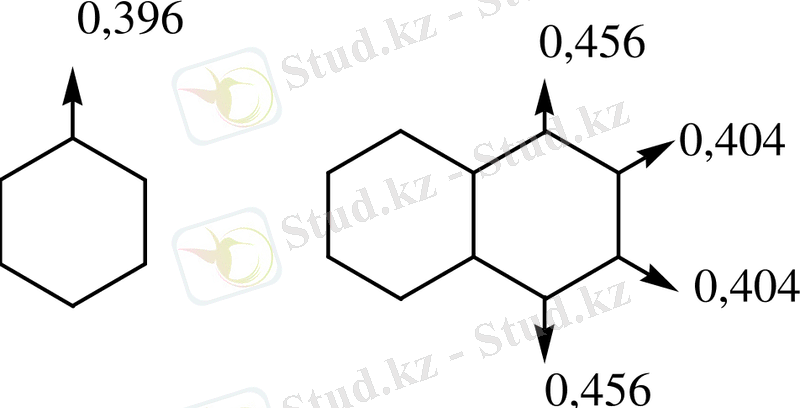
Индекстердің негізінде нафталинде қосып алу 1, 4-жағдайда оңай жүретініне қорытынды жасауға болады.
а) Электрон тарту, анион - радикалдар
Нафталиннің сұйық аммиак, эфир, тетрагидрофуран сияқты еріткіштердегі сілтілік металдармен әрекеттесуі бөлме температурасында тұрақты жасыл түсті анион-радикалдардың түзілуіне әкеледі.
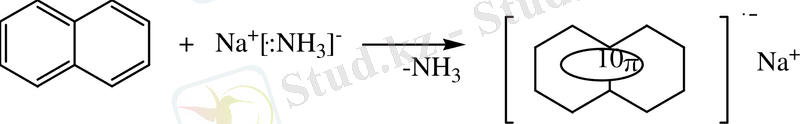
жасыл (нафталин-натрий)
Ион -радикалдардың болуы спектрлеріндегі сызықтар бөлінбеген электрон жұбының болуынан байқалатын ЭПР әдісінің көмегімен орнатылады. УК-спектрлерде ұзын толқынды жолақтар пайда болады, өйткені нафталиннен айырмашылығы анион-радикал боялған.
б) Нафталиннің гидрленуі
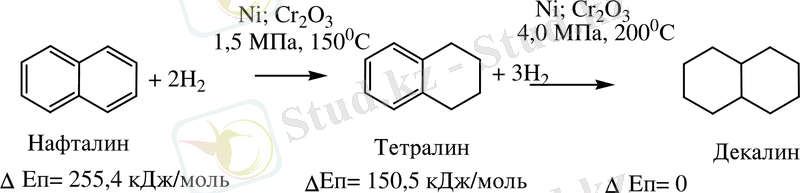
Нафталиннің гидрленуі сатылап жүреді және реакция жағдайына байланысты аралық өнімдер алуға болады. Молекулалық сутекпен гидрлеу VIII топ металдарының қатысуымен жүреді.
Бірінші ретті гидрлеу өнімі - тетралин екі моль сутекті қосып алғанда түзіледі. Бензолдан айырмашылығы нафталиннің бірінші сақинасы неғұрлым оңай гидрленеді, өйткені бір сақинаның ароматтылығын бұзу кезіндегі делокализациялану энергиясы бар жоғы 104, 6 кДж/мольді құрайды. Тетралин бензол сияқты қиын гидрленеді және бірден сутектің үш молін қосып алады.
Тетралин (қайнау температурасы 205 - 207 С) өндіріс көлемінде шығарылады және жоғары температурада қайнайтын еріткіш, жағатын май және мотор отынына қоспа ретінде қолданылады. Ным, балауыздарды, майларды, битумдарды, каучуктарды, бояғыш пленкаларды т. б жақсы ерітеді. Тетралин активті α-сутекті атомдармен бензол гомологтарының қасиетін көрсетеді. Декалин органикалық қосылыстар мен полимерлерді ерітуде қолданылады.
в) Нафталинді спирттердегі активті металдармен тотықсыздандыру
Бензолға қарағанда айырмашылығы нафталин протоны бар еріткіштердегі (спирттер) активті металдармен әсер еткенде гидрленеді. Бұл жағдайда нафталиннің «квазиароматтылық» қасиеті көрінеді және бірінші сатыда нафталин өзін түйіскен 1, 3-бутадиен сияқты көрсетеді және егер тотықсыздандыруды этил спиртінде жүргізсе тотықсызданудың ьіріншілік өнімін алуға болады. Егер қайнау температурасы неғұрлым жоғары амил спиртін қолданса, онда тетралин алынады. Реакция механизмі Берч реакциясының жағдайындағы тотықсыздануға ұқсас. Түзілген аралық анион-радикал протонды қосып алады. Қалған радикал анионға айналады және қайта протонданады.
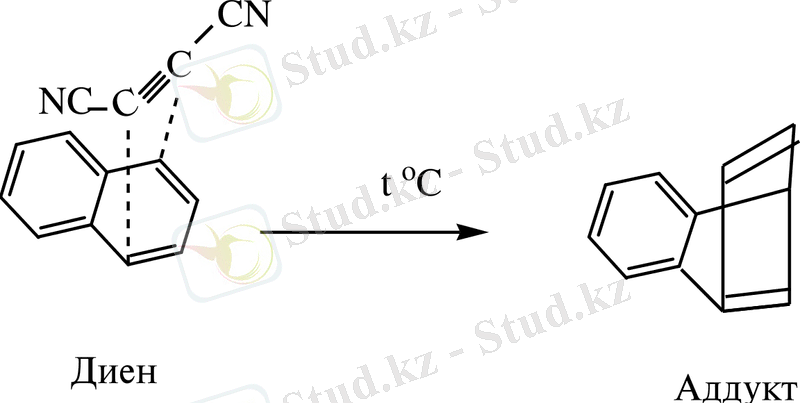
г) Диенді синтез
Нафталиннің диенді жүйесі Дильс-Альдер реакциясында да барлық байланыстары теңдестірілген бензолдағы ұқсас реакциялармен салыстырғанда оңай жүреді.
д) Нафталинді галогендеу
Нафталинді галогендеу катализатордың қатысынсыз УК-сәулесімен әсер еткенде тізбекті радикалды механизм бойынша жүреді. Бром молекуласы 1, 4-жағдайда қосылады. Алынған өнімнің тұрақтылығы төмен және бромсутектін жоғалтып ароматты жүйеге дейін тотықсызданады. Сонғы өнім α- бромнафталин.
Нафталиннің тотығуыНафталиннің ауадағы оттегімен каталитикалық қуатты тотығып фтал қышқылына гидролизденетін фтал ангидридін береді.
Көрсетілген жағдайда екі о-карбил тобының болу салдарынан электрон жетіспеушілігі бар екінші сақина ешқашан тотықпайды. Фтал ангидриді - көп тонналы өнім. Өндірістік фтал қышқылын (эфир, амид т. б. ) трифенилметанды бояғыштар, глифталды нымдар, дәрілік препараттар т. б. алу үшін қолданылады.
Электрофильді орынбасу реакцияларыНафталиннің ароматтылық қасиеттері электрофильді орынбасу реакцияларымен сипатталады. Ерекше қызығушылықты бензолға қарағанда да күрделі бағытталу тудырады. Нафталиндегі барлық көміртек атомдарының электрондық тығыздықтары бірге тең және статистикалық есептеулер α- және β- көміртек атомдарының шабуылдануына түсінік бере алмайды. Түсу орны динамикалық фактормен анықталады:
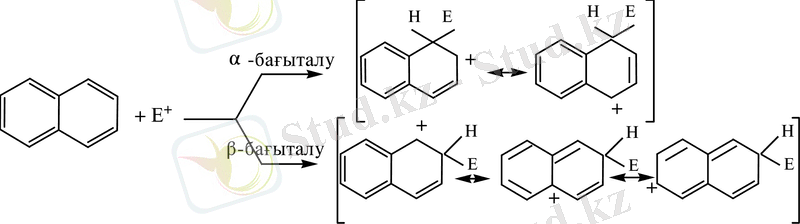
Нафталиннің электрофильді орынбасу реакциясы бензолға қарағанда оңай жүреді. Бұл электрофильді орынбасу реакциясының қатарында бензолдың еріткіш ретінде пайдаланылуымен түсіндіріледі. Электрофильді реагент көбінесе α- жағдайды шабуылдайды, екінші сақинаның ароматтылығын бұзбай, бірінші сақинаның зарядының делокализациялануы арқылы неғұрлым тұрақты -комплексті түзеді. β- жағдайға бағытталу қолайсыз, себебі нәтижесінде бүкіл жүйенің ароматтылығы бұзылады.
Егер нафталин сақинасында орынбасар болса, онда сақинадағы электрон тығыздығы жоғары және төмен орындар болады. Егер орынбасардың мезомерлі әсерін ескерсек бағытталуды болжау қиын емес. Бірақ, нафталин сақинасындағы бағытталу өте күрделі және оны үнемі болжау мүмкін емес. Барлығы молекуладағы бір сақинадан екіншісіне электрондық эффектіні нашар өткізетін, қос байланыстық дәрежесі аз С9 - С10 байланыстың болуымен күрделенеді. Осының нәтижесінде орынбасар неғұрлым орынбасқан сақинаға көп әсер етеді, ал бұл әсер екінші сақинада соншалықты көп болмайды.
Орынбасар орынбаспаған сақинаға түскен жағдайда динамикалық фактор анықтаушы болып табылады және орынбасар электрон тығыздығы төмен болған жағдайда да α- орынға барады. Әсіресе бағытталу сульфирлеу, Фридель-Крафтс реакциялары жағдайында күрделі.
α- жағдайдағы орынбасу жылдамдығы β-жағдайға қарағанда жоғары, бірақ β- изомер термодинамикалық жағынан неғұрлым тұрақты. Сондықтан қайтымды реакциялар жағдайында құрамы температура, катализатор, еріткіш және т. б. факторлармен анықталатын изомерлер қоспасын алады. Нафталин Льюис қышқылдарының қатысында 1-хлорнафталин түзіп, бензолға қарағанда оңай хлорланады. Хлорлану ары қарай электротехникада диэлектрик ретінде қолданылатын қатты перхлорнафталинге дейін жүруі мүмкін.
Нитрлеу 50 о С температурада нитрлеуші қоспа қатысында оңай жүреді және аздаған β- изомерлі қоспасы бар α- нитронафталиннің түзілуіне әкеледі. Екінші нитротоп орынбаспаған сақинаның α-жағдайына келеді.
Динитронафталиндер - суда нашар, оганикалық еріткіштерде жақсы еритін, сарғыш түсті қатты өнімдер. 1-нитронафталиндер және динитронафталиндер азобояғыштар алуда кең қолданылатын 1-нафтиламин және нафтилендиаминдерге тотықсызданады. α-нитронафталин аса маңызды емес, тотықсызданғанда кансерогенді 2-нафтиламин түзеді. Ол қазіргі кезде өндірістен алыныптасталған.
Қайтымды сульфирлену реакциясы нақты қаралды. Реакция жағдайына байланысты α- және β- алуға болады. Төменгі температурада (60 о С) моногидраттан α-изомер алады. Бұл жағдайда α- сульфоқышқыл гидролизденбейді. Жоғары температурада (160 о С) көбіне β-нафталинсульфоқышқылы алынады.
Қатаң жағдайда α- сульфоқышқыл гидролизденеді және нафталин β-жағдайда сульфирленеді, яғни молекуларалық қайта топтануы (десульфирлену-сульфирлену) болады. Тұрақтылығы төмен α- изомер термодинамикалық тұрақты β- изомерге айналады.
Төменде нафталиннің сульфирленуінің потенциалдық қисығы келтеріледі. Төменгі температурада реакция бағыты кинетикамен анықталады және тұрақтылығы төмен α- изомер оңай түзіледі. Жоғары температурадынегізгі ролді термодинамика ойнайды. Жоғары температурада тепе-теңдікті неғұрлым тұрақты изомер
β- сульфоқышқылдық түзілу жағына ығыстырады, бірақ түзілу жылдамдығы төмен. α- және β-жағдайдағы сульфирлеу реакциясының жылдамдығы шамамен 5:1 қатынасындай болады.
Екінші және үшінші сульфотоптарды енгізу үшін біршама қатаң жағдайлар керек. Сульфотоп о- және п-жағдайлардағы электрон тығыздығын төмендете отырып сақинаны дезактивтендіреді, сондай-ақ м-жағдайдағы электрон тығыздығы да төмендейді.
С 9 - С 10 байланыстың қос байланыстылық дәрежесінің аздығынан сульфотоптың екінші сақинаға тигізетін әсері елеусіз. Алмастырылмаған сақинаға сульфотоптың келетін орны динамикалық фактормен анықталады, яғни аралық сатыда тұрақты -комплекстің түзілуімен.
α- 1, 5- және 1, 8 -дисульфоқышқыл алуға болады, бірақ құрылымындағы қиындық пери (1, 8-) қышқылды алуға мүмкіндік бермейді.
α- сульфирлегенде реакциялық массада 1, 5-изомерден басқа 1, 7- және 1, 7-дисульфоқышқыл болады. Олардың түзілуін 1, 5-изомердегі бір сульфотоптың гидролизденуі мен β- жағдайдың сульфирленуімен түсіндіруге болады.
Қайта топтастыру нәтижесінде ядролары әр түрлі α- және β-дисульфоқышқылыдң түзілуі гидролизге ұшырамайтын олеумді сульфирлеу процесінде дисульфоқышқылдардың ішінде бояғыштарды алуда аралық өнім алу маңызды болып табылатын 1, 5-изомердің түзілуімен дәлелденеді. β-сульфоқышқылды сульфирлеген жағдайда барлық төрт ядролары әр түрлі изомерлер: 2, 5-, 2, 6-, 2, 7-, 2, 8- түзіледі, бірақ ұзақ уақыт қыздырғанда тек екі β, β- дисульфоқышқылдар (2, 6- және 2, 7-) ғана қалады.
Нафталин туындылары және олардың орынбасу реакциялары Нафтолдар1-нафтол тас көмір нымының құрамында болады. 2-нафтолды алу үшін β- натрий тұзының сілтілік балқымасын қолданады. 2-нафтолды балқымадан тұз немесе күкірт қышқылымен қышқылдау арқылы бөліп алады.
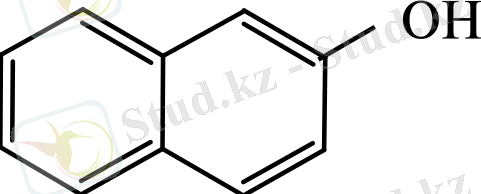
2-нафтол (б. т. 122 о С )
1-нафтолды алу үшін 1- 2 изомердің қоспасының болуы салдарынан сілтілік балқыту қолданылмайды. Тазалығы жоғары 1-нафтолды 1-нитронафталинді тотықсыздандырғанда шығарылатын 1-нафтиламиннің тұздарын қышқылдық гидролиздеу арқылы алады. Өзінің химиялық қасиеттері бойынша 1-нафтол фенолды еске түсіреді. 1-нафтол фенолға қарағанда екі есе қылқылырақ, өйткені ОН-топтың нафталиндегі диенді жүйемен түйісуі бензол сақинасымен түйісуіне қарағанда күштірек: КНА = 10 (фенол), КНА = 10 (1-нафтол) .
Фенолдар сияқты нафтолдар да хлорлы темірмен түс береді және енолды формада болады (100%) . Фенолдар сияқты нафтолдар да алкилденеді, ацилденеді және фенолға қарағанда да оңай жүретін электрофильді орынбасу реакцияларына түседі.
1-нафтол сілтілік ортада азобайланыстырушы реакцияларына түседі, арилдиазони катионы ОН-топқа п-жағдайда түседі.
2-нафтолда 2-орындағы ОН-тобы 1-орынды белсендендіреді, екінші сақинадағы 6, 8-орындардың елсенділігі елеусіз. Ерекшелігі екі о-жағдайы да белсенді және тең фенолға қағанда екінші о-жағдай (3-оырн) инертті. Бұл ерекшеліктің негізгі себебі - С2-С3 байланыстардың қос байланыстық дәрежесінің аздығы және олар арқылы электрондық әсердің берілуінің нашарлығы. 2-нафтол азобояғыштар мен каучук және резеңкенің тұрақтандырғышы - N-фенил-2-нафтиламин алу үшін қолданылады. «Яра-яра» және «нералин» деп аталатын 2-нафтолдың метил және этил эфирлері парфюмерияда сабынның компоненттері ретінде қолданылады. Барлық нафтолдар түссіз, суда нашар, сілтілерде жақсы еритін кристалды заттар. Олардың негізгі қолданылу аймағы - азобояғыштар алуда.
НафтиламиндерНафтиламиндер өздерінің қасиеттері бойынша анилинді еске түсіреді.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz